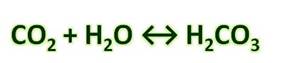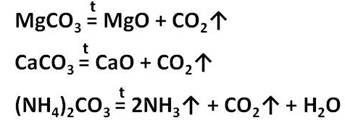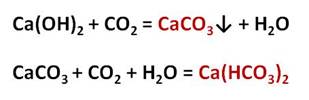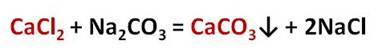- Угольная кислота. Получение угольной кислоты.
- Получение угольной кислоты.
- Угольная кислота. Карбонаты. Жёсткость воды
- Урок 27. Химия 9 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Угольная кислота. Карбонаты. Жёсткость воды»
- Угольная кислота — свойства, получение и применение
- Физические и химические свойства
- Способы получения
- Особенности применения
- Использование в сельском хозяйстве
- Средняя стоимость
Угольная кислота. Получение угольной кислоты.
Получение угольной кислоты.
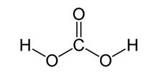
При растворении углекислого газа образуется угольная кислота, причем в растворе присутствует равновесие:
В природе не встречается, очень неустойчива и легко распадается.
Угольная кислота двухосновная и образует 2 типа солей: кислые (гидрокарбонаты) и средние (карбонаты).
Качественная реакция на присутствие H2CO3: воздействие сильных кислот на соли H2CO3, в результате чего улетучивается СО2:
При пропускании углекислого газа через известковую воду выпадает белый осадок:
Только карбонаты щелочных металлов и аммония, а также гидрокарбонаты, растворимы в воде.
Если через выпавший осадок пропустить углекислый газ, то из нерастворимого карбоната образуется растворимый гидрокарбонат:
Гидрокарбонаты при температуре разлагаются на СО3 2- , Н2О и газ:
Карбонаты (кроме щелочных металлов) при темпеатуре распадаются:
Основное значение из всех солей имеет сода, из которой получают различные кристаллогидраты: Na2CO3·10H2O (наиболее устойчив, называется кристаллической содой), Na2CO3·7H2O, Na2CO3·H2O.
Источник
Угольная кислота. Карбонаты. Жёсткость воды
Урок 27. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Угольная кислота. Карбонаты. Жёсткость воды»
Угольная кислота. Карбонаты. Жёсткость воды
Угольная кислота образуется при растворении оксида углерода (IV) в воде. Эта кислота нестойкая и почти сразу распадается на исходные вещества – углекислый газ и воду.
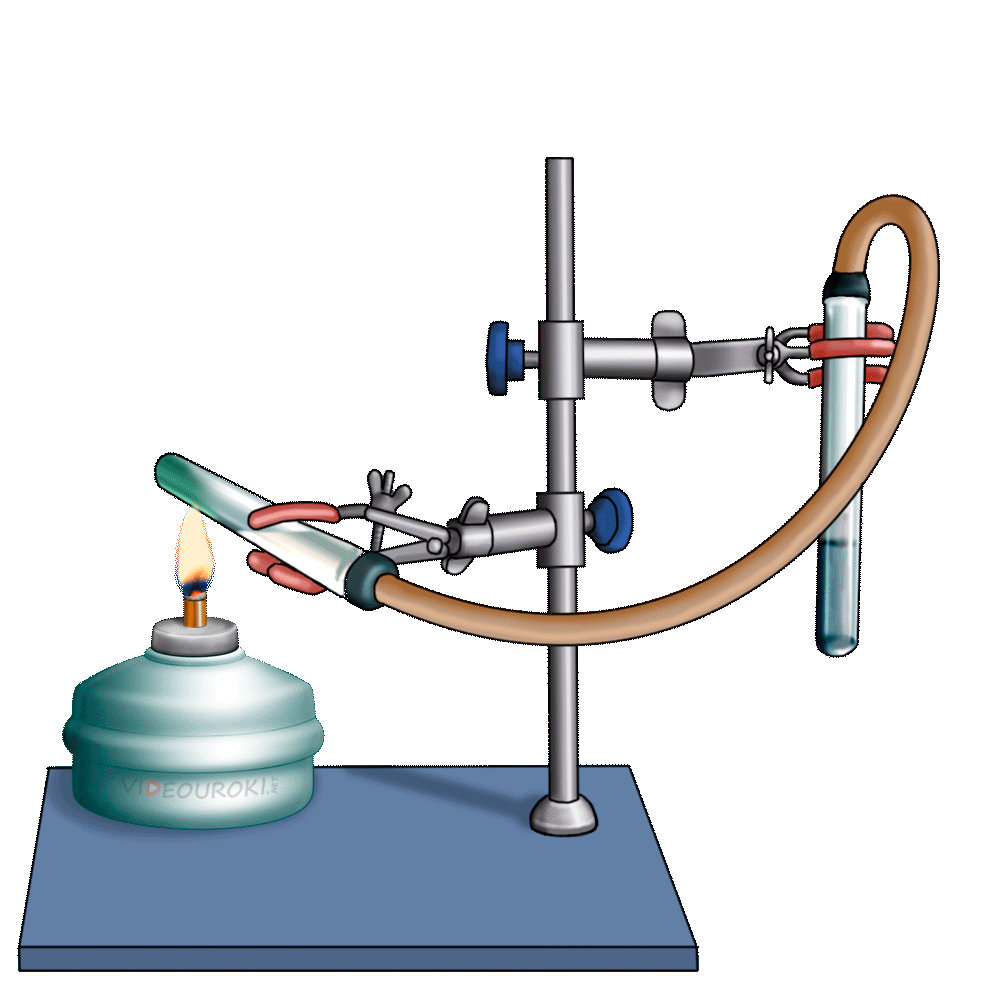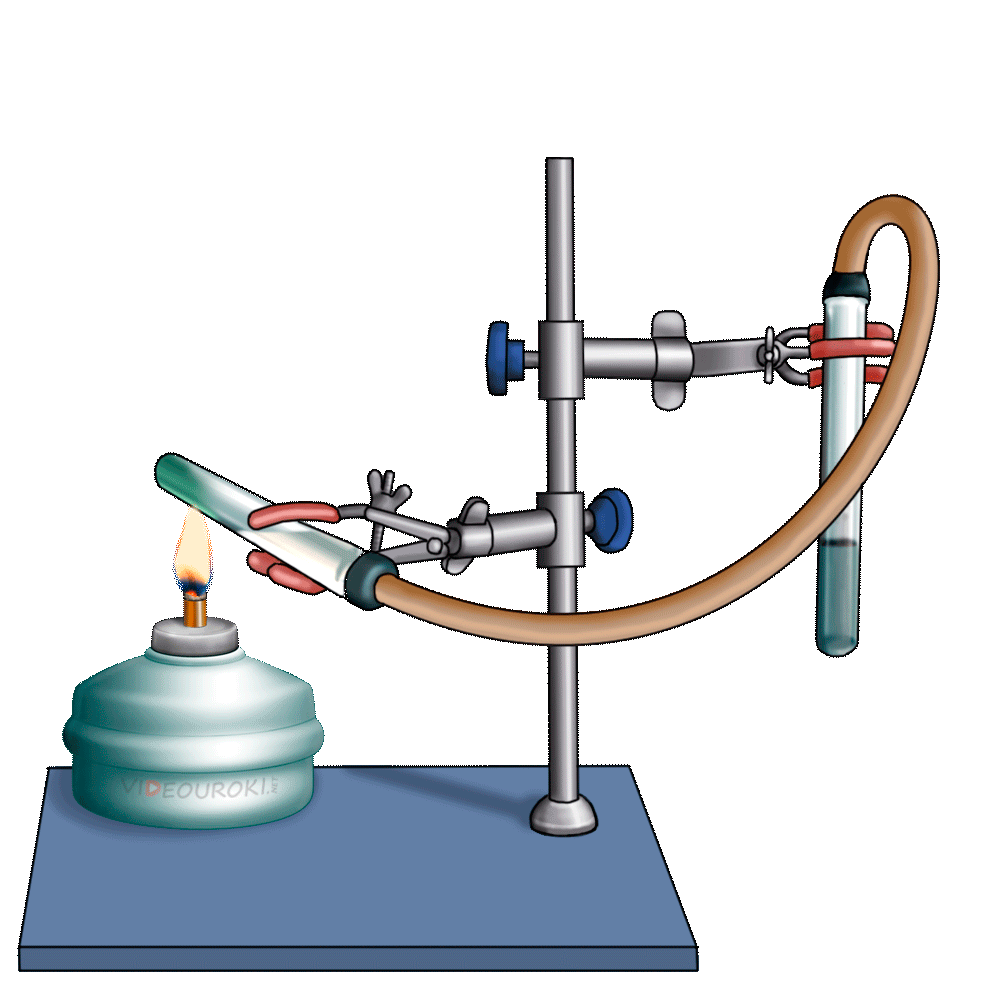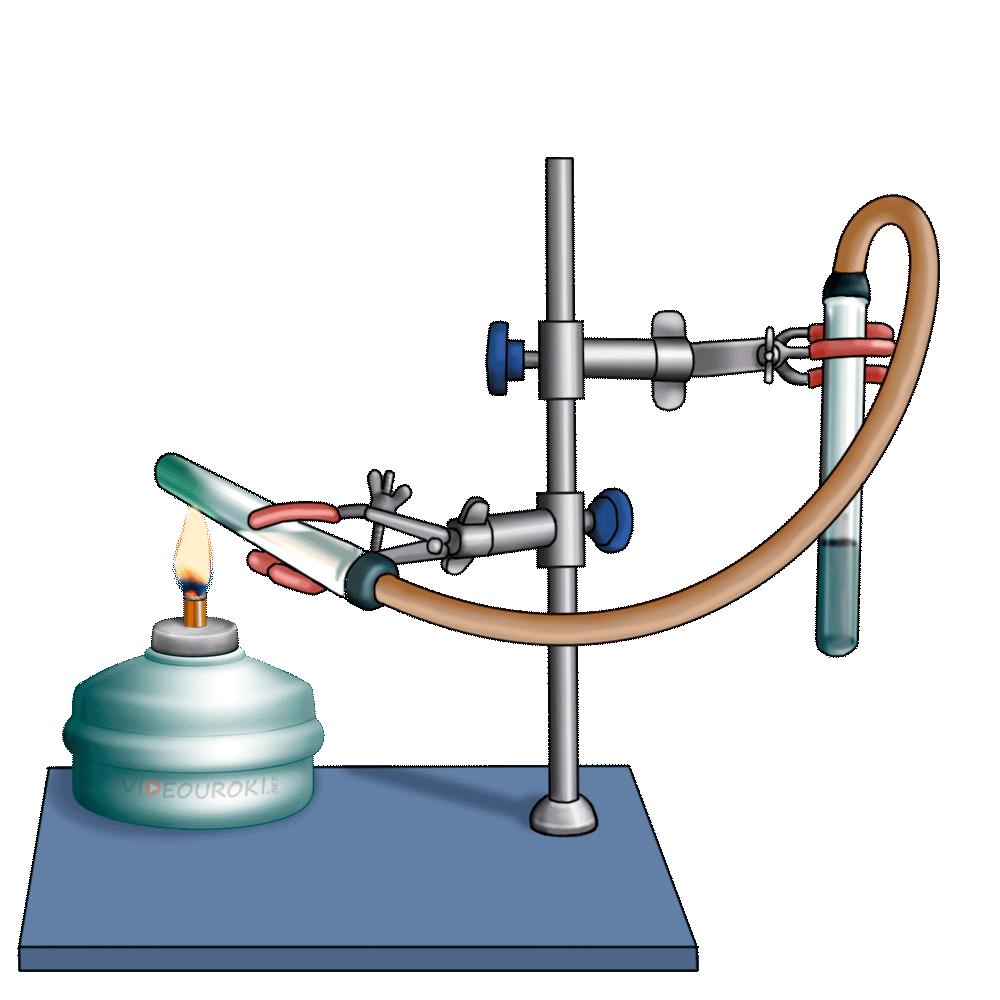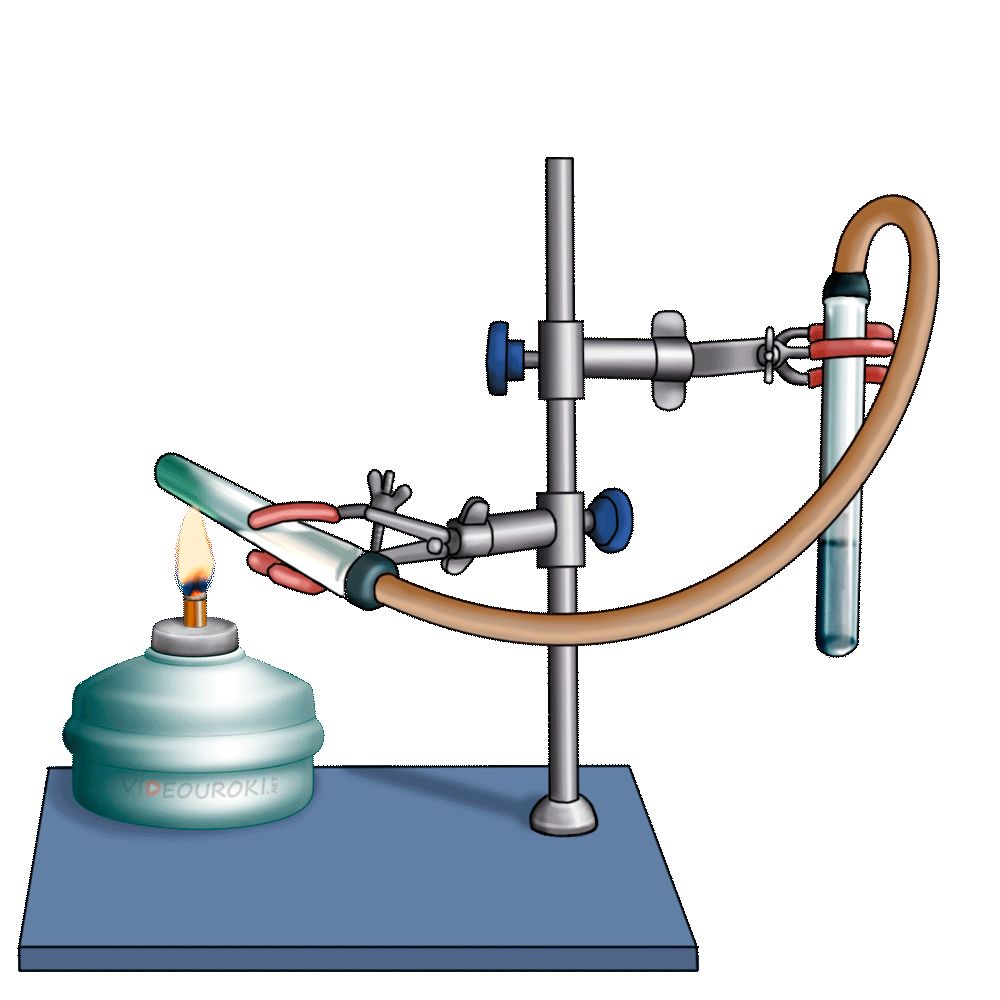
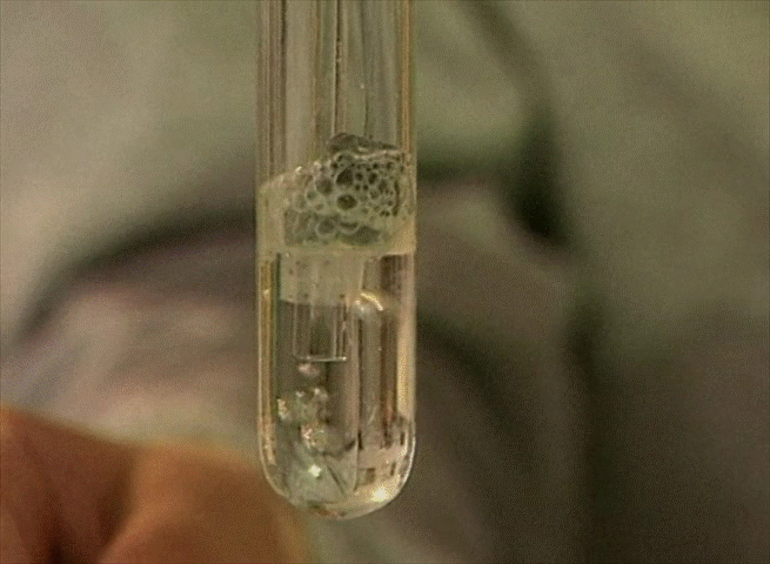
Получим угольную кислоту и исследуем её свойства. Собрав прибор для получения газов и проверив его на герметичность, следует поместить в пробирку кусочки мрамора и прилить соляной кислоты. После чего мы можем наблюдать выделение газа, который следует пропустить через воду с лакмусом. При этом видно, что лакмус изменил окраску с фиолетовой на красную. Но через некоторое время лакмус опять меняет свою окраску с красной на фиолетовую, потому что образовавшаяся угольная кислота является нестойкой и через некоторое время распадается на исходные вещества – углекислый газ и воду.

Как двухосновная кислота угольная кислота диссоциирует по двум ступеням: на первой ступени образуется ион водорода и гидрокарбонат-ион, а на второй – ион водорода и карбонат-ион:
Угольная кислота образует два типа солей: средние – карбоната и кислые – гидрокарбонаты. Например, CaCO3 – карбонат кальция, Ca(HCO3)2 – гидрокарбонат кальция. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Карбонаты других металлов нерастворимы в воде и при нагревании разлагаются на оксид металла и углекислый газ. При разложение карбоната магния образуется оксид магния и углекислый газ, а при разложении карбоната кальция образуется оксид кальция и углекислый газ. При нагревании карбоната аммония образуется аммиак, вода и углекислый газ.
Кислые соли растворимы в воде.
Карбонаты могут превращаться в гидрокарбонаты: если через них пропустить углекислый газ в присутствии воды. Например, если через известковую воду пропускать углекислый газ, то сначала известковая вода мутнеет, вследствие образования карбоната кальция, но при дальнейшем пропускании углекислого газа помутнение исчезает, потому что карбонат переходит в гидрокарбонат.
Наличием гидрокарбонатов кальция и магния в природной воде объясняется её временная жёсткость. В жёсткой воде плохо мылится мыло, трудно стирать бельё, плохо развариваются овощи. Если нагреть растворимый гидрокарбонат кальция, то образуется снова карбонат кальция – нерастворимая в воде соль.
Эта реакция приводит к образованию накипи на стенках котлов, чайников, труб парового отопления. В природе в результате этой реакции в пещерах формируются свисающие вниз сталактиты, навстречу которым снизу вырастают сталагмиты.


Другие соли кальция и магния, такие как хлориды и сульфаты, придают воде постоянную жёсткость. Для её устранения нужно использовать карбонат натрия – Na2CO3 – соду, которая переводит ионы кальция в осадок. Например, в реакции хлорида кальция с карбонатом натрия образуется нерастворимая соль – карбонат кальция и хлорид натрия. Таким образом, карбонат натрия перевёл растворимую соль кальция – хлорид кальция, в нерастворимую – карбонат кальция.
Соду можно использовать и для устранения временной жёсткости.
Качественными реакциями на карбонаты и гидрокарбонаты являются реакции этих солей с кислотами. Например, если в расвтор карбоната натрия добавить соляной кислоты, то происходит «вскипание» раствора, из-за образовавшегося углекислого газа. То же самое можно наблюдать при добавлении соляной кислоты к гидрокарбонату натрия.
Из солей угольной кислоты наиболее широко применяют кристаллическую соду – Na2CO3 ∙ 10H2O, кальцинированную соду – Na2CO3 – в стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтеперерабатывающей и других отраслях промышленности, а в быту её используют как моющее средство.
Сода была известна человеку примерно за полторы – две тысячи лет до нашей эры, а может быть и раньше. Её добывали из содовых озёр и извлекали из месторождений. Первые сведения о получении соды путём упаривания воды озёр относятся к шестьдесят четвертому г н. э. и приведены в сочинениях древнеримского врача и ботаника Диоскорида Педания о лекарственных веществах.
Питьевая сода – NaHCO3 – применяется в медицине, хлебопечении, пищевой промышленности, питьевая сода входит в состав наполнителя для огнетушителей.
Карбонат калия, или поташ – K2CO3 – используют для получения мыла, в фотографии, в качестве удобрения, при изготовлении тугоплавкого стекла.
Известняк, или мрамор – CaCO3 – используют в строительстве как облицовочный и строительный материал. Он необходим для получения извести, его вносят в почву для понижения кислотности, мел необходим для побелки, а также в стекольной, резиновой и других областях промышленности.
Таким образом, угольная кислота – это двухосновная слабая неустойчивая кислота, которая образуется при растворении в воде углекислого газа, она диссоциирует по двум ступеням, поэтому образует два типа солей – карбонаты и гидрокарбонаты, карбонаты многих металлов нерастворимы в воде и при нагревании разлагаются, а гидрокарбонаты – это растворимые соли. Карбонаты можно перевести в гидрокарбонаты и наоборот. Для перевода карбоната в гидрокарбонат через карбонат пропускают углекислый газ в воде, а при нагревании гидрокарбонатов образуются карбонаты. Различают временную и постоянную жёсткость. Временная жёсткость обусловлена наличием гидрокарбонатов кальция и магния и устраняется кипячением, постоянная жёсткость обусловленая наличием других солей кальция и магния, и устраняется добавлением соды. Качественными реакциями на карбонат и гидрокарбонат-ион является действие кислот на эти соли, при этом наблюдается бурное выделение углекислого газа. Карбонаты и гидрокарбонаты многих металлов находят широкое применение во многих отраслях народного хозяйства.
Источник
Угольная кислота — свойства, получение и применение
Физические и химические свойства
Угольная кислота способна существовать в равновесии с диоксидом углерода в водных растворах. Однако при изменении условий, в частности, температуры, этот карбонатный класс склонен распадаться, одновременно происходит окисление гидроксида. Также встречается безводная форма, которая представляет собой небольшие бесцветные кристаллы, образующиеся при температурах ниже минус 30 градусов. При ее нагревании происходит диссоциация угольной кислоты, при которой твёрдая форма полностью разлагается.
Соляный ангидрид свое название получил из-за формулы угольной кислоты, в которой содержится СО2. Газ может подвергаться обратному гидролизу, создавая устойчивую кислую среду. В растворах, содержащих эти элементы, возникает равновесная сложная система, которая сохраняет свою химическую формулу и физические свойства. При повышении температуры стабильность и равновесие такого раствора нарушается, а кислота начинает разлагаться. Полностью этот процесс завершается при кипячении водного раствора.
Угольная кислота, графическая формула которой выглядит как H2CO3, имеет нейтральную реакцию, образуя кислые и средние соли, в том числе гидрокарбонаты и карбонаты. На сегодняшний день это вещество отлично изучено, химикам известна степень, молярное уравнение, масса, константа и степень валентности. Такие соединения получили широкое распространение в пищевой промышленности, их используют в качестве консервантов и раскислителей, а также в бытовой химии для изготовления различных чистящих и моющих средств.
Способы получения
Наибольшее распространение на сегодняшний день получила технология изготовления кислоты угольной путем растворения в воде структурной газовой формы диоксида углерода. Для производства этих соединений используют соответствующие установки, позволяющие увеличивать давление углекислоты, одновременно понижая температуру раствора. В подобных условиях концентрация угольной кислоты увеличивается и в последующем имеется возможность получения твердой формы за счёт понижения температуры до отметки -35 градусов и ниже.
Также в последние годы популярностью стала пользоваться технология производства солей путем взаимодействия гидрокарбонатов и карбонатов с еще более сильными кислотами. При этом лучшая часть полученных соединений разлагается на диоксид углерода и воду. Преимуществом такой технологии является простота используемого оборудования, не требуется одновременно охлаждать растворы и повышать давление CO2, но при этом отмечается большое количество отходов. Недостатком этой технологии является то, что требуется утилизировать углеродный диоксид, который превращается в пар.
Используемые сегодня высокотехнологичные установки позволяют получать чистую кислоту угольную, в особенности при применении технологии с экстремально низкими температурами. В последующем необходимо лишь обеспечить правильное хранение кристаллов, которые при температурах выше минус 30 градусов начинают растворяться, быстро теряя все свои свойства. Также возможно производство и последующее хранение различных солей на основе этого соединения, которые сохраняют свою форму и параметры даже при положительных температурах и доступе воздуха.
Особенности применения
Угольная кислота и её соли сегодня активно используются в различных сферах жизнедеятельности человека. Они применяются в медицине, строительстве и кулинарии. Без этих микроэлементов невозможно было бы получение и возникновение следующих составов и материалов:
- мраморный камень;
- известняковые породы;
- кристаллическая и пищевая сода;
- мел;
- поташ.
Также из кислоты угольной получают углекислый газ, который требуется для изготовления газированной воды. Свойства этих соединений изменять показатели давления в зависимости от содержания ионов и кислотности позволяют на их основе выпускать хладагенты для морозильников и солнечных генераторов.
Такие кислоты и соли широко используются в пищевой промышленности, они полностью безопасны для организма человека. Из нее делаются разнообразные консерванты, которые не ухудшают свойства продуктов питания, существенно продлевая их срок хранения. Это соединение используется в качестве антиокислителя, его добавляют в кофе, чай и сыры. С открытием этой кислоты появилась возможность изготавливать разнообразные шипучие напитки, в том числе минералку, Coca- Cola и даже шампанское.
В последние годы широкое распространение получила литиевая соль, которую изготавливают из этой кислоты. Она применяется для производства керамических изделий, также ее добавляют в топливо для реактивных двигателей. Сегодня это химическое соединение активно применяется в стекловарении. На его основе выполняют специальные добавки, которые повышают прочность и эксплуатационные характеристики конечного материала. Силикатное стекло, в которое была добавлена литиевая соль, отличается не только прочностью, но и великолепными показателями проницаемости светового потока.
Кислоту угольную активно используют пожарные бригады, что позволяет им эффективно бороться с огнём. В жидком виде такие соединения содержат в специальных емкостях, после чего под высоким давлением направляют в распылители, смешивая со специальными химикатами, образующими густую пену. Это позволяет не только бороться с открытым пламенем, но и быстро тушить горящую нефть и различные нефтепродукты.
Использование в сельском хозяйстве
Кислота угольная сегодня широко используется в сельском хозяйстве для производства различных качественных минеральных удобрений. Это экологически чистые компоненты, которые применяются для подкормки различных овощных, фруктовых и плодовых культур, позволяя существенно повысить показатели урожайности.
На основе кислоты угольной выполняются следующие минеральные удобрения:
- кальцинированная сода;
- литиевая соль;
- карбамид или мочевина.
Наибольшее распространение сегодня получила мочевина или как она стала сегодня называться карбамид. Это простое в использовании эффективное удобрение, которое отличается универсальностью. С одинаковым успехом его можно вносить под плодовые деревья, фрукты и овощи, различные декоративные растения.
Несомненным преимуществом таких удобрений на основе угольной кислоты является доступная стоимость минеральных составов, их простота использования, эффективность и полная экологичность.
Средняя стоимость
На сегодняшний день в России имеется несколько крупных производителей кислоты угольной, которые изготавливают как соли, так и чистые вещества. В среднем стоимость одного килограмма такого соединения составляет 3−4 тысячи рублей.
Также востребован мел, который изготавливают с использованием этой кислоты, он применяется в кормовых и технических целях. За одну тонну мела обычно просят 1200 рублей.
В редких случаях используется так называемый угольный снег, то есть кристаллы твердой формы этой кислоты. Они имеют крайне высокую стоимость, доходящую до 10000 рублей за килограмм и более. При этом необходимо обеспечить соответствующие условия хранения, в том числе поддержание температуры на уровне минус 30−35 градусов, что предупреждает его разложение. Это соединение применяется в химической промышленности, а также при производстве разнообразных продуктов питания.
Источник