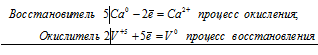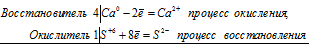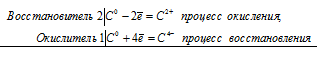- Реакция кальция с водой
- Реакция взаимодействия кальция с водой.
- Уравнение реакции взаимодействия кальция с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Химические и физические свойства кальция, его взаимодействие с водой
- Характеристика кальция как простого вещества
- Физические свойства кальция и способы получения металла
- Химические свойства кальция
- Реакция воды с кальцием
- Гидрид кальция: способы получения и химические свойства
- Способ получения
- Химические свойства
- Характеристика химических свойств кальция
Реакция кальция с водой
Реакция взаимодействия кальция с водой.
Уравнение реакции взаимодействия кальция с водой:
Кальций взаимодействует с водой.
В зависимости от температурного режима, избытка или недостатка воды реакция кальция с водой протекает по-разному.
2Ca + H2O → CaO + CaH2 (t = 200-300 °C).
Первая реакция протекает при обычных условиях и избытке воды , вторая – при условии: при температуре 200-300 °C и недостатке воды .
В результате первой реакции кальция с водой образуются гидроксид кальция и водород , в результате второй реакции кальция с водой образуются оксид кальция и гидрид кальция .
В ходе первой реакции кальция с водой при стандартных условиях выделяется тепловая энергия (теплота).
Таким образом, первая реакция кальция с водой носит экзотермический характер.
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 485)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 492)
- Метан, получение, свойства, химические реакции (23 734)
- Этилен (этен), получение, свойства, химические реакции (22 819)
- Природный газ, свойства, химический состав, добыча и применение (21 169)
- Крахмал, свойства, получение и применение (20 575)
- Целлюлоза, свойства, получение и применение (19 425)
- Пропилен (пропен), получение, свойства, химические реакции (19 106)
- Прямоугольный треугольник, свойства, признаки и формулы (18 729)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Химические и физические свойства кальция, его взаимодействие с водой
Почему металл хранят в герметичной банке
Кальций располагается в четвертом большом периоде, второй группе, главной подгруппе, порядковый номер элемента — 20. Согласно периодической таблице Менделеева, атомный вес кальция — 40,08. Формула высшего оксида — СаО. Кальций имеет латинское название calcium, поэтому символ атома элемента — Са.
Характеристика кальция как простого вещества
При обычных условиях кальций — это металл серебристо-белого цвета. Имея высокую химическую активность, элемент способен образовывать множество соединений разных классов. Элемент представляет ценность для технических и промышленных химических синтезов. Металл широко распространен в земной коре: его доля составляет около 1,5 %. Кальций относится к группе щелочноземельных металлов: при растворении в воде он дает щелочи, но в природе встречается в виде множественных минералов и солей. Морская вода содержит кальций в больших концентрациях (400 мг/л).
Характеристики кальция зависят от строения его кристаллической решетки. У этого элемента она бывает двух типов: кубическая гранецентрическая и объемноцентрическая. Тип связи в молекуле кальция — металлический.
Природные источники кальция:
Физические свойства кальция и способы получения металла
В обычных условиях кальций находится в твердом агрегатном состоянии. Металл плавится при 842 °С. Кальций является хорошим электро- и теплопроводником. При нагревании он переходит сначала в жидкое, а затем в парообразное состояние и теряет металлические свойства. Металл является очень мягким и режется ножом. Кипит при 1484 °С.
Под давлением кальций теряет металлические свойства и способность к электропроводимости. Но затем металлические свойства восстанавливаются и проявляются свойства сверхпроводника, в несколько раз превышающего по своим показателям остальные элементы.
Кальций долго не удавалось получить без примесей: из-за высокой химической активности этот элемент не встречается в природе в чистом виде. Элемент был открыт в начале XIX века. Кальций как металл впервые синтезировал британский химик Гемфри Дэви. Ученый обнаружил особенности взаимодействия расплавов твердых минералов и солей с электрическим током. В наши дни электролиз солей кальция (смеси хлоридов кальция и калия, смеси фторида и хлорида кальция) остается самым актуальным способом получения металла. Кальций также извлекают из его оксида с помощью алюминотермии — распространенного в металлургии метода.
Химические свойства кальция
Кальций — активный металл, вступающий во многие взаимодействия. При нормальных условиях он легко реагирует, образуя соответствующие бинарные соединения: с кислородом, галогенами. Нажмите здесь, чтобы узнать больше о соединениях кальция. При нагревании кальций реагирует с азотом, водородом, углеродом, кремнием, бором, фосфором, серой и другими веществами. На открытом воздухе мгновенно взаимодействует с кислородом и углекислым газом, поэтому покрывается серым налетом.
Бурно реагирует с кислотами, при этом иногда воспламеняется. В солях кальций проявляет интересные свойства. Например, пещерные сталактиты и сталагмиты — это карбонат кальция, постепенно образовавшийся из воды, углекислого газа и гидрокарбоната в итоге процессов внутри подземных вод.
Из-за высокой активности в обычном состоянии кальций хранится в лабораториях в темной герметичной стеклянной посуде под слоем парафина или керосина. Качественная реакция на ион кальция — окрашивание пламени в насыщенный кирпично-красный цвет.
Идентифицировать металл в составе соединений можно по нерастворимым осадкам некоторых солей элемента (фторид, карбонат, сульфат, силикат, фосфат, сульфит).
Реакция воды с кальцием
Кальций хранят в банках под слоем защитной жидкости. Чтобы провести опыт, демонстрирующий, как происходит реакция воды и кальция, нельзя просто достать металл и отрезать от него нужный кусочек. Металлический кальций в лабораторных условиях проще использовать в виде стружки.
Если металлической стружки нет, а в банке есть только большие куски кальция, потребуются пассатижи или молоток. Готовый кусочек кальция нужного размера помещают в колбу или стакан с водой. Кальциевую стружку кладут в посуду в марлевом мешочке.
Кальций опускается на дно, и начинается выделение водорода (сначала в месте, где находится свежий излом металла). Постепенно с поверхности кальция выделяется газ. Процесс напоминает бурное кипение, одновременно образовывается осадок гидроксида кальция (гашёная известь).
Кусок кальция всплывает, подхваченный пузырьками водорода. Примерно через 30 секунд кальций растворяется, а вода из-за образования взвеси гидроксида становится мутно-белой. Если реакцию проводить не в стакане, а в пробирке, можно наблюдать выделение тепла: пробирка быстро становится горячей. Реакция кальция с водой не заканчивается эффектным взрывом, но взаимодействие двух веществ протекает бурно и выглядит зрелищно. Опыт безопасен.
Если мешочек с оставшимся кальцием вынуть из воды и подержать на воздухе, то через некоторое время в результате продолжающейся реакции наступит сильное разогревание и оставшаяся в марле вода закипит. Если часть помутневшего раствора отфильтровать через воронку в стакан, то при пропускании через раствор оксида углерода CO₂ получится осадок. Для этого не нужен углекислый газ — можно продувать выдыхаемый воздух в раствор через стеклянную трубочку.
Источник
Гидрид кальция: способы получения и химические свойства
Гидрид кальция CaH2 — неорганическое бинарное соединение щелочноземельного металла кальция и водорода. Белый, плавится без разложения в атмосфере H2, при дальнейшем нагревании разлагается. Сильный восстановитель.
Относительная молекулярная масса Mr = 42,09 относительная плотность для тв. и ж. состояния d = 1,9; tпл ≈ 1000º C.
Способ получения
1. Гидрид кальция получают реакцией взаимодействия кальция и водорода при 500 — 700º C:
2. Хлорид кальция взаимодействует с водородом при 600 — 700º С и образует гидрат кальция и хлороводородную кислоту:
Химические свойства
1. Гидрид кальция — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. При взаимодействии с кислородом при температуре 300 — 400º C гидрид кальция образует оксид кальция и воду:
1.2. При температуре выше 1000º C г идрид кальция взаимодействует с азотом , образуя нитрид кальция и водород:
2. Гидрид кальция взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид кальция образует гидроксид кальция и газ водород:
2.2. Гидрид кальция вступает в реакцию с кислотами :
2.2.1. С разбавленной хлороводородной кислотой гидрид кальция реагирует с образованием хлорида кальция и газа водорода:
2.2.2. В результате реакции между гидридом кальция и сероводородной кислотой при 500 — 600º С образуется сульфид кальция и водород:
2.3. Гидрид кальция реагирует с газом аммиаком при t = 300º C с образованием амида кальция и водорода:
2.4. Гидрид кальция вступает во взаимодействие с солями :
В результате реакции между гидридом кальция и хлоратом калия при 450 — 550º С образуется хлорид калия, оксид кальция и вода:
3CaH2 + 2KClO3 = 2KCl + 3CaO + 3H2O
3. Гидрид кальция разлагается при температуре выше 1000º C, с образованием кальция и водорода:
Источник
Характеристика химических свойств кальция
Задание 337
Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция: а) с V2O5; б) СаSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
Благодаря большому отрицательному значению 
Уравнения реакций кальция:
5Ca 0 + 2V +5 = 5Ca 2+ + 2V 0
б) Ca + СаSO4 = CaO + CaS
4Ca 0 + S +6 = 4Ca 2+ + S 2-
4Са + CaSO4 = 4СаО + CaS
Задание 338
Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Решение:
СаО – оксид кальция называют «негашеная известь». Са(ОН)2 – гидроксид кальция называют «гашённая известь».
а) Оксид кальция получают при термическом разложении известняка СаСО3:
Этот процесс протекает при температуре 1000 0 С (промышленный метод получения СаО).
б) При спекании известняка и графита получают оксид кальция:
Гашённую известь получают при действии воды на оксид кальция:
При прокаливании негашеной извести с углём образуется карбид кальция:
СаО + 3С СаС2 + СО
2Ca 0 + С 0 = 2Ca 2+ + С 4-
Таким образом, углерод является и окислителем, и восстановителем в данной реакции. Эта реакция является реакцией самоокисления-самовосстановления (реакцией диспропорционирования, дисмутации), потому что протекает с одновременным уменьшением и увеличением степени окисления одного и того же элемента (С – уголь).
Задание 339
Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Решение:
Источник