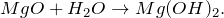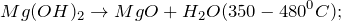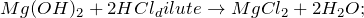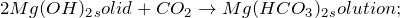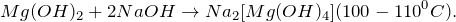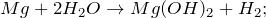- Оксид магния: способы получения и химические свойства
- Способ получения
- Химические свойства
- MgO + H2O = ? уравнение реакции
- В какие реакции вступает оксид магния
- Примеры реакций оксида магния
- Реакции MgO с кислотными оксидами
- Реакции с амфотерным оксидами:
- Как MgO реагирует с водой?
- Оксид магния, свойства, получение, химические реакции
- Оксид магния, свойства, получение, химические реакции.
- Краткая характеристика оксида магния:
- Физические свойства оксида магния:
- Получение оксида магния:
- Уравнения реакций mgo с водой
- MgO – основный оксид
- SO3 – кислотный оксид
- Mg(OH)2 – основный гидроксид
- H2SO4 – кислотный гидроксид
Оксид магния: способы получения и химические свойства
Оксид магния MgO — бинарное неорганическое вещество . Белый, тугоплавкий, термически устойчивый, не реагирует с водой. Проявляет основные свойства.
Относительная молекулярная масса Mr = 40,3; относительная плотность для тв. и ж. состояния d = 3,62; tпл ≈ 2825º C; tкип = 3600º C.
Способ получения
1. Оксид магния получается при разложении карбоната магния при температуре 350 — 650º C. В результате разложения образуется оксид магния и углекислый газ:
2. В результате разложения нитрата магния при температуре выше 300º С образуется оксид магния, оксид азота (IV) и кислород:
3. Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
4. Оксид магния можно получить путем разложения сульфата магния при температуре выше 1200º C, образуется оксид магния, кислород и оксид серы (IV):
5. Оксид магния можно получить сжиганием магния в в кислороде при 600 — 650º С:
2Mg + O2 = 2MgO
Химические свойства
1. Оксид магния реагирует с простыми веществами :
1.1. В результате реакции между оксидом магния и кальцием при температуре выше 400º С образуется магний и оксид кальция:
MgO + Ca = CaO + Mg
1.2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
MgO + C = Mg + CO
2. Оксид магния взаимодействует со сложными веществами:
2.1. Оксид магния взаимодействует с кислотами . При этом образуются соль и вода.
2.1.1. О ксид магния с разбавленной соляной кислотой образует хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
2.3. Оксид магния взаимодействует с водой при 100 — 125º С, образуя гидроксид магния:
Источник
MgO + H2O = ? уравнение реакции
Помогите составить химическое уравнение по схеме MgO + H2O = ? Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Запишите молекулярное уравнение реакции. Охарактеризуйте полученное соединение: укажите основные физические и химические свойства, способы получения.
В результате взаимодействия оксида магния с водой (MgO + H2O = ?) происходит образование нерастворимого в воде основания – гидроксида магния (соединение). Молекулярное уравнение реакции имеет вид:
Гидроксид магния представляет собой вещество белого цвета, кристаллы которого при нагревании разлагаются. Не растворяется в воде. Проявляет основные свойства, реагирует с кислотами, кислотными оксидами. В жестких условиях образует гидроксокомплексы. Поглощает углекислый газ из воздуха. Переводится в раствор солями аммония.
Кроме вышеописанного способа гидроксид магния получают растворением металла в воде:
а также по любой реакции, удовлетворяющей сокращенному-ионному уравнению
Источник
В какие реакции вступает оксид магния
Всё о химических свойствах оксида магния
Оксид магния — порошкообразное вещество, которое в природе встречается в форме минерала периклаз. Порошок этот очень тугоплавкий (расплав образуется при температуре свыше 2650 ⁰С).
Оксид магния легко впитывает влагу, благодаря чему он нашел широкое применение. Оксид магния применяется в пищевой промышленности (кодируется как пищевая добавка Е 530) против комкообразования и слеживания.
В медицине MgO используется как антацид (средство против повышенной кислотности в желудке), как слабительное или как вспомогательное вещество во многих лекарствах, которые выпускаются в форме таблеток.
Нашел MgO широкое распространение и как наполнитель в производстве резины, огнеупоров, цемента, а также в качестве мелкого абразива в электронной промышленности.
Интересное оптическое свойство порошка оксида магния обуслаливает его применение в качестве эталонного отражателя: в широком спектре его коэффициент отражения равен 1.
Одно из названий MgO — жженая магнезия, так как он получается при обжиге минералов магнезита и доломита:
Получить это вещество можно простым способом — взаимодействием магния и кислорода:
Будучи основным оксидом, MgO вступает в реакции с:
- водой, образуя гидроксид магния (о нюансах этой реакции расскажем чуть позже);
- с кислотами, образуя соли и воду;
- с кислотными оксидами, образуя сложные соли;
- c амфотерным оксидами при сплавлении образует сложные вещества — двойные оксиды.
Примеры реакций оксида магния
Растворение в кислотах:
- MgO + HCl (разб) → MgCl₂ + H₂O (для протекания реакции нужны неконцентрированные кислоты)
- MgO + H₂SO₄ → MgSO₄ + H₂O В реакциях с кислотами MgO показывает общие свойства оксидов (образуя соль и воду).
Реакции MgO с кислотными оксидами
MgO + SO₃ → MgSO₄ — образуется сульфат магния
MgO + СO₃ → MgСO₃ — образуется карбонат магния
Реакции с амфотерным оксидами:
Al₂O₃ + MgO → MgAl₂O₄
В этой реакции оксида магния с оксидом алюминия образуется алюминат магния (двойной оксид магния и алюминия). Реакция протекает при высокой температуре (свыше 1500 ⁰С).
Как MgO реагирует с водой?
Являясь основным оксидом, MgO взаимодействует с водой, образуя основание — гидроксид магния.
С холодной водой оксид магния реагирует очень медленно, но если реакцию проводить с водяным паром, реакция пойдет быстрее.
MgO + H₂O (вода в виде горячего пара) → Mg(OH)₂
В результате этой реакции образуется гидроксид магния
А вот если у экспериментатора есть полоска магния, можно провести очень зрелищный опыт:
- полоску металла частично опустить в стакан с водой;
- поджечь оставшуюся часть магния.
Mg + 2H₂O = Mg(OH)₂ + H₂↑
Горение магния продолжается даже в воде. При этом выделяющийся водород тоже вступает в реакцию горения.
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
Источник
Оксид магния, свойства, получение, химические реакции
Оксид магния, свойства, получение, химические реакции.
Оксид магния – неорганическое вещество, имеет химическую формулу MgO.
Краткая характеристика оксида магния:
Оксид магния – неорганическое вещество белого цвета.
Так как валентность магния равна двум, то оксид магния содержит один атом кислорода и один атом магния.
Химическая формула оксида магния MgO.
Оксид магния представляет собой лёгкий, рыхлый порошок, легко впитывает воду.
Оксид магния плохо растворяется в воде, вступает с ней в реакцию. Не растворяется в этаноле.
Встречается в природе в виде минерала периклаз.
Оксид магния может вызывать раздражение слизистых глаз и носа. При работе с препаратом следует применять индивидуальные средства защиты (респираторы типа «Лепесток», резиновые перчатки, защитные очки), а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы с оксидом магния, должны быть оборудованы общей приточно-вытяжной вентиляцией. См. ГОСТ 4526-75 Реактивы. Магний оксид. Технические условия (с Изменением N 1).
Пожаро- и взрывобезопасен.
Физические свойства оксида магния:
| Наименование параметра: | Значение: |
| Химическая формула | MgO |
| Синонимы и названия иностранном языке | magnesium oxide (англ.) |
магнезия жженая (рус.)
магния окись (устар. рус.)
Получение оксида магния:
Оксид магния получают обжигом минералов магнезита и доломита .
Он получается в результате химической реакции – термического разложения карбоната кальция и карбоната магния:
CaCO3·MgCO3 → CaО + MgО + СО2 (t = 900-1200 o C);
MgCO3 → MgО + СО2 (t > 650 o C);
CaCO3 → CaО + СО2 (t = 900-1200 o C).
MgCO3 – химическая формула магнезита.
Это промышленный способ получения оксида магния.
Источник
Уравнения реакций mgo с водой
Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO3; б) Mg(OH)2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
MgO – основный оксид
Взаимодействует с водой при нагревании:
MgO + H2O ⟶ Mg(OH)2
Взаимодействует с кислотными оксидами:
MgO + CO2 ⟶ MgCO3
Взаимодействует с кислотами:
MgO + 2HNO3 ⟶ Mg(NO3)2 + H2O
MgO + 2H + + 2NO3 — ⟶ Mg 2+ + 2NO3 — + H2O
MgO + 2H + ⟶ Mg 2+ + H2O
SO3 – кислотный оксид
Взаимодействуют с основными оксидами:
SO3 + CaO ⟶ CaSO4
Оксид серы (VI) проявляет только окислительные свойства.
| 2SO3 ⇄ 2SO2 + O2 | ||
| S +6 + 2ē ⟶ S +4 | 2 | окислитель (восстановление) |
| 2O -2 — 4ē ⟶ O2 0 | 1 | восстановитель (окисление) |
Mg(OH)2 – основный гидроксид
Разлагается при нагревании:
Mg(OH)2 t ⟶ MgO + H2O
Взаимодействует с кислотными оксидами:
Mg(OH)2 + CO2 ⟶ MgCO3 + H2O
H2SO4 – кислотный гидроксид
Разбавленная серная кислота взаимодействует с металлами, находящимися в электрохимическом ряду напряжений левее водорода:
Fe + H2SO4 ⟶ FeSO4 + H2↑
Взаимодействует с основными оксидами:
FeO + H2SO4 ⟶ FeSO4 + H2O
Взаимодействует с солями, если образуется газ, осадок или слабый электролит:
BaCl2 + H2SO4 ⟶ 2HCl + BaSO4↓
Ba 2+ + 2Cl — + 2H + + SO4 2- ⟶ 2H + + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
Серная кислота проявляет только окислительные свойства.
Источник