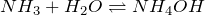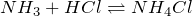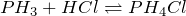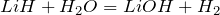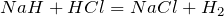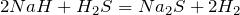Валентность и степень окисления
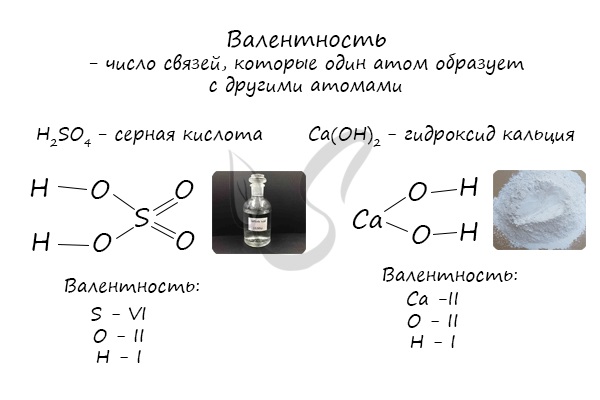
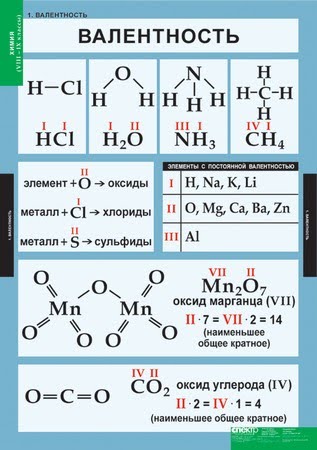
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
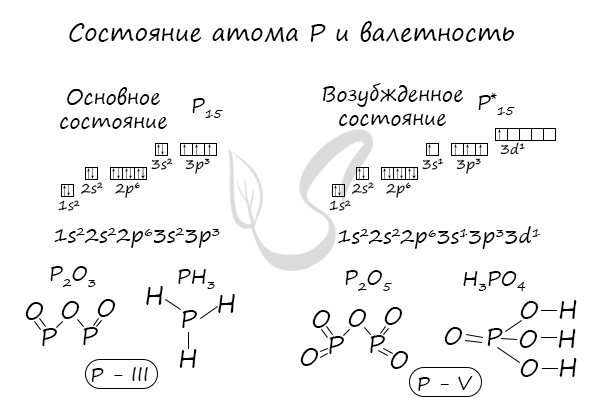
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
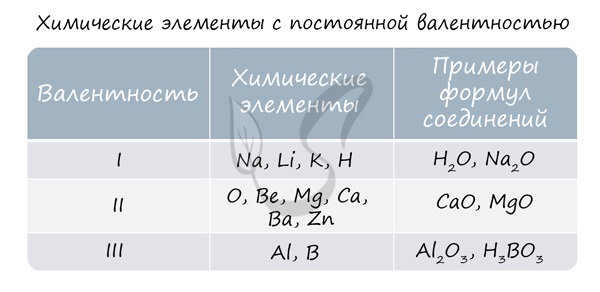
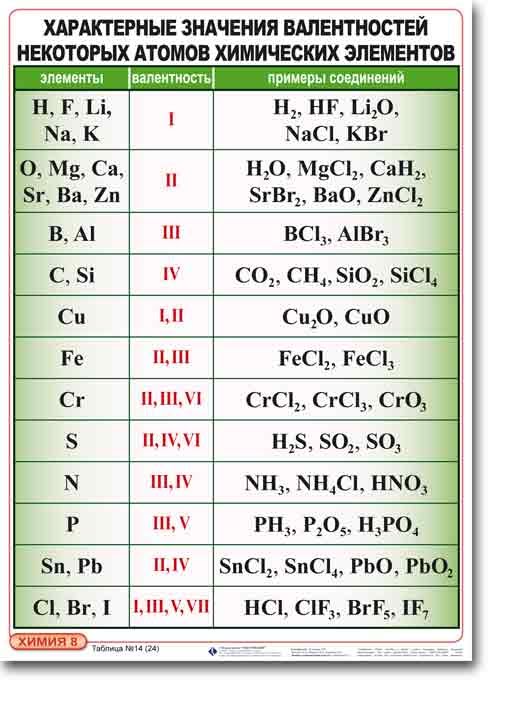
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.
Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.
Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe — II
Степень окисления
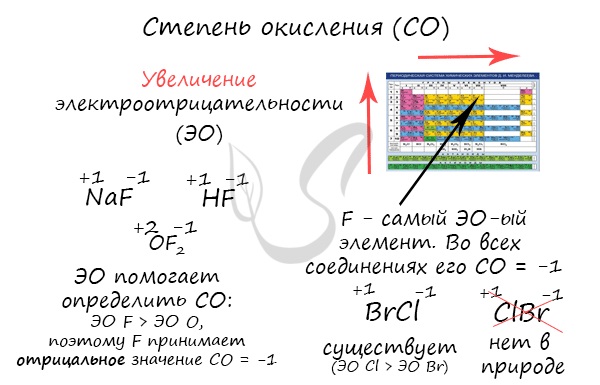
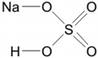
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток — получает знак «+».
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Источник
Валентность водорода
Общие сведения о валентности водорода
При температуре ниже -240 o С (критическая температура водорода) он под давлением сжижается. Если испарять полученную жидкость, то образуется твердый водород в виде прозрачных кристаллов, плавящихся при -259,2 o С.
Водород – самый легкий из всех газов, он в 14,5 раз легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. В воде водород растворим очень мало, но в некоторых металлах, например в никеле, паладии, платине, растворяется в значительных количествах.
Водород имеет три изотопа: протий 1 H, дейтерий 2 H или D и тритий 3 H или T. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий – радиоактивен. Ядро атома водорода 1 H содержит один протон. Ядра дейтерия и трития включают кроме одного протона соответственно один и два нейтрона.
Молекула водорода состоит из двух атомов – H2.
Валентность водорода в соединениях
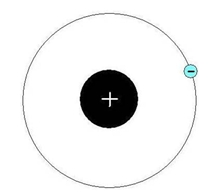
В ядре атома водорода содержится один протон, а по единственной орбите вокруг него движется один электрон (рис. 1).
Рис. 1. Строение атома водорода.
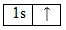
Электронная формула атома водорода в основном состоянии будет выглядеть следующим образом:
А энергетическая диаграмма:
Наличие одного неспаренного электрона свидетельствует о том, что для водорода характерна валентность равная I. Этот факт также подтверждается и тем, что водород расположен в IA группе Периодической таблицы Д.И. Менделеева, а, как известно, высшая валентность химического элемента определяется номером группы, в которой он находится. Валентность водорода постоянна во всех соединениях (BaH I 2, H I Cl, NaOH I , Ca(H I CO3)2и т.д.)
Примеры решения задач
| Задание | Могут ли реагировать между собой бинарные водородные соединения? Дайте обоснованный ответ. Приведите уравнения возможных реакций на примере водородных соединений элементов второго и третьего периодов Периодической системы. |
| Ответ | Бинарные водородные соединения элементов второго и третьего периодов могут вступать во взаимодействие друг с другом, проявляя как кислотно-основные, так и окислительно-восстановительные свойства. Например, между собой реагируют:
|
- Аммиак и хлороводород (фтороводород) с образованием хлорида (фторида) аммония:
- Фосфин и хлороводород с образованием хлорида фосфония:
В этих реакциях аммиак и фосфин проявляют свойства оснований, а вода, хлороводород и фтороводород – свойства кислот.
Окислительно-восстановительные реакции протекают при взаимодействии гидридов лития и натрия с водой, хлороводородом и сероводородом:
В этих реакциях гидриды металлов выступают в роли восстановителей, а вода, хлороводород и сероводород – в роли окислителей.
| Задание | Некоторый элемент образует гидрид ЭН3, массовая доля водорода в котором равна 8,82%. Определите этот элемент. |
| Решение | Рассчитаем относительную молекулярную массу ЭН3, воспользовавшись расчетной формулой массовой доли химического элемента в веществе: |
Рассчитаем относительную атомную массу элемента:
Источник
Валентность водорода с водой
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Валентность химических элементов
Из материалов урока вы узнаете, что постоянство состава вещества объясняется наличием у атомов химических элементов определенных валентных возможностей; познакомитесь с понятием «валентность атомов химических элементов»; научитесь определять валентность элемента по формуле вещества, если известна валентность другого элемента; научитесь составлять химические формулы по валентности.
I. Понятие “валентность”
Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н2О. Возникает вопрос: почему вещества имеют постоянный состав?
Проанализируем состав предложенных веществ: Н2О, NaH, NH3, CH4, HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
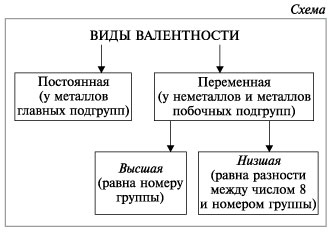
II. Правила определения валентности элементов в соединениях
Посмотрите видео по данной теме:
- Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
- Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 —Nгруппы.
- У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
- У неметаллов в основном проявляются две валентности: высшая и низшая. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
- Валентность может быть постоянной или переменной.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Пример 1. Определим валентность углерода в веществе СН4.
Зная, что валентность водорода всегда равна I, а углерод присоединил к себе 4 атома водорода, можно утверждать, что валентность углерода равна IV. Валентность атомов обозначается римской цифрой над знаком элемента.
Пример 2. Определим валентность фосфорав соединении Р2О5.
Для этого необходимо выполнить следующие действия:
1. Над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. Умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. Разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
IV. Cоставление бинарных формулпо валентностям химических элементов
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов.
V. Задания для закрепления
Задание №1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III VII III II IV III
Li O, Ba O, P O, SnO, P H, MnO, Fe O, H S, N O, Cr Cl
Задание №2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) цинка и хлора,
4) магния и серы.
Задание №3.
Используя материалы лекции составьте бинарные формулы следующими элементами:
А) бор и кислород;
Б) алюминий и хлор;
В) литий и сера.
Задание №4
Определите валентность химических элементов по формулам их соединений:
Источник