I .4. Химические свойства ванадия
На воздухе ванадий не изменяется, устойчив он к воде, к растворам минеральных солей и щелочей. Кислоты на него действуют только такие, которые одновременно являются окислителями. На холоде на него не действуют разбавленные азотная и серная кислоты. По-видимому, на поверхности металла образуется тончайшая пленка оксида, препятствующая дальнейшему окислению металла («пассивированное состояние»). Для того чтобы заставить пассивированный ванадий интенсивно реагировать, его нужно нагреть. При 600—700°С происходит интенсивное окисление компактного металла, а в мелкораздробленном состоянии он вступает в реакции при более низкой температуре:
2V +5O2 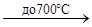
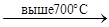
2V +5F 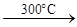

Прямым взаимодействием элементов при нагревании могут быть получены сульфиды, карбиды, нитриды, арсениды, силициды. Для техники важны желто-бронзовый нитрид VN (tпл = 2050°С), устойчивый к воде и кислотам, а также обладающий высокой твердостью карбид VC (tпл = 2800 °С).
Ванадий очень чувствителен к примесям газов (O2, N2, H2), которые резко меняют его свойства, даже если присутствуют в самых незначительных количествам. Поэтому и сейчас можно в разных справочниках встретить различную температуру плавления ванадия. Загрязненный ванадий, в зависимости от чистоты и способа получения металла, может плавиться в интервале от 1700 до 1900°С. При чистоте 99,8 — 99,9 % его плотность равна 6,11 г /см 3 при 20°С, температура плавления составляет 1919°С, а температура кипения 3400 °С.
Металл исключительно стоек как в органических, так и в большинстве неорганических агрессивных средах. По стойкости к действию НС1, НВr и холодной серной кислоты он значительно превосходит титан и нержавеющую сталь. С галогенами, за исключением самого агрессивного из них — фтора, соединений не образует. С фтором же дает кристаллы VF5, бесцветные, возгоняющиеся без превращения в жидкость при 111°С. Атмосфера из углекислого газа на металлический ванадий действует значительно слабее, чем на его аналоги — ниобий и тантал. Он обладает высокой стойкостью к расплавленным металлам, поэтому может применяться в конструкциях атомных реакторов, где расплавленные металлы используются как теплоносители. Ванадий не ржавеет ни в пресной, ни в морской воде, ни в растворах щелочей. Действуют на него лишь расплавленные щелочи:
Из кислот на него действуют концентрированная серная и азотная кислоты, плавиковая и их смеси:
Особенностью ванадия считается высокая растворимость в нем водорода. В результате такого взаимодействия образуются твердые растворы и гидриды. Наиболее вероятная форма существования гидридов — металлообразные соединения с электронной проводимостью. Они способны довольно легко переходить в состояние сверхпроводимости. Гидриды ванадия могут с некоторыми твердыми или жидкими металлами образовывать растворы, в которых повышается растворимость водорода.
Самостоятельный интерес представляют карбиды ванадия, так как по своим качествам дают для современной техники материал с весьма ценными свойствами. Они исключительно тверды, тугоплавки и обладают хорошей электрической проводимостью. Ванадий способен для образования своих карбидов даже вытеснить другие металлы из их карбидов:
Известен целый ряд соединений ванадия с углеродом:
С большинством членов главной подгруппы ванадий дает соединения как бинарные (т. е. состоящие только из двух элементов.), так и более сложного состава. Нитриды образуются при взаимодействии порошка металла или его оксидов с газообразным аммиаком:
Для, полупроводниковой техники интерес представляют фосфиды V3Р, V2P, VP, VP2 и арсениды V3As, VAs.
Комплексообразующие свойства ванадия проявляются в образовании соединений сложного состава типа фосфорно-ванадиевой кислоты H7PV12O36 или Н7[Р(V2O6)6].
I .5. Оксиды ванадия
В системе ванадий — кислород взаимодействие начинается при нагревании до температуры примерно 300°С. Получено большое количество оксидов ванадия, характер которых постепенно меняется при переходе от низших оксидов к высшим. Относительно недавно обнаружен низший оксид V2О. Он нестоек и по своему характеру близок к металлическому состоянию. Его светло-серые кристаллы отливают металлическим блеском, хорошо проводят электрический ток.
Оксид VO более стоек, нерастворим в воде, но растворяется в разбавленных кислотах с образованием двухзарядного катиона V 2+ .
Водные растворы ванадия в такой степени окисления окрашены в фиолетовый, или в бледно-голубой цвет. Растворы солей иона V 2+ неустойчивы и настолько сильные как восстановители, что при стоянии выделяют водород прямо из воды, а ион ванадия переходит в более устойчивые высшие степени окисления. При добавлении к растворам любого даже слабого основания образуется бурый аморфный осадок V(OH)2. В чистом виде, однако, выделить его нельзя, так как на воздухе он быстро превращается в серо-зеленый гидроксид V(ОН)3.
Из особенностей оксида можно отметить существование при определенных концентрациях ванадия димера V2О2, а также совершенно особое влияние температуры на его состояние. Оксиды обычно делаются нестойкими при высоких температурах и разлагаются. Здесь же наблюдается совершенно удивительное свойство: оксид VO устойчив лишь при высокой температуре. Даже при медленном и постепенном охлаждении он разлагается и переходит в высшие оксиды.
Оксид ванадия, соответствующий степени окисления +3, имеет амфотерный характер с преобладанием основных свойств. Как кислотные качества можно рассматривать образование им с оксидами MgO, MnO, СаО двойных соединений, а с Fe2О3, Сr2О3, Аs2О3 непрерывный ряд твердых растворов. С оксидами же щелочных металлов Li2О и Na2О получаются соли LiVO3, NаVОз, которые можно считать ванадиевыми солями.
Внешне V2O3 — блестящие черные кристаллы (tпл = 1970°С), по структуре подобны корунду, в воде, растворах щелочей и кислотах не растворяются, кроме плавиковой и азотной (быстрее всего в кипящей):
Водные растворы таких солей окрашены в зеленый цвет. Из них добавлением аммиака можно осадить рыхлый серо-зеленый осадок, который считается гидроксидом ванадия в степени окисления +3. Отметим, что такое состояние менее устойчиво и менее характерно для ванадия, чем +4 и +5. Поэтому соединения ванадия со степенью окисления +3 стремятся перейти в более стабильное состояние и проявляют, следовательно, свойства восстановителей.
Сине-голубые кристаллы VO2 на воздухе теряют свою форму, так как вещество гигроскопично. Это наиболее устойчивый оксид ванадия, поэтому его можно получить либо окислением низших оксидов:
либо восстановлением высшего:
Оксид VO2 амфотерен и одинаково легко растворяется как в основаниях:
так и в кислотах:
Водный его раствор не изменяет цвета ни синей, ни красной лакмусовой бумажек, т. е. его амфотерность распределена поровну между кислотными качествами и основными. Водные растворы солей содержат ванадий не в виде простого катиона, а в виде иона ванадила, имеющего две формы существования: VO 2+ — и V2O2 4+ — и придающего синий цвет растворам.
В щелочах образуются соли поливанадиевых кислот H4V4O9 или H2V2O5, называются соли ванадитами или поливанадатами. При величине рН = 4 из растворов солей можно осадить серовато-бурый аморфный гидроксид VO(OH)2. Если щелочность увеличить, при рН от 8 до 10 гидроксид (в соответствии со своими амфотерными качествами) будет растворяться, превращаясь в соли. При сплавлении этого оксида ванадия с оксидами щелочноземельных металлов получаются ванадаты:
Могут образовываться три ряда ванадатов СаVО3, Са2VO4, Ca3VO5 со сложной структурой.
Наиболее важным и интересным, с точки зрения химика, считается высший оксид ванадия V2O5, который может иметь вид красных или красно-желтых кристаллов либо оранжевого порошка. Получается он по реакции ванадия с кислородом. При 600—700°С взаимодействие идет очень быстро, так как образующийся оксид V2О5 расплавляется (tпл = 675°С) и скатывается с поверхности металлического ванадия. Лабораторный способ его получения — из метаванадата аммония;
Высший оксид ванадия имеет ярко выраженный кислотный характер и при растворении в воде образует ванадиевую кислоту:
Форма существования ванадия в растворе кислоты — в виде катиона VO 2+ , цвет раствора желтовато-оранжевый. При растворении оксида ванадия (V) в основаниях получаются соли изомерных ванадиевых кислот, напоминающих фосфаты:
По форме они соответствуют мета — [НVO3], орто — [Н3VO4]и H2V2O7 пированадиевым кислотам. В этом отношении ванадий обнаруживает сходство уже не с азотом, а с фосфором.
Особенность ванадия (в степени окисления +5) при растворении в сильных кислотах — образовывать комплексные соединения, содержащие до девяти -двенадцати атомов ванадия на молекулу. Другим замечательным свойством оксида можно считать способность в расплавленном состоянии проводить электрический ток, скорее всего вследствие диссоциации на ионы:
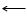

А ведь пропускание электрического тока считается безусловной «привилегией» металлов. По этому свойству распознается принадлежность вещества к металлам или неметаллам.
Характер гидратных форм оксидов ванадия меняется закономерно с изменением степени его окисления. В состоянии наибольшего окисления он образует кислоты, подобные кислотам фосфора и мышьяка, элементов, которые являются соседями ванадия, но относятся к противоположной подгруппе. Слово «противоположная» означает, что элементы различных подгрупп одной группы — химические антиподы: для одних должны быть более характерны свойства металлов, а для других — неметаллов. Но при сравнении членов обеих подгрупп можно заметить, что «противоположности» сближаются. У элементов побочной подгруппы все более усиливаются свойства неметаллов, характерные для главной подгруппы, и наоборот.
Ванадий в этом отношении служит примером. В высшей окислительной степени у него преобладают свойства неметалла. При состоянии окисления +4 его гидроксид в одинаковой мере проявляет. Свойства обеих противоположностей, т. е. он амфотерен.
Сопоставив приведенные данные об оксидах ванадия с аналогичными сведениями о подобных соединениях других членов V группы, можно прийти к следующему выводу: по количеству оксидов и по числу состояний окисления ванадий далеко превосходит не только членов побочной подгруппы (это естественно), но и некоторые элементы главной подгруппы. Если судить по кислородным соединениям (именно их особенности несколько десятилетий назад считались основным признаком сходства и различия), то ванадий должен считаться более близким «родственником» азота, чем висмут, сурьма и даже мышьяк. Ведь эти элементы не образуют всех типов оксидов, присущих азоту, а существующие у них по своим свойствам подобны оксидам фосфора.
Источник
Ванадий взаимодействие с водой
Ванадий отличается высокой химической стойкостью, при нормальных условиях инертен.
- Взаимодействие с неметаллами
При температуре выше 600 °С взаимодействует с кислородом, образуя оксид ванадия (V):
при горении ванадия на воздухе образуется оксид ванадия (IV):
При температуре выше 700°С реагирует с азотом с образованием нитрида:
При нагревании до 200–300 °С реагирует с галогенами. С фтором образует фторид ванадия (V), с хлором – хлорид ванадия (IV), с бромом – бромид ванадия (III), с йодом – йодид ванадия (II):
С углеродом при 800 °С образует карбид:
При спекании с бором и кремнием при высоких температурах образует борид и силицид:
Реагирует с серой и фосфором при нагревании:
2V + 3S = V2S3, возможно образование VS и VS2,
V + P = VP, возможно образование VP2.
С водородом образует твердые растворы.
Взаимодействие с кислотами
Ванадий находится в ряду напряжений металлов до водорода, но, благодаря своей прочной защитной пленке, довольно инертен, не растворяется в воде и разбавленной соляной кислоте, на холоду не реагирует с разбавленной серной и азотной кислотой.
Реагирует с плавиковой кислотой с образованием фторидного комплекса:
с концентрированной азотной кислотой с образованием соединения ванадия (V) – нитрата ванадина:
с концентрированной серной кислотой с образованием соединения ванадия (IV) – сульфата ванадила:
и царской водкой с образованием соединения ванадия (V) – хлорида ванадина:
растворяется в смеси азотной и плавиковой кислот:
плавиковая кислота растворяет пассивирующую пленку оксида:
а азотная кислота окисляет поверхность металла:
Взаимодействие со щелочами
Ванадий не взаимодействует с растворами щелочей, в расплавах в присутствии воздуха окисляется с образованием ванадатов:
С металлами образует сплавы и интерметаллиды.
Источник
Ванадий взаимодействие с водой
Цель: повторить и обобщить сведения о свойствах, способах получения и применении ванадия и его соединений.
Оборудование: Периодическая система химических элементов Д.И. Менделеева (приведена в электронном учебном пособии).
Содержание урока соответствует части IV.9 электронного учебного пособия.
Знакомство с химией ванадия и его соединений следует начать с исторической справки. Ванадий был открыт в 1830 г . шведским химиком и минералогом Н. Сефстремом в железной руде из Таберга (Швеция). В чистом виде выделен в 1869 г . английским химиком Г. Роско при взаимодействии водорода и хлористого ванадия.
Охарактеризовать положение ванадия в Периодической системе химических элементов Д.И. Менделеева. Ванадий расположен в 5 группе Периодической системы химических элементов Д.И. Менделеева. Ванадий – d-элемент. Валентные электроны атома ванадия имеют электронную конфигурацию 3d 3 4s 2 . В соединениях ванадий проявляет степени окисления +2, +3, +4, +5. Соединения ванадия (II) проявляют преимущественно основные свойства, ванадия (III) и (IV) – амфотерные, соединения ванадия (V) – кислотные.
Остановиться на распространенности ванадия в земной коре: ванадий – довольно распространенный элемент, но его минералы не встречаются в виде крупных месторождений, ванадий относится к рассеянным элементам. Ванадий встречается в нефти, битумах, углях, содержится в морской воде и осадочных породах.
При изучении физических свойств ванадия отметить, что ванадий – серебристо-белый металл, пластичен, при нагревании на воздухе выше 300 °С становится хрупким, примеси кислорода, водорода и азота резко снижают пластичность ванадия, придают ему твердость и хрупкость. На воздухе покрывается прочной оксидной пленкой.
При изучении химических свойств ванадия обратить внимание, что ванадий отличается высокой химической стойкостью, при нормальных условиях инертен. При нагревании взаимодействует со многими неметаллами: кислородом, азотом, галогенами, углеродом, бором, кремнием, серой и фосфором. Обратить внимание на образующиеся продукты и степень окисления ванадия в соединениях. Ванадий находится в ряду напряжений металлов до водорода, но, благодаря своей прочной защитной пленке, довольно инертен, не растворяется в воде и разбавленной соляной кислоте, на холоду не реагирует с разбавленной серной и азотной кислотой. Реагирует с плавиковой кислотой с образованием фторида ванадия, с концентрированной азотной кислотой с образованием соединения ванадия (V) – нитрата ванадина, с концентрированной серной кислотой с образованием соединения ванадия (IV) – сульфата ванадила, с царской водкой с образованием соединения ванадия (V) – хлорида ванадина, растворяется в смеси азотной и плавиковой кислот с образованием гептафторованадата (V) водорода. Ванадий не взаимодействует с растворами щелочей, в расплавах в присутствии воздуха окисляется с образованием ванадатов. Необходимо обратить особое внимание на характер образующихся продуктов.
Рассмотреть способы получения ванадия методами металлотермии и электролизом расплава солей ванадия.
Познакомить учащихся с соединениями ванадия в различных степенях окисления. Из соединений ванадия (II) рассмотреть свойства оксида, гидроксида и солей ванадия (II). Обратить внимание, что они проявляет основные свойства, с водой и щелочами не взаимодействует, реагирует с кислотами. Соединения ванадия (II) – сильные восстановители, уже на воздухе растворы солей окисляются с образованием соединений ванадия (III).
Из соединений ванадия (III) рассмотреть свойства оксида, гидроксида и солей ванадия (III). Основными формами существования ванадия (III) являются V 3+ , VO + , VO3 3- , комплексные ионы, в которых ванадий имеет координационное число, равное 6. Соединения ванадия (III) проявляют амфотерные свойства с преобладанием основных, являются сильными восстановителями, в растворах окисляются кислородом воздуха до производных ванадия (IV).
Из соединений ванадия (IV) рассмотреть свойства оксида, гидроксида и солей ванадия (IV). При обычных условиях степень окисления +4 является для ванадия наиболее характерной. Ванадий (IV) существует в следующих формах: VO 2+ (ванадин-ион), VO3 2- , V4O9 2- (ванадат (IV)-ионы). В комплексных ионах имеет координационное число, равное 6, а также 4 и 5. Соединения ванадия (IV) проявляют амфотерные свойства, с преобладанием кислотных, в зависимости от условий могут быть окислителями и восстановителями.
Из соединений ванадия (V) рассмотреть свойства оксида и солей ванадия (V) – изополиванадатов. Степень окисления +5 для ванадия реализуется в оксокатионах VO2 + , VO 3+ (ванадил-ионы) и оксоанионах VO4 3- , V2O7 4- , V3O9 3- и др. (ванадат (V)-ионы). Соединения ванадия (V) проявляют кислотные свойства. Обратить внимание на формы существования ванадат-ионов в растворе в зависимости от рН и концентрации раствора.
Сделать вывод об изменении кислотно-основных и окислительно-восстановительных свойств соединений ванадия в ряду V (II) – V (III) – V (IV) – V (V). В указанном ряду кислотно-основные свойства изменяются от основных (V (II)) через амфотерные (V (III) и V (IV)) до кислотных (V (V)), а окислительно-восстановительные – от восстановительных (V (II)) до окислительных (V (V)).
Рассмотреть основные области применения ванадия и его соединений.
Источник



