- Химия, Биология, подготовка к ГИА и ЕГЭ
- Качественные реакции органической химии
- Вещества обесцвечивающие бромную воду это
- Органическая химия
- Качественные реакции в органической химии
- Качественные реакции на алканы
- Качественные реакции на алкены
- Качественные реакции на алкины
- Качественные реакции на альдегиды
- Качественные реакции на спирты
- Какие органические соединения обесцвечивают бромную воду. Список веществ, которые обесцвечивают бромную воду
- Способы получения
- Химические свойства
- Br 2 — очень сильный окислитель
- Бромная вода — реактив для проведения качественных реакций
- 1. Обнаружение в растворах восстановителей
- 2. Обнаружение кратных углерод-углеродных связей
- 3. Обнаружение фенола и анилина в органических растворах
- Йод-крахмальная реакция в качественном анализе
- Реакции с участием I 2 в качестве восстановителя
- Бромоводород и йодоводород
- Термическая неустойчивость НВr и HI
- Анионы Вr — и I — — более сильные восстановители, чем анионы Сl — .
- Получение НВг и HI:
- Бром и приготовление бромной воды
- Состав бромной воды
- Свойства химические и физические
- Применение
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества .
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 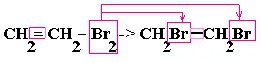 2. Изменение окраски раствора 2. Изменение окраски раствора 3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 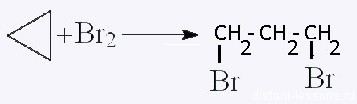 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 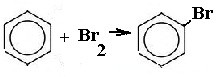
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 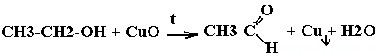 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 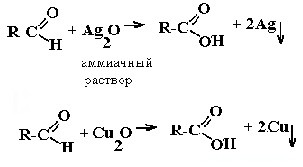 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Источник
Вещества обесцвечивающие бромную воду это
Органическая химия
Качественные реакции в органической химии
Качественные реакции на алканы
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а) Обесцвечивание перманганата калия (реакция Вагнера).
При этом этилен окисляется в двухатомный спирт этиленгликоль .
СН2=СН2 + [О] 
б) Обесцвечивание бромной воды:
Качественные реакции на алкины
а) Обесцвечивание перманганата калия (реакция Вагнера).
б) Обесцвечивание бромной воды:
в) Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C≡C-R) в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CH 3 -CHO + 2Cu(OH) 2 —> CH 3 -COOH + Cu 2 O↓ + 2H 2 O (реакция идет при нагревании)
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных спиртов реакции различны.
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
б) Взаимодействие с натрием.
Качественные реакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
К примеру, при приливании глицерина образуется глицерат меди (II) ( хелатный комплекс темно-синего цвета):
Источник
Какие органические соединения обесцвечивают бромную воду. Список веществ, которые обесцвечивают бромную воду
Вr 2 при обычной температуре — буровато-коричневая тяжелая жидкость, образующая ядовитые пары красно-бурого цвета с резким запахом. Растворимость в воде брома выше, чем у хлора. Насыщенный раствор Вr 2 в воде называют «бромной водой».
Свободный I 2 при обычной температуре-черно-серое с фиолетовым оттенком твердое вещество, имеет заметный металлический блеск. Йод легко возгоняется, обладает своеобразным запахом (пары йода, как и брома, очень ядовиты). Растворимость I 2 в воде наименьшая среди всех галогенов, но он хорошо растворяется в спирте и других органических растворителях.
Способы получения
1. Бром и йод извлекают из морской воды, подземных рассолов и буровых вод, где они содержатся в виде анионов Вr — и I — . Выделение свободных галогенов осуществляют с помощью различных окислителей, чаще всего пропускают газообразный хлор:
2NaI + Cl 2 = I 2 + 2NaCl
2NaBr + Cl 2 = Br 2 + 2NaCI
2. В лабораторных условиях для получения Br 2 и I 2 используют, например, следующие реакции:
2NaBr + МnO 2 + 2H 2 SO 4 = Br 2 ↓ + MnSO 4 + Na 2 SO 4 + 2Н 2 O
бНВг + 2H 2 SO 4 = 3Br 2 ↓ + S↓ + 4Н 2 O
2HI + H 2 SO 4 = I 2 ↓ + SO 2 + 2Н 2 O
Химические свойства
По химическим свойствам бром и йод сходны с хлором. Различия связаны, главным образом, с условиями протекания реакций. Отметим некоторые важные особенности химических реакций с участием Br 2 и I 2 .
Br 2 — очень сильный окислитель
Бром — жидкость, в отличие от газообразного Cl 2 , поэтому концентрация молекул в нем выше. Этим объясняется более сильное окисляющее действие жидкого брома. Например, при соприкосновении с ним железа и алюминия происходит возгорание даже при обычной температуре.
Бромная вода — реактив для проведения качественных реакций
Бромная вода имеет желто-бурую окраску, которая быстро исчезает, если растворенный Br 2 прореагирует с каким-либо веществом. «Обесцвечивание бромной воды» — тест на присутствие в растворе целого ряда неорганических и органических веществ.
1. Обнаружение в растворах восстановителей
Газообразные и растворенные в воде SO 2 и H 2 S, а также растворимые сульфиты и сульфиды обесцвечивают бромную воду:
Br 2 + Na 2 SO 3 + Н 2 O = 2HBr + Na 2 SO 4
Br 2 + H 2 S = 2НВr + S↓
3Br 2 + Na 2 S + ЗН 2 O = 6HBr + Na 2 SO 3
2. Обнаружение кратных углерод-углеродных связей
Качественная реакция на непредельные органические соединения — обесцвечивание бромной воды:
R-CH=CH-R» + Br 2 → R-CHBr-CHBr-R»
3. Обнаружение фенола и анилина в органических растворах
Фенол и анилин легко взаимодействуют с бромной водой, причем продукты реакций не растворяются в органических растворителях, поэтому образуют осадки:
С 6 Н 5 ОН + ЗBr 2 → С 6 Н 2 Вг 3 ОН↓ + ЗНВr
С 6 Н 5 NH 2 + ЗВr 2 → С 6 H 2 Br 3 NH 2 ↓ + ЗНВr
Йод-крахмальная реакция в качественном анализе
Анионы I — очень легко окисляются как сильными, так и слабыми окислителями:
Обнаружить выделяющийся I 2 даже в малых количествах можно с помощью крахмального раствора, который приобретает характерную грязно-синюю окраску в присутствии I 2 . Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Реакции с участием I 2 в качестве восстановителя
Атомы иода имеют более низкие значения энергии сродства к электрону и ЭО по сравнению с другими галогенами. С другой стороны, проявление некоторой металличности у йода объясняется существенным снижением энергии ионизации, благодаря чему его атомы гораздо легче отдают электроны. В реакциях с сильными окислителями йод ведет себя как восстановитель, например:
I 2 + I0HNO 3 = 2НIO 3 + 10NO 2 + 4Н 2 O
I 2 + 5Н 2 O 2 = 2НIO 3 + 4Н 2 O
I 2 + 5Cl 2 + 6Н 2 O = 2НIO 3 + 10HCl
Бромоводород и йодоводород
НВr и HI по физическим и химическим свойствам очень сходны с HCl, поэтому следует обратить внимание только на практически важные отличия, которые необходимо учитывать при получении этих веществ.
Термическая неустойчивость НВr и HI
Молекулы НВr и HI менее устойчивы, чем HCl, поэтому синтез их из простых веществ затруднен вследствие обратимости реакции (особенно в случае HI).
Анионы Вr — и I — — более сильные восстановители, чем анионы Сl — .
HCI получают действием конц. H 2 SO 4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H 2 SO 4 до свободных галогенов:
2КВг + 2H 2 SO 4 = Вr 2 + SO 2 + 2Н 2 O + K 2 SO 4
6KI + 4H 2 SO 4 = 3I 2 + S + 4Н 2 O + 3K 2 SO 4
Получение НВг и HI:
1) из бромидов и йодидов
Необходимо вытеснять НВr и HI из их солей нелетучей неокисляющей ортофосфорной кислотой
КВг + H 3 PO 4 = НВr + КН 2 PO 4
2) гидролиз галогенидов неметаллов
KI + H 3 PO 4 = HI + КН 2 PO 4
3) восстановление свободных галогенов в водных растворах
РВr 3 + ЗН 2 O = H 3 PO 3 + ЗНВr
РI 3 + ЗН 2 O = H 3 PO 3 + 3HI
Br 2 + SO 2 + 2Н 2 O = 2НВr + H 2 SO 4
l 2 + H 2 S = 2HI + S↓
4Br 2 + BaS + 4Н 2 O = 8HBr + BaSO 4
3.Укажите соединение, содержащее карбоксильную группу:
1) ароматический спирт
4.Укажите соединение, содержащее карбонильную группу:
1) ароматический спирт
4) непредельная многоосновная кислота
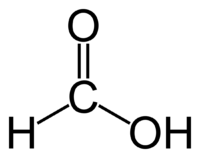
5.Дайте название соединению: О
6. Реакция СН3СНО+Ag2O СН3СООН+2 Ag:
3) «серебряного зеркала»
7. Функциональная группа карбоновых кислот называется:
8. Уксусная кислота не реагирует со следующим металлом:
9. Как называется альдегид:
1) 2-Метил-3-пропилбутаналь;
2) 2,3-диметилгексаналь;
3) 4,5-диметилгексаналь;
4) 2-метил-2-пропилбутаналь
10. Укажите общую формулу углеводов:
11. Укажите углевод, являющийся основной частью древесины:
12. Укажите формулу фруктозы:
13.Пентоза, входящая в состав ДНК – это:
14. Молочный сахар – это дисахарид:
15. Свекловичный или тростниковый сахар – это дисахарид:
16. Солодовый сахар:
17. В клетках растений крахмал выполняет функцию:
1) Передачи наследственной информации
2) Запаса питательных веществ
3) Строительную и структурную
4) Катализатора биологических процессы
18. В клетках растений целлюлоза выполняет функцию:
1) Запаса питательных веществ
2) Катализатора биологических процессов
3) Строительную и структурную
4) Передачи наследственной информации
19. Дайте название соединению:
СН3 — СН – СН — СН3
1) 3-метилбутанол-2 3) 3-метилпропанон-2
2) 2-метилбутанол-3 4) 2 –метилпропаналь-2
20. Допишите уравнение химической реакции и дайте ей название:
1) гидратация 3) присоединения
2) реакция этерификации 4) замещения
Среди нижеперечисленных характеристик выберите те, которые, как правило, относятся к жидким жирам — маслам:
1) Имеют растительное происхождение
2) Имеют животное происхождение
3) Хорошо растворимы в воде
4) Хорошо растворимы в органических растворителях
7) Обесцвечивают бромную воду
8) Являются эфирами глицерина
Ответ дайте в виде последовательности цифр в порядке их возрастания.
В-2 Установите соответствие между характеристикой жира и примером жира, соответствующего этой характеристике. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту:
А) твердый жир растительного происхождения
Б) твердый жир животного происхождения
В)Жидкий жир животного происхождения
Г)Жидкий жир растительного происхождения
1) Льняное масло
2) Сливочное масло
4) Пальмовое масло
Здравствуйте. Помогите пожалуйста. 1) Укажите число изомерных карбоновых кислот состава C5H10O2: а) 3 б) 2 в) 4 г)
2) При растворении в воде 1 моль уксусного ангидрида образуется:
а) 2 моль этаналя
б) 2 моль этанола
в) 2 моль уксусной кислоты
г) 1 моль метилацетата
3) С какими веществами реагирует ацетат натрия:
а) Солярная кислота
б) Гидроксид натрия при нагреве
в) Угольная кислота
4) При взаимодействии этанола и оксида углерода (II) соответствующих условиях получается?
в) пропановая кислота
5) В реакции какого типа могут вступать непредельные карбоновые кислоты: а) Окисление
6) С какими веществами реагирует муравьиная кислота:
а) Хлорид меди II
б) Сульфат натрия
в) Гидрокарбонат калия
г) аммиачный раствор оксида серебра I
7) В отличие от стеариновой кислоты олеиновая кислота:
а) Жидкая при комнатной температуре
б) растворима в воде
в) Обесцвечивает бромную воду
г) Реагирует с щелочами
8) Какие вещества реагируют с водой:
а) линолевая кислота
9) С помощью какого одного реактива можно различить растворы глицерина, пропаналя, и этановой кислоты:
б) карбонат калия
в) гидроксид меди II
г) азотная кислота
10) В реакциях с какими веществами с участием уксусной кислоты от ее молекулы отщепляется гидросильная группа:
г) карбонатами металов
Помогите плиз, решить две задачки!:(ставлю 11 пунктов 1) С какими из перечисленных веществ: гидроксид натрия, бромная вода, диметиловый эфир —
Бром — вещество, которое, как и ртуть, при комнатной температуре находится в жидком состоянии. Оно очень токсично, но широко используется в химической промышленности и лабораториях. Относится к группе галогенов, но более слабое, чем хлор. При прохождении через воду образует раствор под названием бромная вода.
Бром и приготовление бромной воды
Сам элемент — это красно-бурая жидкость с сильным, неприятным запахом. Дышать ею не стоит, так как можно отравиться, да и желание такое вряд ли у кого возникнет. Об этом свойстве говорит уже само название, ведь бром в переводе с древнегреческого означает «вонючка», «вонючий».
Молекула двухатомная, и ее формула — Br 2 . Сам элемент был найден в 1826 году и принес славу своему первооткрывателю — молодому преподавателю Антуану Балару. Распространен бром повсеместно, но больше всего его в морской воде и соленых озерах. Используется в производстве и лабораториях не само вещество, а его раствор, который легко приготовить.
Готовят раствор бромной воды только в вытяжном шкафу из-за ядовитости паров. Для этого берут бром в объеме один миллилитр и заливают в воду (дистиллированную, иначе получится много ненужных примесей) объемом 250 миллилитров, интенсивно мешая стеклянной палочкой. Бромная вода готова. Хранить ее нужно только в темном стекле, герметично закрыв. Будьте осторожны, так как, соприкасаясь с кожей, бром вызывает сильнейшие и болезненные ожоги. Если контакт произошел, срочно промойте пораженное место водой.
Состав бромной воды
Свойства химические и физические
По внешнему виду бромная вода — оранжево-желтая жидкость, взявшая от основного вещества его неприятный запах. Температура, при которой раствор замерзает, довольно низкая. Еще при -20°C она жидкая.
Как и все галогеновые растворы, вода бромная является отличным окислителем, но более слабым, чем раствор хлора. Окисляет она металлы и многие органические соединения, в том числе фенолы. А добавление в нее еще брома приводит к уменьшению pH.
Применение
Применяют бромную воду в промышленных лабораториях. Одной из качественных реакций на непредельные углеводороды является именно взаимодействие алкенов и алкинов с раствором бромной воды. В результате этого состав обесцвечивается. Разрывая двойные и тройные связи, бром присоединяется, образуя бромистые соединения.
Происходит обесцвечивание бромной воды и при реакции с непредельными маслами. В них также присутствуют двойные и тройные связи. Взаимодействие с бромной водой йодистого калия приводит к обесцвечиванию первого и постепенному выделению молекул свободного йода (I 2). Можно провести с бромной водой качественную реакцию на присутствие CuCl, при добавлении небольшого количества аммиачного раствора произойдет покраснение.
В медицине бромную воду применяют при производстве препаратов. Раньше существовала легенда, что солдатам в пищу добавляют бром, чтобы снизить потенцию. Но оснований для этого утверждения нет никаких, так как вещества, содержащие бром, не оказывают на мужскую силу никакого влияния. Они просто действуют на нервную систему как успокаивающее и мягкое снотворное.
Но применяя лекарственные вещества, содержащие бром, следует быть весьма аккуратными, так как длительный прием может вызвать такую болезнь, как бромизм. Основные симптомы заболевания — общий упадок сил, сопровождающийся сыпью на коже и отсутствием аппетита. Для нормализации состояния нужно срочно вывести из организма активное вещество. Для этого прописывают большое количество жидкости и пищу с большим содержанием солей.
Применяется бромная вода и в строительстве — на разных этапах производства веществ, защищающих от пламени ткани, древесину, стройматериалы. Еще эти вещества называют антипиренами. Бромную воду и бромиды применяют в полетах, для окисления ракетного топлива, при добыче нефти, в сельском хозяйстве (производство пестицидов и инсектицидов).
Принято записывать через такую формулу — Br2, хотя она в растворе находится в виде смеси двух кислот — HBrO (бромноватистая кислота) и HBr Данное соединение имеет желто-оранжевый цвет и довольно низкую температуру замерзания. Является сильным окислителем, который способен в щелочной среде окислять катионы таких металлов — Сг +3 , Мп +3 , Fe +2 , Co + 2 , Ni +3 . Добавление Br 2 уменьшает водородный показатель раствора (рН), т.к. бромная вода содержит свободные кислоты.
Это химически активное вещество, которое может вступать во взаимодействие как с неорганическими, так и с органическими веществами. Рассмотрим некоторые химические процессы с данным соединением.
Обесцвечивание бромной воды служит на все Для проведения такого эксперимента необходимо небольшое количество любого алкена или алкина смешать в пробирке с Br 2 . В ходе данной реакции происходит присоединение атомов брома по месту разрыва двойной или тройной связи. Исчезновение желто-оранжевой окраски при таком взаимодействии является доказательством непредельности взятого углеводорода.
Химическая реакция «фенол — бромная вода» используется для осаждения из растворов бромзамещенных соединений. Если данное взаимодействие веществ проводить в безводной среде, то образование трибромфенола займет пару дней. Поэтому в качестве катализатора добавляют небольшое количество Н 2 О.
Бромная вода в лаборатории готовится так: к 1 мл брома добавляют 250 мл дистиллированной воды, при этом интенсивно перемешивают. Приготовленный раствор хранят в плотно закрытой емкости из темного стекла. Если приготовленную Br 2 хранить на свету или в светлой склянке, то будет происходить выделение кислорода из-за содержания бромноватистой кислоты. Работу по приготовлению реактива проводят в вытяжном шкафу. Так как сам бром ядовит, а бромная вода его содержит, то при работе с ней необходимо соблюдать осторожность.
Необходимо учитывать и тот факт, что при попадании Br 2 на кожу появляется сильный зуд, а при длительном воздействии могут возникнуть язвочки. Если вещество попало на кожу, ее следует промыть большим количеством воды, а затем При большой раневой поверхности или глубоких поражениях эпидермиса кожа дополнительно смазывается мазью, в состав которой входит NaHCO 3 .
Бромная вода широко используется в химическом анализе и синтезе органических препаратов. Так, ее используют при производстве бромсодержащих лекарственных средств. И здесь необходимо быть осторожными, т.к. длительное их употребление может привести к заболеванию — бромизм. Основные симптомы — апатия, вялость, появление кожной сыпи. Для более быстрого выведения ионов брома из организма соблюдают диету с повышенным содержанием соли и обильное питье. Еще бромную воду применяют на промежуточных этапах производства антипиренов — веществ, которые защищают от воспламенений. Ими пропитывают ткани, древесину, строительный материал.
Источник