- Аномалии воды и их характеристика
- Интересные факты
- Биологическое значение
- Основные понятия
- Некоторые противоречия в физических свойствах
- Аномалии плотности
- Аномалии сжимаемости
- Температурное поведение теплоемкости
- Причины появления
- «Память» воды
- Вода аномальные свойства их значение
- Аномальные свойства воды
- Опыт № 7. В предыдущем опыте мы убедились, что поверхность воды похожа на тонкую пленку, которая может растягиваться. Теперь мы сможем рассмотреть эту пленку, и увидеть, что она может не только удерживать воду внутри, но и не дает утонуть относительно тяжелым предметам и прогибаться под их весом.
Аномалии воды и их характеристика
Вода является веществом необычным, заслуживающим детального изучения. Советский академик И. В. Петрянов написал об этом удивительном веществе книгу «Самое необыкновенное вещество в мире». Какие аномалии физических свойств воды представляют особый интерес? Вместе будем искать ответ на этот вопрос.
Интересные факты
Мы редко задумываемся над смыслом слова «вода». На нашей планете более 70 % от всей площади занимают реки и озера, моря и океаны, айсберги, ледники, болота, снега на вершинах гор, а также вечная мерзлота. Несмотря на такое огромное количество воды, для питья пригоден только 1 %.
Биологическое значение
Организм человека на 70-80 % состоит из воды. Это вещество обеспечивает протекание всех жизненно важных процессов, в частности, благодаря ей из него выводятся токсины, восстанавливаются клетки. Основной функцией воды в живой клетке является структурно-энергетическая, при снижении количественного содержания ее в теле человека происходит его «усыхание».
Нет такой системы в живом организме, которая бы могла функционировать без H2O. Несмотря на аномалии воды, она является эталоном для определения количества теплоты, массы, температуры, высоты местности.
Основные понятия
H2O — оксид водорода, в котором содержится 11,19 % водорода, 88,81% кислорода по массе. Это бесцветная жидкость, которая не имеет ни запаха, ни вкуса. Вода является обязательным компонентом технологических процессов в промышленности.
Впервые данное вещество было синтезировано в конце 18 века Г. Кавендишем. Ученый взрывал смесь кислорода и водорода электрической дугой. Впервые проанализировал разницу в плотности льда и воды в 1612 году Г. Галилей.
В 1830 году была создана паровая машина французскими учеными П. Дюлонгом и Д. Араго. Это открытие позволило изучить взаимосвязь между давлением насыщенного пара и температурой. В 1910 году американским ученым П. Бриджменом и немцем Г. Тамманом обнаружено несколько полиморфных модификаций у льда при высоком давлении.
В 1932 году американскими учеными Г. Юри и Э. Уошберном была открыта тяжелая вода. Аномалии физических свойств данного вещества были открыты благодаря совершенствованию аппаратуры и методов проведения исследований.
Некоторые противоречия в физических свойствах
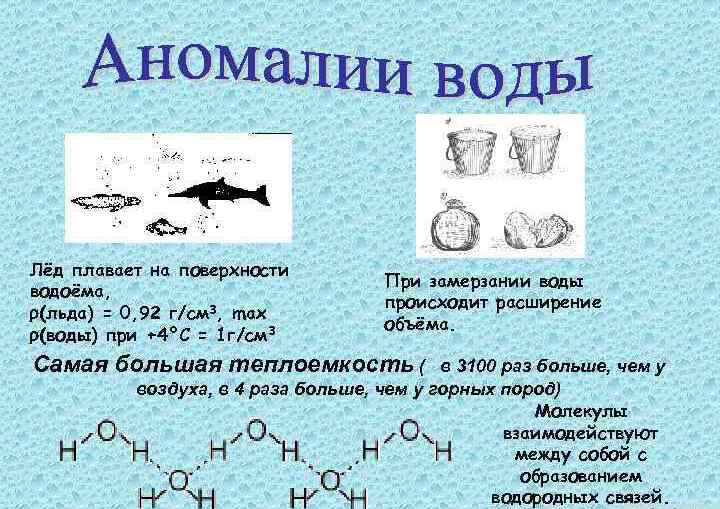
Чистая вода является прозрачной бесцветной жидкостью. Ее плотность при превращении в жидкость из твердого вещества возрастает, в этом проявляется аномалия свойств воды. Нагревание ее от 0 до 40 градусов приводит к росту плотности. В качестве аномалии воды необходимо отметить высокую теплоемкость. Температура кристаллизации составляет 0 градусов по Цельсию, а кипения — 100 градусов.
У молекулы этого неорганического соединения угловое строение. Ядра, входящие в ее состав, формируют равнобедренный треугольник, в основании которого располагаются два протона, а вершиной является атом кислорода.
Аномалии плотности
Ученым удалось выявить порядка сорока особенностей, характерных для H2O. Аномалии воды заслуживают пристального рассмотрения и изучения. Ученые пытаются пояснить причины каждого фактора, дать ему научное объяснение.
Аномалия плотности воды заключается в том, что у данного вещества свое максимальное значение плотность начинается при +3,98°С. При последующем охлаждении, переводе из жидкости в твердое состояние наблюдается уменьшение плотности.
Для остальных соединений плотность в жидкостях при уменьшении температуры снижается, так как увеличение температуры способствует росту кинетической энергии молекул (растет скорость их передвижения), что приводит к повышенной рыхлости вещества.
Рассматривая подобные аномалии воды, необходимо отметить, что и для нее при повышении температуры свойственен рост скорости, но плотность понижается только при повышенных температурных значениях.
После уменьшения плотности льда он будет находиться на поверхности воды. Объяснить данное явление можно тем, что молекулы имеют в кристалле регулярное строение, имеющее пространственную периодичность.
Если у обычных соединений молекулы упакованы в кристаллах плотно, то после плавления вещества, регулярность пропадает. Подобное явление наблюдается только при расположении молекул на значительных расстояниях. Уменьшение плотности при плавлении металлов является ничтожно малой величиной, оценивается в 2-4 %. Плотность воды превышает аналогичный показатель у льда на 10 процентов. Таким образом, это и есть проявление аномалии воды. Химия объясняет подобное явление дипольным строением, а также ковалентной полярной связью.
Аномалии сжимаемости
Продолжим разговор об особенностях воды. Для нее характерно непривычное температурное поведение. Ее сжимаемость, то есть уменьшение объема, по мере повышения давления вполне можно считать примером аномалии физических свойств воды. Конкретно какие особенности здесь необходимо отметить? Другие жидкости гораздо проще сжать под давлением, а вода приобретает такие признаки только при высоких температурах.
Температурное поведение теплоемкости
Данная аномалия является одной из сильнейших для воды. Теплоемкость говорит о том, какое необходимо затратить количество теплоты для того, чтобы повысить температуру на 1 градус. Для многих веществ после плавления теплоемкость жидкости увеличивается не больше чем на 10 процентов. А для воды после плавления льда данная физическая величина возрастает в два раза. Ни у одного вещества подобного роста теплоемкости не зафиксировано.
Во льду та энергия, которая подводится к нему для нагревания, расходуется в большей части на рост скорости движения молекул (кинетическую энергию). Существенный рост после плавления теплоемкости свидетельствует о том, что в воде происходят иные энергоемкие процессы, для которых нужно подводимое тепло. Именно они и являются причиной повышенной теплоемкости. Данное явление характерно для всего диапазона температур, при котором вода имеет жидкое агрегатное состояние.
Как только она превращается в пар, аномалия пропадает. В настоящее время многие ученые занимаются анализом свойств переохлажденной воды. Оно заключается в ее возможности сохранять жидкое состояние ниже точки кристаллизации 0°С.
Переохладить воду вполне можно в тонких капиллярах, а также в неполярной среде в качестве мельчайших капелек. Возникает закономерный вопрос о том, что наблюдается с аномалией плотности в подобной ситуации. По мере переохлаждения плотность воды существенно снижается, она стремится к плотности льда при понижении температурного значения.
Причины появления
Когда спрашивают: «Назовите аномалии воды и охарактеризуйте их причины», необходимо связывать их с перестройкой структуры. Расположение частиц в структуре любого вещества определяется особенностями взаимного расположения в ней частиц (атомов, ионов, молекул). Между молекулами воды действуют водородные силы, которые выводят данную жидкость из зависимости между температурами кипения и плавления, характерной для иных веществ, находящихся в жидком агрегатном состоянии.
Появляются они между молекулами данного неорганического соединения благодаря особенностям распределения плотности электронов. Атомы водорода обладают определенным положительным зарядом, а кислорода — отрицательным. В итоге молекула воды имеет форму правильного тетраэдра. Подобное строение характеризуется валентным углом 109,5°. Самым выгодным расположением является размещение по одной линии кислорода и водорода, имеющих разный заряд, следовательно, водородная связь характеризуется электростатической природой.
Итак, необычные (аномальные) свойства воды являются следствием особенного электронного строения ее молекулы.
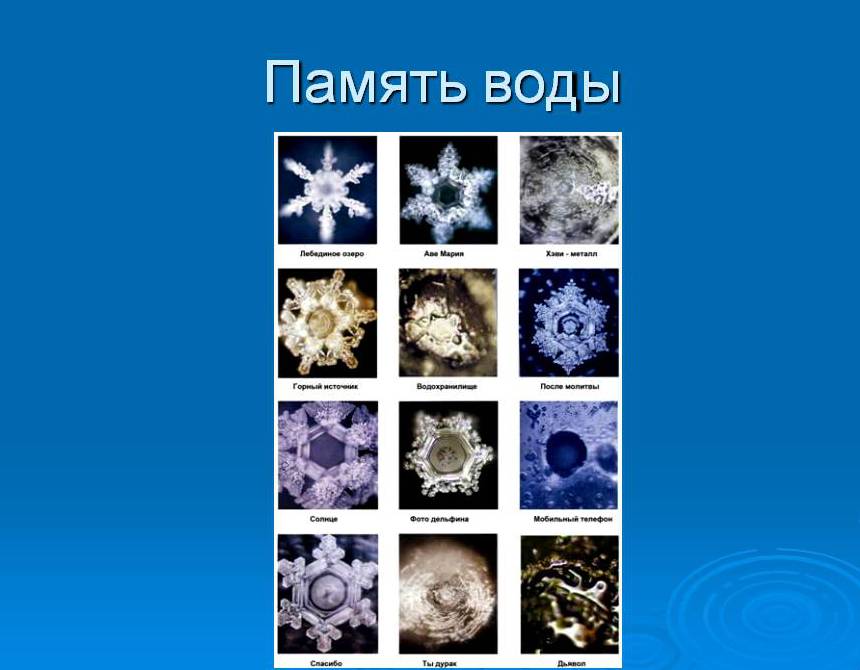
«Память» воды
Есть такое мнение, что вода обладает памятью, может накапливать и переносить энергию, питая тело виртуальной информацией. Длительное время данной проблемой занимался японский ученый Масару Эмото. Результаты своих исследований доктор Эмото опубликовал в книге «Послания воды». Ученым были проведены эксперименты, в рамках которых он сначала замораживал при 5 градусах каплю воды, а потом анализировал структуру кристаллов под микроскопом. Для фиксации получаемых результатов он использовал микроскоп, в который была встроена фотокамера.
В рамках эксперимента Масау Эмото воздействовал на воду разными способами, потом заново ее замораживал, вел фотосъемку. Ему удалось получить зависимость между формой кристаллов льда и музыкой, которую «слушала» вода. Удивительно, но самые гармоничные снежинки ученый зафиксировал при использовании классической и народной музыки.
Использование современной музыки, по мнению Масау, «загрязняет» воду, поэтому им были зафиксированы кристаллы неправильной формы. Интересным фактом является и выявление японским ученым зависимости между формой кристаллов и человеческой энергией.
Вода — это самое удивительное вещество, которое содержится в большом количестве на нашей планете. Сложно представить себе какие-либо сферы деятельности современного человека, в которых бы она не принимала активное участие. Многогранность данного вещества определяется аномалиями, причиной которых стало тетраэдрическое строение воды.
Источник
Вода аномальные свойства их значение
Аномальные свойства воды
Автор работы награжден дипломом победителя III степени
Во 2 классе, на одном из занятий кружка «Необычное в обычном», учитель продемонстрировал нам как иголка не тонет на поверхности воды, налитой в небольшую емкость. Меня это удивило и заинтересовало. Как это может быть, ведь металлическая игла тяжелее? Я захотела подробнее узнать об этом удивительном свойстве воды, и выяснила, что она имеет еще и другие свойства. Я бы их назвала «волшебными», но ученые называют их «аномальными» свойствами воды.
Люди привыкли к воде, и считают ее обычным веществом. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Наука до сих пор не смогла дать объяснение всем аномальным свойствам воды. Целый ряд свойств воды выпадает из общих закономерностей и правил, таких наук как физика и химия. Эти свойства не соответствуют законам «периодической системы», разработанной ученым-химиком Дмитрием Ивановичем Менделеевым. При этом, считается, что вся жизнь на Земле своим существованием во многом обязана аномальным свойствам воды, в частности — поверхностному натяжению. Так ли это на самом деле?
Обоснование выбора темы: с водой мы сталкиваемся ежедневно, и она занимает важнейшее место в нашей жизни. С одной стороны — нет ничего более простого и доступного на планете, как вода, с другой – более загадочного и уникального.
Цель исследования: выяснить причины уникальности воды; при проведении физико-химических опытов, доказать, что вода необычное вещество.
изучить и проанализировать литературу и информацию в Интернете по данной теме;
провести наблюдения за основными состояниями воды, её физическими свойствами;
определить и выделить удивительные свойства воды;
провести эксперименты и опыты, доказывающие уникальность воды;
понаблюдать, как человек использует необычные свойства воды;
Объект исследования: вода.
Предмет исследования: свойства воды, присущие только ей и неочевидные в природе.
Гипотеза: мы предположили, что аномальные свойства воды можно доказать в домашних условиях.
анализ литературы и других источников;
Актуальность заключается в практической значимости уникальности воды на современном этапе развития науки и техники. Проект реализуется в рамках химии и физики и может быть квалифицирован как экспериментально-информационный.
Вода является неотъемлемым компонентом существования всего живого. Это объясняет интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Она обладает свойствами, известными с древних времен. Именно благодаря этим особенностям ее и называют «основой жизни». Так в чем же «чудесность» этих свойств? Давайте разбираться.
Глава № 1. ВОДА В ПРИРОДЕ
Вода – самое значимое вещество для нашей планеты. Без нее на Земле жизнь невозможна, без нее не проходит ни один геологический процесс. Земная вода и поглощает, и возвращает очень много тепла и тем самым «выравнивает» климат. А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров.
Вода входит в состав всех живых и растительных организмов. Вода присутствует не только в организме всех живых существ нашей планеты, но и во всех веществах на Земле – в минералах и горных породах.
Вода находится в постоянном и активном круговороте. Его движущей силой является Солнце, а основным источником воды — Мировой океан. Увлажняющая почву вода всасывается корнями растений. Вместе с водой растения получают растворенные питательные вещества. В растениях она поднимается по стеблям и возвращается в виде пара, в атмосферу через листья.
Вода в естественных природных условиях может существовать в трех агрегатных состояниях: твёрдое – лёд; жидкое – вода; газообразное — водяной пар. Один из ранних греческих философов, Фалес Милетский (640-546 гг. до нашей эры), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом, присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Глава № 2. УДИВИТЕЛЬНЫЕ СВОЙСТВА ВОДЫ
§ 1. Химическая формула воды. Физические свойства воды
Вода — это простейшее химическое соединение двух атомов водорода и одного атома кислорода: H2O. Из химических свойств воды особенно важна способность воды растворять вещества разной химической природы. Она удивительно легко растворяет большое количество самых разнообразных веществ и газов и, что тоже весьма важно, так же легко их отдает.
Физические свойства воды – это свойства, которые проявляются вне химических реакций. Основными физическими свойствами воды являются – запах, цвет, прозрачность, вкус, плотность, температура, жесткость, вязкость, структура.
§ 2. АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ
Многие физические и химические свойства воды удивляют и выпадают из общих правил и закономерностей и являются аномальными. Отдельные свойства воды не соответствуют многим принципам физики и химии. Рассмотрим некоторые уникальные свойства воды.
Горячая вода застывает быстрее холодной
Удивительно, но факт – горячая вода замерзает быстрее холодной, что противоречит логике и общему восприятию вещей. Еще в древности Аристотель обращал внимание на это. В средние века ученые пытались объяснить данный феномен. Затем об этом неудобном факте забыли. И только в 1968 году «вспомнили» благодаря школьнику Эрасто Мпембе из далекой от всякой науки Танзании, который случайно заметил этот факт. Так его и назвали — эффект Мпембы – эффект горячей воды.
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Теплоемкость воды в 10 раз превышает теплоемкость железа. Это значит, что для ее нагревания необходимо большое количество энергии, однако и при остывании энергии выделяется столько же. Это дает возможность в летнее время года накапливать тепло океанам и морям, а высвобождение тепла происходит в зимний период, Теплая вода легче холодной и всегда поднимается вверх. Благодаря этому явлению, называемому «конвекцией», большинство обитателей земных водоемов живут ближе к поверхности.
При замерзании вода увеличивается в объеме
В большинстве случаев при замерзании молекулы веществ располагаются ближе друг к другу, структура их становится компактнее и плотнее. Но с водой эта схема не работает. Плотность воды, при переходе ее из твердого состояния в жидкое, не уменьшается, как почти у всех других веществ, а возрастает. При замораживании объем воды увеличивается на 1%, но при этом становится не такой плотной, поэтому лед всегда легче воды, и находится на ее поверхности. Если бы озера замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.
Температура замерзания и кипения воды не соответствуют общим закономерностям и законам химии. Так, мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно. При -120 ° С с водой начинают происходить странные вещи: она становится тягучей, как патока, а при температуре ниже -135 ° С превращается в «стеклянную» воду — твердое вещество, в котором отсутствует кристаллическая структура.
Вода – уникальный растворитель
Еще одним аномальным свойством воды является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения. В ней можно найти более половины известных химических элементов, одни в высоких концентрациях, а другие – только в следовых количествах. Между ее подвижных молекул могут «затесаться» практически любые вещества – от жидкостей до металлов. Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Молекулы воды активно притягиваются друг к другу, в результате ее поверхность, стремится к минимуму. Именно поэтому естественной формой любой жидкости является шар. Объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы или игла – плавать.
§ 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Те аномальные свойства воды, которые мы описали выше, попробуем проверить в домашних условиях.
Опыт № 1. Проведем эксперимент и понаблюдаем за горячей и холодной водой в морозильной камере.
Условия: В ячейки для льда я налила теплую воду 35 ° С и поставила в морозильную камеру, засекла время превращения воды в лёд. Тоже самое проделала с холодной водой – 0,5 ° С.
Результат: тёплая вода превратилась в лед через 20 минут; холодная вода превратилась в лед через 25 минут. Для опыта необходима вода определенной температуры.
Вывод: горячая вода замерзает быстрее, чем холодная при определенных условиях.
Опыт № 2. В ходе работы над проектом я обратила внимание, что вода может перемещаться самостоятельно.
Условия: Я взяла 3 стакана, в два из них налила воду. Третий оставила пустым и к нему перекинула «мостики» из бумажных салфеток.
Результат: вода по «мостикам» «перешла» в пустой стакан, уровень воды в 3-х стаканах стал почти одинаковый.
Вывод: вода может подниматься вверх без посторонней помощи (приложение № 2) Это удивительное свойство помогает растениям получать влагу из почвы и перемещать от корней по стеблям к листьям.
Опыт № 3. Я задумалась, а какая вода быстрее будет подниматься вверх?
Условия: Я взяла 2 стакана: № 1 — с теплой водой и № 2 — с холодной водой; две полоски картона, один конец которых окрашен в разные цвета маркерами; опустила концы полосок картона в стаканы.
Результат: Краски маркера на полоске в тёплой воде поднялись вверх быстрее и выше, чем в холодной.
Вывод: теплая вода поднимается вверх быстрее холодной (приложение № 3). Теперь мне понятно, почему растения нужно поливать теплой водой, она доставит необходимые питательные вещества из почвы и живительную влагу быстрее.
Опыт № 4. Горку можно соорудить практически из чего угодно — и песка, соли, сахара. А можно ли сделать неподвижную горку из воды?
Условия: Я взяла хорошо вымытый сухой стакан, наполнила его водой до отказа, после чего аккуратно опускала в него по одной монете.
Результат: По мере опускания монет в стакан, вода из него не выливалась, а начала понемногу приподниматься, образуя горку. Это хорошо заметно, если посмотреть на стакан сбоку. По мере увеличения в стакане количества монет, горка становилась всё выше — поверхность воды надулась, словно воздушный шарик. Однако, в какой-то момент этот шарик лопнул, и вода струйками потекла по стенкам стакана. В этом опыте горка на поверхности воды образуется за счёт поверхностного натяжения.
Вывод: Взаимодействуя с твёрдой поверхностью, вода плохо к ней прилипает и плохо растекается. Именно поэтому она не стекает сразу же через край стакана при образовании горки (приложение № 4).
Опыт № 5. А можно ли управлять плавающими на поверхности предметами, при этом ничем их не касаясь.
Условия: В миску, наполненную водой, аккуратно положила 10-12 спичек. Расположила их в форме лучей звезды, по возможности равномерно. Взяла жидкое мыло и капнула в воду в центре спичечной звезды.
Результат: Спички тут же начали плыть от него к краям блюдца.
В другой миске вместо мыла опустила в центр спичечной звезды кончик кусочка сахара-рафинада.
Результат: Спички, наоборот, поплыли в обратном направлении и собрались возле погружённого в воду сахара.
Вывод: Такое поведение спичек обусловлено следующим: погружая в воду разные вещества (мыло и сахар), мы тем самым изменяем силу поверхностного натяжения. Когда капаешь мыло на поверхность жидкости, оно растворяется и смешивается с ней. Молекулы мыла проходят между молекулами воды и снижают их взаимное притяжение. Сахар действует противоположно мылу — он увеличивает поверхностное натяжение. (приложение № 5).
Опыт № 6. Следующий опыт показал, что поверхность воды может растягиваться. Как вы думаете, сколько капелек воды поместится на обычной монетке?
Условия: Я положила монетку на блюдце, а блюдце — на очень ровную поверхность. В пипетку набрала воды, капнула воду в центр монетки с очень близкого расстояния.
Результат: Опытным путем мной установлено, что на 2-х рублевой монетке помещается 20 капель воды, а на 5-ти рублевой — 28 капель. Вода на монете располагается не ровным тонким слоем, как это может показаться перед экспериментом, а образует горку. Поверхность воды растягивается и становится все более выпуклой с каждой новой каплей до тех пор, пока тонкая пленка, которую образует поверхность воды, не порвется. И тогда почти вся вода с монетки вытечет в блюдце
Вывод: Поверхность воды растягивается за счет поверхностного натяжения (приложение № 6).
Опыт № 7. В предыдущем опыте мы убедились, что поверхность воды похожа на тонкую пленку, которая может растягиваться. Теперь мы сможем рассмотреть эту пленку, и увидеть, что она может не только удерживать воду внутри, но и не дает утонуть относительно тяжелым предметам и прогибаться под их весом.
Условия: Я налила воду в стакан, взяла иголку и, держа ее горизонтально, поднесла максимально близко к поверхности воды и опустила.
Результат: Иголка плавает и можно будет рассмотреть, как поверхность воды прогибается под ее весом.
Вывод: Поверхностное натяжение воды позволяет удерживать на поверхности достаточно тяжелые предметы (приложение № 7).
Опыт № 8. В холодное время года наши квартиры теплые благодаря паровому отоплению. А почему в батареях именно вода?
Условия: Я поставила металлический ковш на плиту. Через 10 секунд его нельзя взять в руки — он раскален, так как металл нагрелся. В этот же ковш нальем стакан воды и поставим на плиту. Доводим до кипения, на это нужно уже больше времени. Переливаем горячую воду из ковша в стакан с ложкой.
Результат: Через десять минут металлический ковш остыл, а стакан стал очень горячим. Вода нагрела ложку и стенки стакана.
Вывод: У воды есть свойство долго удерживать тепло. Поэтому в батареях именно вода, ну и, конечно, вода самое доступное текучее вещество (приложение № 9).
Опыт № 9. Вода имеет свойство менять плотность при переходе в твердое состояние. Так ли это на самом деле?
Условия: Я взяла стеклянную бутылку, налила воду и поместила её в морозильную камеру холодильника.
Результат: вода замерзла и расширилась, её объём увеличился и бутылка растрескалась.
Вывод: Вода при низких температурах превращается в лед и при этом расширяется (приложение № 10).
Опыт № 10. Логично было бы предположить, что замерзая, вода, как и любое другое вещество становится тяжелее.
Условия: Кусочек льда я опустила в стакан с водой.
Результат: Лед плавает на поверхности и не тонет.
Вывод: Замерзая, вода увеличивается в объеме, но структура становится более рыхлой. Поэтому лед, легче самой воды, он плавает на поверхности и не тонет.
Опыт № 11. Приведем еще один интересный опыт, который продемонстрирует теплопроводность воды.
Условия: В воздушный шарик я налила холодную воду и немного надула. Поднесла шарик к горящей свече.
Результат: Воздушный шар не лопнул, так как в нем вода. Надуваем другой воздушный шарик и подносим к огню, он лопнул.
Вывод: Теплопроводность воды в 24 раза выше, чем у воздуха. Пока вода не испарится в шарике, он не лопнет (приложение № 12).
Опыт № 12. Жидкости, имеющие разную плотность – не смешиваются.
Условия: В стакан я поочерёдно налила жидкости разной плотности и цвета (растительное масло и воду).
Результат: они не смешиваются.
Вывод: Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Другие вещества, такие как масла, жиры, воск и синтетика не намокают. Они являются гидрофобными. Разная плотность не дает смешиваться молекулам воды и масла (приложение № 13) .
Объект моего исследования – вода — кажется будничным и естественным, только на первый взгляд. Исследование позволило мне сделать вывод, что многие свойства воды, присущи только ей, они обязательно встречаются в природе, но они совсем не так очевидно представляются глазам наблюдателя, как в наших опытах. На основе опытов, мы доказали уникальность воды, как химического вещества, а физические свойства воды действительно обусловлены особенностями ее строения. Гипотеза, что аномальные свойства воды можно доказать в домашних условиях – подтвердилась.
В данной работе были рассмотрены такие уникальные свойства воды, как высокая теплоёмкость, плотность, теплопроводность, конвекция или перемешивание, поверхностное натяжение.
опытным путём рассмотрены различные свойства воды, являющиеся уникальными, как физико-химического вещества;
экспериментально установлено, что физические свойства воды действительно обусловлены особенностями ее строения. На основе это, было доказана уникальность воды, как химического вещества.
Материалы исследования можно применять и использовать на уроках физики в 7-8 классах при изучении темы «Состав и физические свойства воды», а также на факультативных занятиях, внеклассных мероприятиях.
В ходе работы над проектом я научилась самостоятельности, у меня появился интерес к предметам физика и химия, которые мне еще только предстоит изучать, развились исследовательские умения и навыки, например, умение пользоваться дополнительной литературой, думать, рассуждать, делать выводы.
Список использованной литературы
1. Вода для жизни. Сбережем воду – сохраним жизнь. / авт.-сост. А. Н. Пахоменко и др. – Могилев: Могилев. обл. укруп. тип,
2. Врублевский А. И. Основы химии. Школьный курс. – 2-е изд. – Мн.: Юнипресс, 2010г. – 960 с.
3. Глинка Н. Л. Общая химия: учеб. пособие для вузов. – 23-е изд., испр. /Под ред. В. А. Рабиновича. – Л.: Химия, 1983г. – 704 с.
4. Энциклопедический словарь юного физика — М.: Педагогика, 1981
5. https://www.syl.ru/article/368647/anomalnyie-svoystva-vodyi-prichinyi znachenie
Справа – стакан с водой +35 °C, слева – стакан с водой — 0, 5 °C
Горячая вода начала превращаться в лед через 20 минут, холодная через 25 минут
средний стакан пустой, в двух крайних стаканах – вода
вода по бумажным мостикам перешла в средний стакан
картонную полоску с отметкой черного цвета опускаем в стакан с холодной водой, с отметкой коричневого цвета – в стакан с теплой водой
теплая вода поднимается вверх быстрее, чем холодная
мыло уменьшает, а сахар увеличивает, а поверхностное натяжение воды
на двухрублевой монете помещается 20 капель воды
на пятирублевой монете помещается 28 капель воды
на поверхности воды спокойно плавают металлические игла, скрепка, лезвие
горячий металлический ковш остыл очень быстро, а стакан с водой – нет
при замерзании вода увеличилась в объеме
кусочек льда не тонет в воде
воздушный шар, наполненный водой, не лопается
Источник