- Фенолы
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Химия. 10 класс
- § 28. Химические свойства, получение и применение фенола
- Химические свойства фенола
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
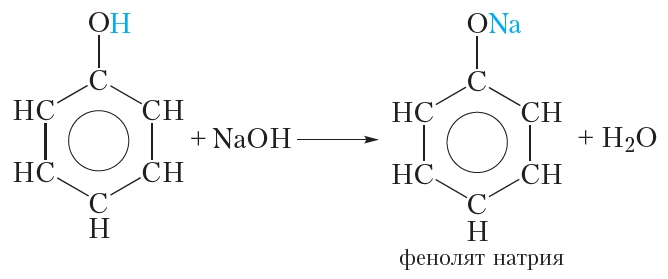
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
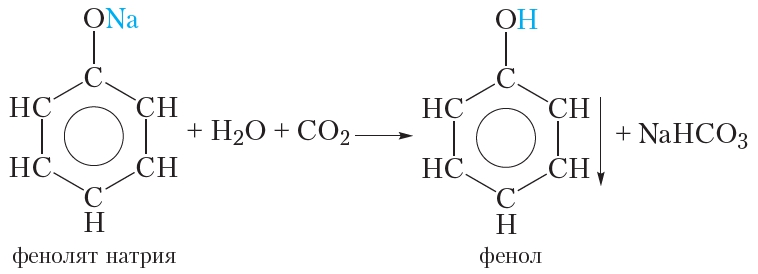
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
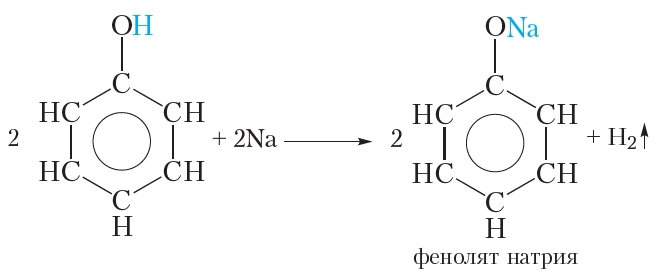
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
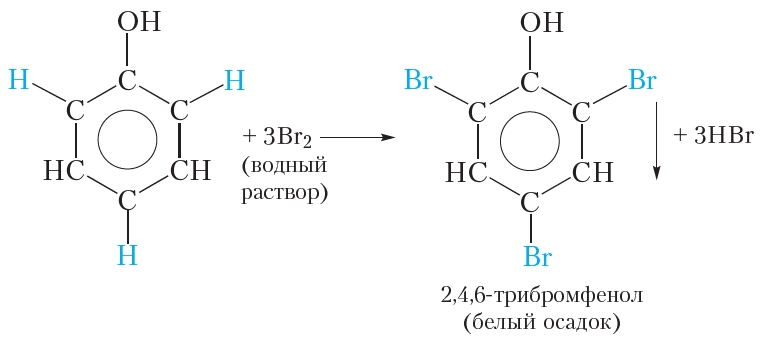
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
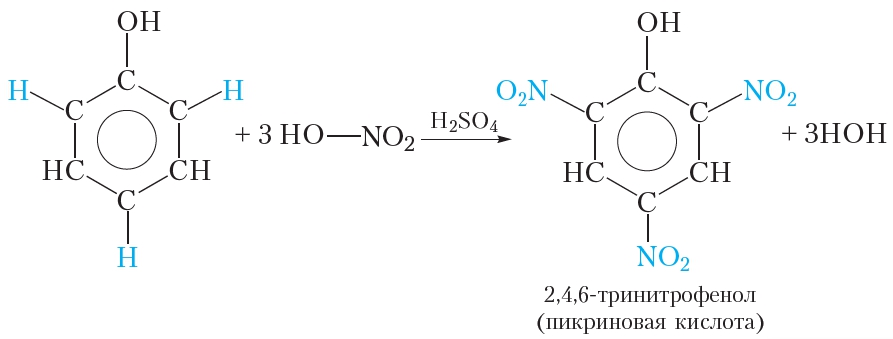
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Источник
Химия. 10 класс
§ 28. Химические свойства, получение и применение фенола
Химические свойства фенола
В молекуле фенола имеется гидроксильная группа, следовательно, можно ожидать, что фенол будет проявлять химические свойства, присущие спиртам. В то же время из-за влияния бензольного кольца на гидроксильную группу некоторые свойства фенола отличаются от химических свойств спиртов.
1. Взаимодействие со щелочными металлами
Подобно спиртам, фенол реагирует со щелочными металлами. Если в расплавленный фенол пометить кусочек металлического натрия, наблюдается выделение водорода (температура плавления фенола невысока и составляет всего 41 °С). В ходе реакции атом водорода гидроксильной группы замещается на атом натрия:
В результате образуется фенолят натрия. Феноляты, подобно алкоголятам, представляют собой твёрдые солеподобные вещества.
Реакция фенола со щелочными металлами свидетельствует о том, что фенол, как и спирты, проявляет слабые кислотные свойства.
2. Взаимодействие со щелочами (отличие фенола от спиртов)
Кислотные свойства фенола выражены сильнее, чем у спиртов. Это проявляется в том, что, в отличие от спиртов, фенол взаимодействует со щелочами:
Образующийся фенолят натрия хорошо растворяется в воде. Таким образом фенол умеренно растворим в воде, но хорошо растворяется в растворе гидроксида натрия, так как при этом образуется растворимый фенолят натрия. Усиление кислотных свойств фенола по сравнению со спиртами обусловлено влиянием бензольного кольца, которое приводит к уменьшению прочности связи О—Н. В результате атом водорода гидроксильной группы молекулы фенола может замещаться на атом металла не только при взаимодействии со щелочными металлами, но и со щелочами.
По кислотным свойствам фенол превосходит не только спирты, но и воду. Поэтому феноляты, в отличие от алкоголятов, не разлагаются водой. Наличие у фенола кислотных свойств отражает его тривиальное название — карболовая кислота.
Тем не менее фенол — очень слабая кислота. Даже угольная кислота сильнее фенола и поэтому вытесняет его из фенолята натрия:
Эту реакцию можно осуществить следующим образом. Через раствор фенолята натрия пропускают углекислый газ, при этом наблюдается помутнение раствора, так как образующийся фенол выпадает в осадок.
3. Взаимодействие с бромной водой (отличие фенола от бензола)
В молекуле фенола содержится бензольное кольцо, следовательно, можно ожидать, что фенол будет проявлять химические свойства, присущие ароматическим углеводородам, например бензолу. Как вы уже знаете, для бензола характерны реакции замещения атомов водорода. Так, бензол в присутствии катализатора реагирует с бромом. При этом протекает реакция замещения одного атома водорода на бром:
Бромную воду бензол не обесцвечивает!
В молекуле фенола гидроксильная группа влияет на свойства бензольного кольца, облегчая замещение атомов водорода, поэтому взаимодействие фенола с бромом легко протекает и без катализатора. Так, при смешивании разбавленного раствора фенола с бромной водой наблюдается обесцвечивание бромной воды и выпадение белого осадка. Уравнение протекающей реакции:
В результате реакции происходит замещение трёх атомов водорода бензольного кольца атомами брома и образуется 2,4,6-трибромфенол. Отметим, что замещение атома водорода бензольного кольца атомом брома возможно и для бензола, но условия протекания реакции гораздо более жёсткие, чем для фенола. Для этого требуется бром, а не бромная вода, а также катализатор. Бромирование фенола протекает в мягких условиях, что свидетельствует о повышенной реакционной способности бензольного кольца фенола. Это обусловлено влиянием гидроксильной группы, которая облегчает замещение атомов водорода в положениях 2, 4, 6 бензольного кольца молекулы фенола.
4. Взаимодействие с азотной кислотой
При взаимодействии фенола со смесью концентрированных азотной и серной кислот можно заместить три атома водорода бензольного кольца на группы —NO2:
В результате реакции образуется 2,4,6-тринитрофенол. Кислотные свойства 2,4,6-тринитрофенола выражены значительно сильнее, чем у фенола. Тривиальное название 2,4,6-тринитрофенола — пикриновая кислота. Пикриновая кислота и её соли являются взрывчатыми веществами.
Рассмотренные химические свойства фенола демонстрируют взаимное влияние атомов в молекулах органических соединений: бензольное кольцо усиливает кислотность гидроксильной группы молекулы фенола, в свою очередь, гидроксильная группа влияет на бензольное кольцо, облегчая замещение атомов водорода в положениях 2, 4, 6.
Источник