- Почему вода полярная молекула? — 2021
- «Ил-2 Штурмовик» нового поколения — «Битва за Сталинград» и «Битва за Москву» #14
- Полярность молекулы воды
- Почему вода является полярным растворителем
- Почему вода не в периодической таблице?
- Почему вода более плотная, чем лед?
- Почему вода в ядерном реакторе светится синим
- Структура молекул воды и их ассоциатов
- Какое строение имеет молекула воды
- Какое строение имеет молекула воды
- Водородная связь
- Строение молекулы в различных агрегатных состояниях
- Жидкая вода
- Водяной пар
- Из чего состоит вода
- Элементы
- Подводим итоги
Почему вода полярная молекула? — 2021
«Ил-2 Штурмовик» нового поколения — «Битва за Сталинград» и «Битва за Москву» #14
Вода является полярной молекулой, а также действует как полярный растворитель.Когда химическое вещество называется «полярным», это означает, что положительный и отрицательный электрические заряды распределены неравномерно. Положительный заряд исходит от атомного ядра, а электроны поставляют отрицательный заряд. Именно движение электронов определяет полярность. Вот как это работает для воды.
Полярность молекулы воды
Вода (ч2О) является полярным из-за изогнутой формы молекулы. Форма означает большую часть отрицательного заряда от кислорода на стороне молекулы, а положительный заряд атомов водорода находится на другой стороне молекулы. Это пример полярной ковалентной химической связи. Когда растворенные вещества добавляются в воду, они могут зависеть от распределения заряда.
Причина, по которой форма молекулы не является линейной и неполярной (например, как СО2) из-за разницы в электроотрицательности между водородом и кислородом. Значение электроотрицательности водорода равно 2,1, а электроотрицательности кислорода — 3,5. Чем меньше разница между значениями электроотрицательности, тем более вероятно, что атомы образуют ковалентную связь. Большая разница между значениями электроотрицательности наблюдается с ионными связями. Водород и кислород оба действуют как неметаллы в обычных условиях, но кислород несколько более электроотрицателен, чем водород, поэтому два атома образуют ковалентную химическую связь, но она полярна.
Крайне электроотрицательный атом кислорода притягивает к нему электроны или отрицательный заряд, делая область вокруг кислорода более отрицательной, чем области вокруг двух атомов водорода. Электрически положительные части молекулы (атомы водорода) отклоняются от двух заполненных орбиталей кислорода. По сути, оба атома водорода притягиваются к одной и той же стороне атома кислорода, но они настолько далеки друг от друга, насколько могут быть, потому что оба атома водорода несут положительный заряд. Изогнутая конформация — это баланс между притяжением и отталкиванием.
Помните, что хотя ковалентная связь между каждым водородом и кислородом в воде является полярной, молекула воды в целом является электрически нейтральной молекулой. Каждая молекула воды имеет 10 протонов и 10 электронов для суммарного заряда 0.
Почему вода является полярным растворителем
Форма каждой молекулы воды влияет на то, как она взаимодействует с другими молекулами воды и другими веществами. Вода действует как полярный растворитель, потому что она может быть притянута к положительному или отрицательному электрическому заряду растворенного вещества. Небольшой отрицательный заряд вблизи атома кислорода притягивает соседние атомы водорода из воды или положительно заряженных областей других молекул. Слегка положительная водородная сторона каждой молекулы воды притягивает другие атомы кислорода и отрицательно заряженные области других молекул. Водородная связь между водородом одной молекулы воды и кислородом другой удерживает воду вместе и придает ей интересные свойства, однако водородные связи не так прочны, как ковалентные связи. Хотя молекулы воды притягиваются друг к другу посредством водородных связей, около 20% из них в любой момент времени могут свободно взаимодействовать с другими химическими веществами. Это взаимодействие называется гидратацией или растворением.
Почему вода не в периодической таблице?
Вы не найдете воды в периодической таблице элементов. Вот объяснение, почему вода не считается элементом.
Почему вода более плотная, чем лед?
Вода плотнее льда? Вода необычна тем, что ее максимальная плотность проявляется как жидкость, а не как твердое вещество. Это означает, что лед плавает на воде.
Почему вода в ядерном реакторе светится синим
Вода в ядерном реакторе действительно светится синим цветом. Вот объяснение того, как это работает, и определение черенковского излучения.
Источник
Структура молекул воды и их ассоциатов
«Мир чарующий и фантастический», — такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Вода начинается с молекулы
Итак, молекула воды ( 1 H2 16 O) состоит из двух атомов водорода ( 1 H) и одного атома кислорода ( 16 O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его – сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, – по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
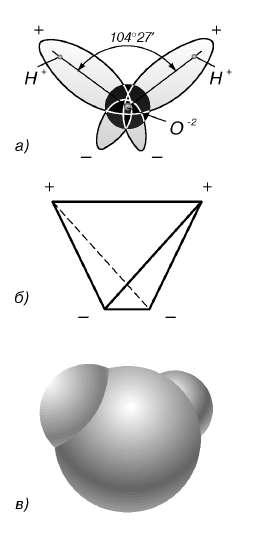
Рис. 1.5. Строение молекулы воды
а – угол между связями O-H;
б – расположение полюсов заряда;
в – внешний вид электронного облака молекулы воды.
Электронное строение молекулы воды
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно – в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром O 2 (рис. 1.5а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра – ядра O2-. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра – протоны – оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Вода — диполь: полярность воды
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом – 1,87 дебая ( Дебай – внесистемная единица электрического дипольного 3,33564·1030 Кл·м). Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.
Также, последние исследования установили полярность кластеров воды .
Вода растворяет все!
Во многом благодаря диэлектрической проницаемости, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
Минеральный состав воды
В пресных природных водах – речных, озерных – содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном – 18, а в Красном море – около 40 г/л. В среднем в 1 л океанской воды растворено 34. 35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно – натрия и кальция), на 10% – из сульфатов (натрия, калия и магния), на 1% – из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) – до 80%. Сульфатов (натрия, кальция и магния) – около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода – до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты – растворимые соединения типа белков, сахаров, спиртов, углеводородов и т.п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
Формирование кластеров воды
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Оказывается, полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (H2O)x
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес-кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов
Возможны и другие модели водной структуры . Тетраэдрически связанные молекулы воды образуют своеобразные «рои» довольно стабильного состава. Пространства между «роями» заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры – нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Источник
Какое строение имеет молекула воды
Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
В статье мы подробно рассмотрим особенности строения молекулы воды в различных агрегатных состояниях: жидком, твердом, газообразном.
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью. Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.

По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода. Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.

Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком. Это ее преимущественное состояние в нормальных условиях. Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан.
- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Она участвует в мировом круговороте воды в природе. Благодаря испарению с поверхности водоемов, почвы, растений образуются облака. Затем они выпадают в виде дождя, снега, града, питая собой подземные воды и родники. Родниковые воды по рекам попадает в море.
Таким образом, количество воды на Земле не изменяется, она только меняет свои формы — это и есть круговорот воды в природе.
Уникальное строение молекулы воды помогает ей трансформироваться в три агрегатных состояния.
При замерзании воды ее молекулы собираются в небольшие группы. При испарении находится на расстоянии относительно друг друга. Жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
- Химия и микробиология воды. Учебное пособие В. В. Котов, Г.А. Нетесова
- Конспект лекций ГИДРОГЕОХИМИЯ. Киреева Т.А., МГУ им. М.В. Ломоносова, 2016
Источник









