Вода для инъекций качественный анализ
Одним из приоритетных направлений государственной политики в Российской Федерации являются вопросы совершенствования лекарственного обеспечения населения. В рамках выполнения поставленной государством задачи принят ряд документов, направленных на обеспечение населения качественными, эффективными и безопасными лекарственными препаратами. Одним из таких документов являются «Правила надлежащей производственной практики Евразийского экономического союза», (GMP – Good Manufacturing Practice), утвержденные решением Совета Евразийской Экономической Комиссии от 3 ноября 2016 г. № 77 и введенными в действие на территории РФ с 6 мая 2017 г. Правила GMP устанавливают требования к промышленному производству различных лекарственных форм. Другим документом, направленным на совершенствование лекарственной помощи населению, является Приказ МЗ РФ № 647н от 31.08.2016 г. «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения», определяющий переход аптек на стандарты GPP (Good Pharmacy Practice) [1, 2].
Правила надлежащих практик основаны не на функциональном, а на процессном подходе. В соответствии с этой концепцией, вся деятельность аптечных организаций рассматривается как набор процессов. Все процессы, происходящие как на промышленных предприятиях, так и в аптеках, должны быть подробно описаны в документах.
Одним из типов регламентирующих документов, требуемых надлежащей производственной и аптечной практиками, являются стандартные операционные процедуры (СОПы) – внутренние нормативные акты, содержащие требования к выполнению определенных операций. СОП можно рассматривать как инструкцию по проведению определенного процесса, в которой подробно представлены полномочия и ответственность каждого сотрудника, стандартизована каждая манипуляция, учтены все риски и меры предосторожности. В то же время стандартные операционные процедуры должны быть написаны в форме, предполагающей обязательность их выполнения.
Принятые в настоящее время Правила GPP не оправдывают в полной мере ожидания фармацевтических работников, занятых экстемпоральным изготовлением лекарственных препаратов в условиях аптек, так как содержат требования главным образом к аптечному ритейлу, практически не затрагивая внутриаптечную производственную деятельность. Требования к качеству лекарственных средств, изготовленных в аптеке, установлены соответствующими нормативными правовыми и методическими документами [3]. Провизор-аналитик в аптеке, выполняя контроль качества изготовленных лекарственных средств (ЛС), должен руководствоваться одновременно целым рядом нормативно-правовых документов, а методики проведения испытаний разрабатывать самостоятельно, руководствуясь действующей Государственной фармакопеей. Все это в значительной степени определяет необходимость создания СОП, являющейся четкой и подробной пошаговой инструкцией, отражающей все виды деятельности сотрудника аптеки, занятого контролем качества изготовленных ЛС.
В производственных аптеках контролю качества воды для инъекций уделяют особое внимание, так как она является основным растворителем при изготовлении большинства парентеральных лекарственных форм. В Государственной фармакопее XIV представлено три фармакопейных статьи, регламентирующих качество различных видов воды для фармацевтических целей. Впервые введена статья на воду для гемодиализа. Фармакопейные статьи, регламентирующие контроль качества различных видов воды, отличаются показателями чистоты. Так, вода для инъекций должна быть апирогенной, а также выдерживать все требования, предъявляемые к воде очищенной.
Цель работы: разработка стандартной операционной процедуры «Анализ воды для инъекций» в условиях производственных аптек.
Материалы и методы исследования
Стандартная операционная процедура «Анализ воды для инъекций» разработана на основе требований фармакопейной статьи ГФ РФ XIV издания 2.2.0019.18 «Вода для инъекций» и в соответствии с действующей нормативно-правовой документацией, регламентирующей деятельность аптек.
Результаты исследования и их обсуждение
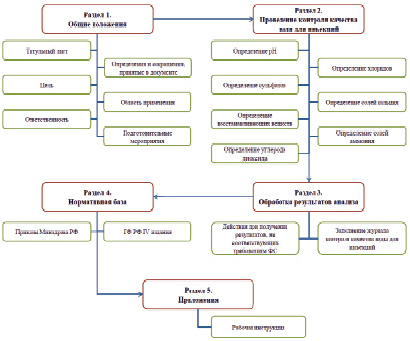
Основные разделы стандартной операционной процедуры по контролю качества воды для инъекций можно представить в виде рисунка.
Раздел 1. Общие положения
В первом разделе СОП необходимо указать общие положения документа: цель, область применения, ответственность сторон, дату введения и актуализации. Титульный лист может быть оформлен в виде таблицы. Необходимо дать расшифровку всем сокращениям, используемые в документе.
Цель стандартной операционной процедуры «Анализ воды для инъекций» определена как стандартизация контроля качества воды для инъекций в условиях производственной аптеки. Применять документ обязаны сотрудники аптеки, занятые внутриаптечным контролем качества. На них же возлагается ответственность по соблюдению всех требований этого документа.
Заключительным этапом первого раздела являются подготовительные мероприятия, которые можно разделить на несколько подразделов. Иерархия подразделов определяется тем, что согласно Правилам, утвержденным приказом МЗ РФ № 751н от 26.10.2015, разделу VII, п.130 вода для инъекций ежедневно проверяется на отсутствие хлоридов, сульфатов, солей кальция, солей аммония, восстанавливающих веществ, углерода диоксида в соответствии с требованиями действующей Государственной фармакопеи XIV издания и ФС.2.2.0019.18 «Вода для инъекций» [3].
В связи с чем необходимо составить список необходимых реактивов, посуды, приборов, необходимых для контроля качества этих показателей. При выполнении контроля качества воды для инъекций в производственных аптеках необходимо провести подготовку приборов и оборудования: для определения рН используют иономеры или рН-метры, требования к которым указаны в ГФ XIV [4].
Перечень реактивов, используемых для контроля качества воды для инъекций, а также их количество соответствует перечню реактивов, используемых при анализе воды очищенной в условиях производственных аптек, так как большинство показателей качества совпадают [5].
Перечень лабораторной посуды, используемой при анализе воды для инъекций также аналогичен наименованиям и количеству посуды, необходимой для контроля качества воды очищенной. Но так как в аптеках, кроме хлоридов, сульфатов, солей кальция, контролируют и другие примеси, указанные в нормативной документации, то необходимо список посуды дополнить необходимыми для анализа цилиндрами, бюретками и термостойкими колбами.
Отбор проб воды для инъекций осуществляют согласно требованиям действующей фармакопеи [6, 7]: 200 мл воды для инъекций, необходимой для анализа одной пробы, ежедневно из каждого баллона отбирает сотрудник аптеки, ответственный за контроль качества изготовленных лекарственных форм. Ежеквартально вода для инъекций должна направляться в аккредитованную в установленном порядке испытательную лабораторию (центр) для полного анализа в соответствии с требованиями Государственной фармакопеи и иных, утвержденных в установленном порядке нормативных правовых актов. Отбор проб и их предоставление на анализ в сторонние лаборатории, а также получение результатов анализа осуществляет провизор-аналитик.
Основные разделы стандартной операционной процедуры «Анализ воды для инъекций» в условиях производственных аптек
Раздел 2. Контроль качества воды для инъекций
В данном разделе должен быть пошагово описан порядок выполнения методики. Необходимо учитывать возможность применения данного документа для обучения новых сотрудников, поэтому вся информация этого раздела должна быть описана четко, детально и полно, по возможности исключая необходимость к обращению к дополнительным источникам информации.
Методика определения рН в воде для инъекций
Определение проводят потенциометрически в соответствии с требованиями ОФС.1.2.1.0004.15 «Ионометрия». Подготовку приборов к работе и проведение измерений выполняют так же, как и для воды очищенной [8].
Методика проведения испытания на недопустимые примеси в воде для инъекций [8]
Хлориды, сульфаты и соли кальция – это недопустимые примеси. Процедура обнаружения недопустимых примесей ионов представлена в ОФС ГФ РФ XIV «Испытания на чистоту и допустимые пределы примесей» в пункте 6 раздела «Общие замечания». Однако целесообразно в СОП прописать пошаговые действия провизора-аналитика для осуществления данной манипуляции. Этот раздел СОП можно представить в виде табл. 1.
Восстанавливающие вещества и углерода диоксид – недопустимые специфические примеси, их обнаружение проводят по методикам, приведенным в ФС.2.2.0019.18 «Вода для инъекций». В качестве шаблона СОП для этого раздела можно использовать табл. 2.
Методика проведения испытания на допустимые примеси в воде для инъекций
Соли аммония – допустимая примесь в воде для инъекций. Определение этой примеси проводят, используя стандартный раствор аммония (1 ppm аммоний-иона), и руководствуясь методикой ФС.2.2.0019.18 «Вода для инъекций». Целесообразно этот раздел СОП также представить в виде табл. 3.
Раздел 3. Обработка результатов анализа воды для инъекций
Согласно требованиям приказа МЗ РФ № 751н от 26.10.2015 г. в производственных аптеках ведется журнал регистрации результатов контроля качества воды очищенной, воды для инъекций. По результатам проведенных испытаний воды для инъекций провизор-аналитик заполняет этот журнал.
Определение недопустимых примесей в воде для инъекций, определяемых по унифицированным методикам
Заключение по содержанию примеси
Хлориды (Cl-), Сульфаты (SO42-), Кальций (Ca2+)
Примечание. Методики определения, уравнения химических реакций, а также заключения по содержанию примесей хлоридов, сульфатов и солей кальция представлены в работе [8].
Определение недопустимых специфических примесей в воде для инъекций
Заключение по содержанию примеси
100 мл воды для инъекций доводят до кипения, прибавляют 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведенной 16 %, кипятят в течение 10 мин; розовое окрашивание должно сохраниться
MnO4- + 8H+ +5e > Mn2+ + 4H2O
вода для инъекций соответствует/не соответствует требованиям по содержанию восстанавливающих веществ
При взбалтывании воды для инъекций с равным объемом раствора кальция гидроксида (известковой воды) в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение 1 ч
Са(ОН)2 + СО2 > СаСО3v + Н2О
вода для инъекций соответствует/не соответствует требованиям по содержанию углерода диоксида [9]
Определение допустимой примеси аммония в воде для инъекций
Заключение по содержанию примеси
Не более 0,00002 % (0,2 ppm)
20 мл испытуемой воды для инъекций помещают в пробирку, прибавляют 1,0 мл щелочного раствора калия тетрайодмеркурата. Через 5 мин просматривают вдоль вертикальной оси пробирок вниз, окраска раствора по интенсивности не должна превышать окраску стандартного раствора, приготовленного одновременно таким же образом путем прибавления 1,0 мл щелочного раствора калия тетрайодмеркурата к смеси 4 мл стандартного раствора аммония (1 ppm аммоний-иона) и 16 мл воды, свободной от аммиака
NH4+ + 2K2[НgI4] + 2KOH =
= [NH2Hg2I2]Iv + 5KI + K+ + 2H2O
вода для инъекций соответствует/не соответствует требованиям по содержанию аммония
Примечание. Методика приготовления стандартного раствора аммония (1 ppm аммоний-иона) представлена в Государственной фармакопее.
Рабочая инструкция по контролю качества воды для инъекций
Методика проведения испытания
В термостойкую колбу помещают 100 мл воды для инъекций, доводят до кипения + 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведенной 16 %, кипятят в течение 10 мин
Розовое окрашивание должно сохраниться
50 мл воды для инъекций + 50 мл раствора кальция гидроксида (известковой воды) в наполненном доверху и хорошо закрытом сосуде взбалтывают
Не должно быть помутнения в течение 1 ч
Берут две пробирки. В одну из них 20 мл испытуемой воды для инъекций + 1,0 мл щелочного раствора калия тетрайодмеркурата. В другую пробирку 4 мл стандартного раствора аммония + 16 мл воды, свободной от аммиака, + 1,0 мл щелочного раствора калия тетрайодмеркурата. Через 5 минут просматривают вдоль вертикальной оси пробирок вниз
Окраска испытуемого раствора по интенсивности не должна превышать окраску стандартного раствора
Заполняют журнал регистрации результатов контроля воды для инъекций
Удовлетворяет/ не удовлетворяет
Примечание. Методики проведения испытаний, нормативные требования для показателей рН, хлориды, сульфаты и соли кальция аналогичны выполняемым испытаниям при контроле качества воды очищенной.
Раздел 4. Нормативная база, используемая при создании СОП
Основными нормативно-правовыми документами, используемыми при контроле качества воды для инъекций в производственных аптеках, являются ГФ РФ XIV и приказы МЗ РФ, регламентирующие контроль качества лекарственных препаратов.
Раздел 5. Приложения к стандартной операционной процедуре «Анализ воды очищенной»
Приложения могут содержать краткие инструкции, находящиеся на рабочем месте (табл. 4), а также приказы, таблицы и другую справочную информацию, необходимую для осуществления контроля качества воды для инъекций.
Разработан алгоритм составления СОП для контроля качества воды для инъекций в условиях производственных аптек. Описаны разделы СОП, включая подготовку приборов, реактивов, рассмотрены методики проведения анализа. Представлен дизайн рабочей инструкции по контролю качества воды для инъекций.
Предложенный формат стандартной операционной процедуры для контроля качества воды для инъекций может быть использован аптеками, занятыми изготовлением и контролем качества лекарственных форм, как шаблон при разработке собственных СОПов.
Источник
КАЧЕСТВЕННЫЙ АНАЛИЗ ВОДЫ ОЧИЩЕННОЙ В АПТЕКАХ
AQUA PURIFICATA
К 10 мл воды прибавляют 0,5 мл разведенной азотной кислоты, 0,5 мл 2% раствора нитрата серебра. Через 5 минут вода должна оставаться прозрачной.В присутствии примесей хлоридов выпадает белый творожистый осадок (или белая опалесценция), не растворимый в азотной кислоте и растворимый в растворе гидрооксида аммония.
AgCl↓ + 2NH4OH -= [Ag(NH3)2]Cl + 2H20 хлорид диаммин серебра
К 10 мл воды прибаатяют 0,5 мл разведенной хлористоводородной кислоты, 1 мл 5 % раствора бария хлорида. Через 10 минут вода должна оставаться прозрачной.
В присутствии примесей сульфатов наблюдают выделение белого кристаллического осадка, который не растворим в растворах минеральных кислот и щелочей.
К 10 мл воды добавляют 1 мл раствора оксалата аммония. Через 10 минут вода должна оставаться прозрачной.
В присутствии солей кальция наблюдают белый осадок, растворимый r азотной и соляной кислотах, но не растворимый в уксусной кислоте и растворе гидроксида аммония.
АЛГОРИТМ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ ВОДЫ ОЧИЩЕННОЙ
1. Работа с рецептом не проводится
2. Письменный контроль
Проверка записей в «Журнале регистрации результатов контроля «Воды очищенной», «Воды для инъекций».
1. Органолептический контроль
Бесцветная прозрачная жидкость без запаха и механических включений.
1. Физический контроль
1. Химический контроль
По приказу М3 РФ № 214 от 16.10.97 проводится качественный химический контроль на отсутствие примесей хлоридов, сульфатов, солей кальция.
1. Оформление результатов контроля
Сделать записи в «Журнале регистрации результатов контроля «Воды очищенной», «Воды для инъекций» (наличие и отсутствие ионов отмечается знаком + или —).
1. Контроль при отпуске
Больным не отпускается.
Состоит в проверке правильности оформления баллонов для ассистентской:
Aqua purificata Дата получения.
• поставить номер анализа и подпись.
ВНУТРИАПТЕЧНЫЙ КОНТРОЛЬ ВОДЫ ДЛЯ ИНЪЕКЦИЙ. AQUA PRO INJECTIONIBUS
Определение примесей хлоридов, сульфатов и солей кальция см. выше.
1. Восстанавливающие вещества
100 мл воды доводят до кипения, прибавляют 2 мл разведенной серной кислоты, 1 мл 0,01 моль/л раствора перманганата калия и кипятят 10 минут. Розовая окраска должна сохраниться. В присутствии примесей восстанавливающих веществ происходит обесцвечивание раствора.
К 10 мл воды (в пробирке) прибавляют 3 капли реактива Несслера. Через 5 минут вода должна оставаться бесцветной или допускается едва заметное, слегка желтоватое окрашивание.
1. Углерода диоксид
При взбалтывании воды очищенной с равным объемом известковой воды в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение 1 часа.
В присутствие примесей диоксида углерода наблюдают появление белой мути.
Са(ОН), + СО, -» СаС031 + Н,0 бел.
Алгоритм внутриаптечного контроля воды для инъекций составьте | самостоятельно, аналогично приведенному выше.
ЗАНЯТИЕ 7
АНАЛИЗ РАСТВОРА ПЕРЕКИСИ ВОДОРОДА 3 % — 50 МЛ № 20 ВНУТРИАПТЕЧНАЯ ЗАГОТОВКА
Задачи
1. Освоить внутриаптечный контроль внутриаптечной заготовки раствора перекиси водорода.
2. Научиться делать обзор возможных методов химического анализа и выбирать наиболее рациональный.
3. Совершенствовать навыки титриметрического определения с использованием окрашенного титранта.
4. Научиться делать заключение и оформлять результаты анализа.
Вопросы для самоподготовки
I. Перечислите требования ГФ по изготовлению и отпуску растворов перекиси водорода.
1. Приказ М3 РФ № 751 о химическом контроле внутриаптечной заготовки. Особенности внутриаптечного контроля данного вида продукции. Составьте алгоритм внутриаптечного контроля.
2. Приведите реакции подлинности раствора перекиси водорода.
3. Приведите обзор возможных методов количественного определения лекарственной формы и выберите наиболее рациональный и экономически выгодный.
4. Укажите различия внутриаптечного контроля раствора перекиси водорода и его фармакопейного анализа.
Материальное обеспечение
Реактивы и растворители:
• раствор калия дихромата.
Титрованные растворы и индикаторы:
• 0,1 моль/л раствор перманганата калия.
Посуда, приборы, оборудование:
• мерные пипетки 2 мл и 5 мл;
• мерная колба 50 мл;
• колба для титрования.
Общие указания
Изготовление и отпуск растворов перекиси водорода следует производить в соответствии с указаниями ГФ, приведенными в соответствующих статьях.
В ГФ X включена статья Solutio Hydrogenii peroxydi diluia (2,7 — 3,3%).
Perhydrolum, т.е. концентрированный раствор перекиси водорода (27,5 — 31 %), рассматривается в ГФ X в разделе «Реактивы».
1. Если в рецепте прописано «Solutio Hydrogenii peroxydi» и не указана концентрация, то следует отпустить «Solutio Hydrogenii peroxydi 3 %».
2. Если в рецепте прописан раствор перекиси водорода другой концентрации, чем 3 %, то его изготовляют разведением пергидроля или раствора перекиси водорода водой, исходя из фактического содержания перекиси водорода в исходном препарате.
Перекись водорода проявляет как окислительные, так и восстановительные свойства. Она устойчива в чистом состоянии и в водных растворах (при обычной температуре), однако присутствие солей тяжелых металлов, диоксида марганца, следов щелочей, окислителей и восстановителей, даже попадание пылинок и соприкосновение с шероховатой поверхностью стек-ла резко ускоряет процесс разложения перекиси водорода.
Разложению перекиси водорода способствуют и ферменты — катала-
за, пероксидаза, содержащиеся в крови, слюне и других биологических жид-
костях. Однако существует ряд ингибиторов этой реакции, которые исполь-
зуют для предотвращения разложения не только концентрированных, но и
разбавленных растворов перекиси водорода. Так, при изготовлении внутри-
аптечной заготовки добавляют 0,05 % бензоата натрия.
Хранят 3 % раствор перекиси водорода в склянках с притертыми стек-
лянными пробками в прохладном, защищенном от света месте. Препарат весь-
ма не стоек и разрушается даже от щелочности стекла.
По приказу М3 РФ № 214 от 26.10.15 внутриаптечные заготовки под-
лежит полному химическому контролю обязательно (каждая серия).
В письменном контроле проверяются записи в книге учета лабора-
торных и фасовочных работ (на русском языке). Каждая серия внутриаптеч-
ной заготовки и фасовки подвергается физическому контролю, проверяют
не менее 3-х упаковок (флаконов).
Rp: Solutionis Hydrogenii peroxydi 50 ml
D.S. Наружное
№ 20 Внутриаптечная заготовка
Бесцветная прозрачная жидкость без запаха или со слабым своеоб-
разным запахом, кислой реакции среды.
Подлинность
К 0,5 мл препарата прибавляют 2—3 капли разведенной серной кисло-
ты, 1-2 мл эфира, 3-4 капли раствора калия дихромата и взбалтывают. Эфир-
ный слой окрашивается в синий цвет.
Синий цвет
Количественное определение
Помещают 2 мл препарата в мерную колбу емкостью 50 мл и объем доводят водой до метки, перемешивают.
1. Метод перманганатометрии
К 5 мл полученного раствора прибавляют 3 мл разведенной серной кислоты и титруют 0,1 моль/л раствором калия перманганата до слабо-розового окрашивания.
1 мл 0,1 моль/л раствора калия перманганата соответствует 0,001701 г перекиси водорода, которой в препарате должно быть 2,7- 3,3 %.
АЛГОРИТМ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ ВНУТРИАПТЕЧНОЙ ЗАГОТОВКИ РАСТВОРА ПЕРЕКИСИ ВОДОРОДА 3 % — 50 МЛ № 20
1. Письменный контроль
Проверяется запись в книге учета лабораторных и фасовочных работ: Воды очищенной 900 мл
Натрия бензоата 0,5 г
Пергидрола 100 мл
№ анализа Подпись провизора-аналитика
1. Органолептический контроль
Бесцветная прозрачная жидкость без запаха или со слабым запахом без механических включений.
1. Физический контроль
• = 50 ml доп. отк = ± 4 %
Количество флаконов — 20
Проверяется не менее 3-х флаконов от данной серии внутриаптечной заготовки.
Проверяется герметичность укупорки.
1. Химический контроль
По приказу М3 РФ № 751 проводится полный химический контроль обязательно.
Качественный химический контроль:
Количественный химический контроль:
Содержание Н202 в пределах [2,7 — 3,3 %] (раствор стандартный, поэтому содержание указывается в процентах, как в ГФ ).
1. Оформление результатов анализа:
• заполнить «Журнал регистрации органолептического, физически/ го и химического контроля внутриаптечной заготовки, лекарственных форм, изготовленных по индивидуальным рецептам (требованиям ЛУ), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки»;
• в книге учета лабораторных и фасовочных работ поставить № анализа и подпись провизора-аналитика
1. Контроль при отпуске:
• основная этикетка «Наружное», дополнительная «Хранить в прохладном, защищенном от света месте»;
• указаны номер и место нахождения аптеки, состав на русском языке, номер серии, срок годности (2 года), дата изготовления, цена.
ЗАНЯТИЕ 8
Дата добавления: 2018-08-06 ; просмотров: 8489 ; Мы поможем в написании вашей работы!
Источник