Вода для инъекций примеси допустимые
Одним из приоритетных направлений государственной политики в Российской Федерации являются вопросы совершенствования лекарственного обеспечения населения. В рамках выполнения поставленной государством задачи принят ряд документов, направленных на обеспечение населения качественными, эффективными и безопасными лекарственными препаратами. Одним из таких документов являются «Правила надлежащей производственной практики Евразийского экономического союза», (GMP – Good Manufacturing Practice), утвержденные решением Совета Евразийской Экономической Комиссии от 3 ноября 2016 г. № 77 и введенными в действие на территории РФ с 6 мая 2017 г. Правила GMP устанавливают требования к промышленному производству различных лекарственных форм. Другим документом, направленным на совершенствование лекарственной помощи населению, является Приказ МЗ РФ № 647н от 31.08.2016 г. «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения», определяющий переход аптек на стандарты GPP (Good Pharmacy Practice) [1, 2].
Правила надлежащих практик основаны не на функциональном, а на процессном подходе. В соответствии с этой концепцией, вся деятельность аптечных организаций рассматривается как набор процессов. Все процессы, происходящие как на промышленных предприятиях, так и в аптеках, должны быть подробно описаны в документах.
Одним из типов регламентирующих документов, требуемых надлежащей производственной и аптечной практиками, являются стандартные операционные процедуры (СОПы) – внутренние нормативные акты, содержащие требования к выполнению определенных операций. СОП можно рассматривать как инструкцию по проведению определенного процесса, в которой подробно представлены полномочия и ответственность каждого сотрудника, стандартизована каждая манипуляция, учтены все риски и меры предосторожности. В то же время стандартные операционные процедуры должны быть написаны в форме, предполагающей обязательность их выполнения.
Принятые в настоящее время Правила GPP не оправдывают в полной мере ожидания фармацевтических работников, занятых экстемпоральным изготовлением лекарственных препаратов в условиях аптек, так как содержат требования главным образом к аптечному ритейлу, практически не затрагивая внутриаптечную производственную деятельность. Требования к качеству лекарственных средств, изготовленных в аптеке, установлены соответствующими нормативными правовыми и методическими документами [3]. Провизор-аналитик в аптеке, выполняя контроль качества изготовленных лекарственных средств (ЛС), должен руководствоваться одновременно целым рядом нормативно-правовых документов, а методики проведения испытаний разрабатывать самостоятельно, руководствуясь действующей Государственной фармакопеей. Все это в значительной степени определяет необходимость создания СОП, являющейся четкой и подробной пошаговой инструкцией, отражающей все виды деятельности сотрудника аптеки, занятого контролем качества изготовленных ЛС.
В производственных аптеках контролю качества воды для инъекций уделяют особое внимание, так как она является основным растворителем при изготовлении большинства парентеральных лекарственных форм. В Государственной фармакопее XIV представлено три фармакопейных статьи, регламентирующих качество различных видов воды для фармацевтических целей. Впервые введена статья на воду для гемодиализа. Фармакопейные статьи, регламентирующие контроль качества различных видов воды, отличаются показателями чистоты. Так, вода для инъекций должна быть апирогенной, а также выдерживать все требования, предъявляемые к воде очищенной.
Цель работы: разработка стандартной операционной процедуры «Анализ воды для инъекций» в условиях производственных аптек.
Материалы и методы исследования
Стандартная операционная процедура «Анализ воды для инъекций» разработана на основе требований фармакопейной статьи ГФ РФ XIV издания 2.2.0019.18 «Вода для инъекций» и в соответствии с действующей нормативно-правовой документацией, регламентирующей деятельность аптек.
Результаты исследования и их обсуждение
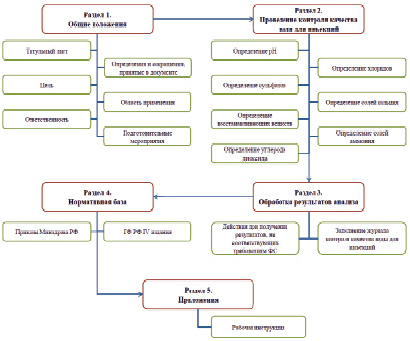
Основные разделы стандартной операционной процедуры по контролю качества воды для инъекций можно представить в виде рисунка.
Раздел 1. Общие положения
В первом разделе СОП необходимо указать общие положения документа: цель, область применения, ответственность сторон, дату введения и актуализации. Титульный лист может быть оформлен в виде таблицы. Необходимо дать расшифровку всем сокращениям, используемые в документе.
Цель стандартной операционной процедуры «Анализ воды для инъекций» определена как стандартизация контроля качества воды для инъекций в условиях производственной аптеки. Применять документ обязаны сотрудники аптеки, занятые внутриаптечным контролем качества. На них же возлагается ответственность по соблюдению всех требований этого документа.
Заключительным этапом первого раздела являются подготовительные мероприятия, которые можно разделить на несколько подразделов. Иерархия подразделов определяется тем, что согласно Правилам, утвержденным приказом МЗ РФ № 751н от 26.10.2015, разделу VII, п.130 вода для инъекций ежедневно проверяется на отсутствие хлоридов, сульфатов, солей кальция, солей аммония, восстанавливающих веществ, углерода диоксида в соответствии с требованиями действующей Государственной фармакопеи XIV издания и ФС.2.2.0019.18 «Вода для инъекций» [3].
В связи с чем необходимо составить список необходимых реактивов, посуды, приборов, необходимых для контроля качества этих показателей. При выполнении контроля качества воды для инъекций в производственных аптеках необходимо провести подготовку приборов и оборудования: для определения рН используют иономеры или рН-метры, требования к которым указаны в ГФ XIV [4].
Перечень реактивов, используемых для контроля качества воды для инъекций, а также их количество соответствует перечню реактивов, используемых при анализе воды очищенной в условиях производственных аптек, так как большинство показателей качества совпадают [5].
Перечень лабораторной посуды, используемой при анализе воды для инъекций также аналогичен наименованиям и количеству посуды, необходимой для контроля качества воды очищенной. Но так как в аптеках, кроме хлоридов, сульфатов, солей кальция, контролируют и другие примеси, указанные в нормативной документации, то необходимо список посуды дополнить необходимыми для анализа цилиндрами, бюретками и термостойкими колбами.
Отбор проб воды для инъекций осуществляют согласно требованиям действующей фармакопеи [6, 7]: 200 мл воды для инъекций, необходимой для анализа одной пробы, ежедневно из каждого баллона отбирает сотрудник аптеки, ответственный за контроль качества изготовленных лекарственных форм. Ежеквартально вода для инъекций должна направляться в аккредитованную в установленном порядке испытательную лабораторию (центр) для полного анализа в соответствии с требованиями Государственной фармакопеи и иных, утвержденных в установленном порядке нормативных правовых актов. Отбор проб и их предоставление на анализ в сторонние лаборатории, а также получение результатов анализа осуществляет провизор-аналитик.
Основные разделы стандартной операционной процедуры «Анализ воды для инъекций» в условиях производственных аптек
Раздел 2. Контроль качества воды для инъекций
В данном разделе должен быть пошагово описан порядок выполнения методики. Необходимо учитывать возможность применения данного документа для обучения новых сотрудников, поэтому вся информация этого раздела должна быть описана четко, детально и полно, по возможности исключая необходимость к обращению к дополнительным источникам информации.
Методика определения рН в воде для инъекций
Определение проводят потенциометрически в соответствии с требованиями ОФС.1.2.1.0004.15 «Ионометрия». Подготовку приборов к работе и проведение измерений выполняют так же, как и для воды очищенной [8].
Методика проведения испытания на недопустимые примеси в воде для инъекций [8]
Хлориды, сульфаты и соли кальция – это недопустимые примеси. Процедура обнаружения недопустимых примесей ионов представлена в ОФС ГФ РФ XIV «Испытания на чистоту и допустимые пределы примесей» в пункте 6 раздела «Общие замечания». Однако целесообразно в СОП прописать пошаговые действия провизора-аналитика для осуществления данной манипуляции. Этот раздел СОП можно представить в виде табл. 1.
Восстанавливающие вещества и углерода диоксид – недопустимые специфические примеси, их обнаружение проводят по методикам, приведенным в ФС.2.2.0019.18 «Вода для инъекций». В качестве шаблона СОП для этого раздела можно использовать табл. 2.
Методика проведения испытания на допустимые примеси в воде для инъекций
Соли аммония – допустимая примесь в воде для инъекций. Определение этой примеси проводят, используя стандартный раствор аммония (1 ppm аммоний-иона), и руководствуясь методикой ФС.2.2.0019.18 «Вода для инъекций». Целесообразно этот раздел СОП также представить в виде табл. 3.
Раздел 3. Обработка результатов анализа воды для инъекций
Согласно требованиям приказа МЗ РФ № 751н от 26.10.2015 г. в производственных аптеках ведется журнал регистрации результатов контроля качества воды очищенной, воды для инъекций. По результатам проведенных испытаний воды для инъекций провизор-аналитик заполняет этот журнал.
Определение недопустимых примесей в воде для инъекций, определяемых по унифицированным методикам
Заключение по содержанию примеси
Хлориды (Cl-), Сульфаты (SO42-), Кальций (Ca2+)
Примечание. Методики определения, уравнения химических реакций, а также заключения по содержанию примесей хлоридов, сульфатов и солей кальция представлены в работе [8].
Определение недопустимых специфических примесей в воде для инъекций
Заключение по содержанию примеси
100 мл воды для инъекций доводят до кипения, прибавляют 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведенной 16 %, кипятят в течение 10 мин; розовое окрашивание должно сохраниться
MnO4- + 8H+ +5e > Mn2+ + 4H2O
вода для инъекций соответствует/не соответствует требованиям по содержанию восстанавливающих веществ
При взбалтывании воды для инъекций с равным объемом раствора кальция гидроксида (известковой воды) в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение 1 ч
Са(ОН)2 + СО2 > СаСО3v + Н2О
вода для инъекций соответствует/не соответствует требованиям по содержанию углерода диоксида [9]
Определение допустимой примеси аммония в воде для инъекций
Заключение по содержанию примеси
Не более 0,00002 % (0,2 ppm)
20 мл испытуемой воды для инъекций помещают в пробирку, прибавляют 1,0 мл щелочного раствора калия тетрайодмеркурата. Через 5 мин просматривают вдоль вертикальной оси пробирок вниз, окраска раствора по интенсивности не должна превышать окраску стандартного раствора, приготовленного одновременно таким же образом путем прибавления 1,0 мл щелочного раствора калия тетрайодмеркурата к смеси 4 мл стандартного раствора аммония (1 ppm аммоний-иона) и 16 мл воды, свободной от аммиака
NH4+ + 2K2[НgI4] + 2KOH =
= [NH2Hg2I2]Iv + 5KI + K+ + 2H2O
вода для инъекций соответствует/не соответствует требованиям по содержанию аммония
Примечание. Методика приготовления стандартного раствора аммония (1 ppm аммоний-иона) представлена в Государственной фармакопее.
Рабочая инструкция по контролю качества воды для инъекций
Методика проведения испытания
В термостойкую колбу помещают 100 мл воды для инъекций, доводят до кипения + 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведенной 16 %, кипятят в течение 10 мин
Розовое окрашивание должно сохраниться
50 мл воды для инъекций + 50 мл раствора кальция гидроксида (известковой воды) в наполненном доверху и хорошо закрытом сосуде взбалтывают
Не должно быть помутнения в течение 1 ч
Берут две пробирки. В одну из них 20 мл испытуемой воды для инъекций + 1,0 мл щелочного раствора калия тетрайодмеркурата. В другую пробирку 4 мл стандартного раствора аммония + 16 мл воды, свободной от аммиака, + 1,0 мл щелочного раствора калия тетрайодмеркурата. Через 5 минут просматривают вдоль вертикальной оси пробирок вниз
Окраска испытуемого раствора по интенсивности не должна превышать окраску стандартного раствора
Заполняют журнал регистрации результатов контроля воды для инъекций
Удовлетворяет/ не удовлетворяет
Примечание. Методики проведения испытаний, нормативные требования для показателей рН, хлориды, сульфаты и соли кальция аналогичны выполняемым испытаниям при контроле качества воды очищенной.
Раздел 4. Нормативная база, используемая при создании СОП
Основными нормативно-правовыми документами, используемыми при контроле качества воды для инъекций в производственных аптеках, являются ГФ РФ XIV и приказы МЗ РФ, регламентирующие контроль качества лекарственных препаратов.
Раздел 5. Приложения к стандартной операционной процедуре «Анализ воды очищенной»
Приложения могут содержать краткие инструкции, находящиеся на рабочем месте (табл. 4), а также приказы, таблицы и другую справочную информацию, необходимую для осуществления контроля качества воды для инъекций.
Разработан алгоритм составления СОП для контроля качества воды для инъекций в условиях производственных аптек. Описаны разделы СОП, включая подготовку приборов, реактивов, рассмотрены методики проведения анализа. Представлен дизайн рабочей инструкции по контролю качества воды для инъекций.
Предложенный формат стандартной операционной процедуры для контроля качества воды для инъекций может быть использован аптеками, занятыми изготовлением и контролем качества лекарственных форм, как шаблон при разработке собственных СОПов.
Источник
ФС.2.2.0019.18 Вода для инъекций
ФС.2.2.0019.18 Вода для инъекций
Настоящая фармакопейная статья распространяется на нефасованную воду для инъекций, получаемую из воды питьевой методами дистилляции, ионного обмена, обратного осмоса, комбинацией этих методов или другим способом, или из воды, очищенной методом дистилляции, и предназначенную для производства или изготовления парентеральных и других лекарственных средств.
При использовании воды для инъекций в технологии парентеральных и других лекарственных средств, получаемых непосредственно перед применением, в условиях, исключающих последующую стерилизацию лекарственных препаратов, вода для инъекций должна быть стерильной.
Вода для инъекций должна быть апирогенной и не должна содержать антимикробных консервантов или других добавок.
Описание. Бесцветная прозрачная жидкость без запаха.
Кислотность или щелочность. К 20 мл воды для инъекций прибавляют 0,05 мл 0,1 % раствора фенолового красного. При появлении желтого окрашивания оно должно измениться на красное от прибавления не более 0,1 мл 0,01 М раствора натрия гидроксида. При появлении красного окрашивания оно должно измениться на желтое от прибавления не более 0,15 мл 0,01 М раствора хлористоводородной кислоты.
Электропроводность. Определение проводят в соответствии с ОФС «Электропроводность» с помощью оборудования – кондуктометров, внесенных в Государственный реестр средств измерений.
Оборудование
Кондуктометрическая ячейка:
— электроды из подходящего материала, такого как нержавеющая сталь;
— константа ячейки обычно устанавливается поставщиком и впоследствии проверяется через соответствующие интервалы времени с использованием сертифицированного стандартного раствора с электропроводностью менее 1500 мкСм/см или путем сравнения с ячейкой, имеющей аттестованную константу ячейки. Константа ячейки считается подтвержденной, если найденное значение находится в пределах 2 % от значения, указанного в сертификате; в противном случае должна быть проведена повторная калибровка.
Кондуктометр. Точность измерения должна быть не менее 0,1 мкСм/см в низшем диапазоне.
Калибровка системы (ячейки электропроводности и кондуктометра). Калибровка должна проводиться с использованием одного или более соответствующих стандартных растворов (ОФС «Электропроводность»). Допустимое отклонение должно составлять не более 3 % от измеренного значения электропроводности.
Калибровка кондуктометра. Калибровку кондуктометра проводят с использованием сопротивлений высокой точности или эквивалентным прибором после отсоединения ячейки электропроводности для всех интервалов, использующихся для измерения электропроводности и калибровки ячейки, с погрешностью не более 0,1 % от сертифицированной величины.
В случае невозможности отсоединения ячейки электропроводности, вмонтированной в производственную линию, калибровка может быть проведена относительно предварительно калиброванной ячейки электропроводности, помещенной в поток воды для инъекции рядом с калибруемой ячейкой.
Методика
Стадия 1
Измеряют электропроводность без температурной компенсации с одновременной регистрацией температуры. Измерение электропроводности с помощью кондуктометров с температурной компенсацией возможно только после соответствующей валидации.
Находят ближайшее значение температуры (табл. 1), меньше измеренного. Соответствующая величина электропроводности является предельно допустимой.
Вода для инъекций соответствует требованиям, если измеренное значение электропроводности не превышает найденного по табл. 1 предельно допустимого значения.
Таблица 1 – Предельно допустимые значения электропроводности воды для инъекций в зависимости от температуры
| Температура, °С | |||
| 0 | 0,6 | 55 | 2,1 |
| 5 | 0,8 | 60 | 2,2 |
| 10 | 0,9 | 65 | 2,4 |
| 15 | 1,0 | 70 | 2,5 |
| 20 | 1,1 | 75 | 2,7 |
| 25 | 1,3 | 80 | 2,7 |
| 30 | 1,4 | 85 | 2,7 |
| 35 | 1,5 | 90 | 2,7 |
| 40 | 1,7 | 95 | 2,9 |
| 45 | 1,8 | 100 | 3,1 |
| 50 | 1,9 | — | — |
Для значений температур, не представленных в табл. 1, вычисляют максимально допустимое значение электропроводности путем интерполяции ближайших к полученному верхнему и нижнему значениям, приведенным в табл. 1.
Если величина электропроводности превышает приведенное в табл. 1
значение, продолжают испытания в соответствии с требованиями стадии 2.
Стадия 2
Не менее 100 мл воды для инъекций помещают в сосуд. При постоянном перемешивании устанавливают температуру в пределах 25 ± 1 °С и измеряют электропроводность через каждые 5 мин до тех пор, пока изменение электропроводности за 5 мин не составит менее 0,1 мкСм/см. Фиксируют это значение электропроводности.
Вода для инъекций удовлетворяет требованиям, если полученное значение электропроводности составляет не более 2,1 мкСм/см.
Если значение электропроводности более 2,1 мкСм/см, проводят испытания в соответствии с требованиями стадии 3.
Стадия 3
Испытание выполняют в течение приблизительно 5 мин после проведения испытания по стадии 2, поддерживая температуру в пределах 25 ± 1 °С. Прибавляют свежеприготовленный насыщенный раствор калия хлорида к воде для инъекций (0,3 мл на 100 мл воды для инъекций) и определяют pH с точностью до 0,1.
Определяют предельное значение электропроводности (табл. 2) для данного рН.
Вода для инъекций удовлетворяет требованиям по электропроводности, если величина электропроводности, полученная на стадии 2, не превышает значения, приведенного в табл. 2. Если полученная на стадии 2 величина электропроводности превышает значение, приведенное в табл. 2, или значение рН находится за пределами диапазона 5,0 – 7,0, то вода для инъекций не соответствует требованиям по показателю
«Электропроводность».
мкСм/см
мкСм/см
Сухой остаток. Не более 0,001 %. 100 мл воды для инъекций выпаривают досуха и сушат при температуре от 100 до 105 °С до постоянной массы.
Восстанавливающие вещества. 100 мл воды для инъекций доводят до кипения, прибавляют 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведенной 16 %, кипятят в течение 10 мин; розовое окрашивание должно сохраниться.
Углерода диоксид. При взбалтывании воды для инъекций с равным объемом раствора кальция гидроксида (известковой воды) в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение 1 ч.
Нитраты и нитриты. Не более 0,00002 % (0,2 ppm). 5 мл испытуемой воды для инъекций помещают в пробирку, погруженную в ледяную воду, прибавляют 0,4 мл 10 % раствора калия хлорида, 0,1 мл 0,1 % раствора дифениламина и по каплям при перемешивании 5 мл серной кислоты, свободной от азота. Пробирку помещают на водяную баню при температуре 50 °С. Через 15 мин синяя окраска раствора по интенсивности не должна превышать окраску стандартного раствора, приготовленного одновременно таким же образом с использованием смеси 4,5 мл воды, свободной от нитратов и 0,5 мл стандартного раствора нитрата (2 ppm нитрат-иона).
Примечание. Приготовление стандартного раствора нитрата (2 ppm нитрат-иона). 0,815 г калия нитрата помещают в мерную колбу вместимостью 500 мл, растворяют в воде и доводят объем раствора водой до метки. 1,0 мл полученного раствора помещают в мерную колбу вместимостью 500 мл и доводят объем раствора водой, свободной от нитратов, до метки.
Аммоний. Не более 0,00002 % (0,2 ppm). 20 мл испытуемой воды для инъекций помещают в пробирку, прибавляют 1,0 мл щелочного раствора калия тетрайодмеркурата. Через 5 мин просматривают вдоль вертикальной оси пробирки вниз; окраска раствора по интенсивности не должна превышать окраску стандартного раствора, приготовленного одновременно таким же образом путем прибавления 1,0 мл щелочного раствора калия тетрайодомеркурата к смеси 4 мл стандартного раствора аммония (1 ppm аммоний-иона) и 16 мл воды, свободной от аммиака.
Примечание. Приготовление стандартного раствора аммония (1 ppm аммоний-иона). 0,741 г аммония хлорида помещают в мерную колбу вместимостью 1000 мл, растворяют в воде и доводят объем раствора водой до метки. 1,0 мл полученного раствора помещают в мерную колбу вместимостью 250 мл и доводят объем раствора водой, свободной от аммиака, до метки.
Хлориды. К 10 мл воды для инъекций прибавляют 0,5 мл азотной кислоты, 0,5 мл 2 % раствора серебра нитрата, перемешивают и выдерживают в течение 5 мин. Не должно быть опалесценции.
Сульфаты. К 10 мл воды для инъекций прибавляют 0,1 мл хлористоводородной кислоты разведенной 7,3 % и 0,1 мл 6,1 % раствора бария хлорида. В течение не менее 1 ч не должно наблюдаться помутнение.
Кальций и магний. К 100 мл воды для инъекций прибавляют 2 мл аммония хлорида буферного раствора рН 10,0, 50 мг индикаторной смеси эриохрома черного Т и 0,5 мл 0,01 М раствора натрия эдетата; должно наблюдаться чисто синее окрашивание раствора (без фиолетового оттенка).
Алюминий. Не более 0,000001 % (0,01 ppm) (ОФС «Алюминий», метод 1). Испытание проводят для воды для инъекций, предназначенной для использования в производстве растворов для диализа.
Испытуемый раствор. К 400 мл испытуемой воды для инъекций прибавляют 10 мл ацетатного буферного раствора рН 6,0 и 100 мл воды дистиллированной.
Эталонный раствор. К 2 мл стандартного раствора алюминий-иона (2 мкг/мл) прибавляют 10 мл ацетатного буферного раствора рН 6,0 и 98 мл воды дистиллированной.
Контрольный раствор. К 10 мл ацетатного буферного раствора рН 6,0
прибавляют 100 мл воды дистиллированной
Тяжелые металлы. Не более 0,00001 % (0,1 ppm).
Определение проводят одним из приведенных методов.
Метод 1. В пробирку диаметром около 1,5 см помещают 10 мл испытуемой воды для инъекций, прибавляют 1 мл уксусной кислоты разведенной 30 % и 2 капли 2 % раствора натрия сульфида. Через 1 мин производят наблюдение окраски раствора вдоль вертикальной оси пробирки, помещенной на белую поверхность. Не должно быть окрашивания.
Метод 2. 120 мл испытуемой воды для инъекций упаривают до объема 20 мл. Оставшаяся после упаривания вода в объеме 10 мл должна выдерживать испытание на тяжелые металлы (ОФС «Тяжелые металлы») с использованием эталонного раствора, содержащего 1 мл стандартного раствора свинец-иона (5 мкг/мл) и 9 мл испытуемой воды для инъекций.
Примечание. Стандартный раствор свинец-иона (5 мкг/мл) готовят разведением стандартного раствора свинец-иона (100 мкг/мл) испытуемой водой для инъекций.
Контрольный раствор. 10 мл испытуемой воды для инъекций.
Микробиологическая чистота. Общее число аэробных микроорганизмов (бактерий и грибов) не более 10 КОЕ в 100 мл. Не допускается наличие Еscherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa в 100 мл. Для определения микробиологической чистоты воды для инъекций используют образец объемом не менее 1000 мл.
Исследование проводят методом мембранной фильтрации в асептических условиях в соответствии с требованиями ОФС «Микробиологическая чистота».
Бактериальные эндотоксины. Не более 0,25 ЕЭ/мл (ОФС «Бактериальные эндотоксины»).
Хранение и распределение. Воду для инъекций хранят и распределяют в условиях, предотвращающих рост микроорганизмов и исключающих возможность любой другой контаминации
Источник