- Познание мира
- Вода — определение, структура, характеристики, свойства и функции
- Структура воды
- В газовой фазе
- В жидкой фазе
- В твердой фазе
- Водородная связь в воде
- Характеристики / Свойства воды
- Физические свойства воды
- Вода как растворитель
- Высокая удельная теплоемкость
- Аномальное расширение воды
- Биологические функции воды
- Структура, свойства и биологические функции воды
Познание мира
Вода — определение, структура, характеристики, свойства и функции
Вода — это неорганическое жидкое химическое вещество, не имеющее цвета, запаха и вкуса, которое составляет большую часть гидросферы Земли и жидкостей в организме всех живых существ.
- Вода — чрезвычайно важный компонент для существования жизни, поскольку она жизненно важна для всех биологических процессов. Однако, она не имеет калорийности или питательной ценности.
- Вода находится в жидком состоянии при стандартных атмосферных температуре и давлении.
- Занимает 71% всей суши на Земле и около 70% от общей массы тела человека.
- Вода также важна для различных химических процессов, поскольку является универсальным растворителем.
Структура воды
- Химическая формула воды — H 2 O, что указывает на то, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода.
- Атомы в молекуле воды связаны друг с другом полярными ковалентными связями. Сама по себе молекула электрически нейтральна, но полярна с отрицательными и положительными зарядами, локализованными в разных областях.
В газовой фазе
- В молекуле воды s- и p-орбитали валентной оболочки sp 3 гибридизуются с образованием четырех гибридных sp 3 орбиталей, тетраэдрически ориентированных вокруг атома кислорода.
- Две гибридные орбитали заняты поодиночке, а неподеленные пары электронов занимают две другие.
- Каждая отдельная занятая sp 3 -орбиталь перекрывается наполовину заполненной орбиталью атома H.
- В результате атом кислорода связан с двумя атомами водорода двумя ковалентными связями ОН, и на атоме кислорода находятся две неподеленные пары электронов.
- Структура молекулы воды имеет угловатую изогнутую структуру.
- Молекула воды полярна, потому что кислород более электроотрицателен, чем водород. Таким образом, атом кислорода притягивает к себе общие электроны.
- В результате на атоме кислорода развивается частичный отрицательный заряд, а у атома водорода — частичный положительный заряд.
В жидкой фазе
- В жидкой фазе молекулы воды удерживаются вместе межмолекулярными водородными связями.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сетку связей.
В твердой фазе
- Твердая форма воды — это лед, который может существовать в различных кристаллических формах в зависимости от условий замерзания воды.
- В обычном гексагональном льду каждый атом кислорода тетраэдрически окружен четырьмя другими атомами кислорода, тогда как один атом водорода находится между каждой парой кислорода.
- Таким образом, каждый атом водорода ковалентно связан с одним атомом кислорода и связан с другим атомом кислорода водородной связью.
- Такое расположение вызывает упаковку атомов с большими открытыми пространствами, что приводит к уменьшению плотности льда по сравнению с жидкой водой.
- Когда лед тает, некоторые водородные связи разрываются, и молекулы воды становятся более плотными.
Водородная связь в воде
- Благодаря полярности молекул воды они способны притягивать друг друга. Эти взаимодействия представляют собой слабые притяжения, называемые водородными связями.
- Водородная связь в воде — это слабое взаимодействие между частично положительным атомом водорода и частично отрицательным атомом кислорода.
- Водородная связь в воде является межмолекулярной и происходит между двумя атомами двух разных молекул.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сетку связей.
- Структура, образованная после образования водородных связей, приводит к тому, что коллективное основное состояние жидкой воды имеет энергию ниже, чем основное состояние в отдельных газообразных молекулах.
- Это создает стабильную структуру молекул воды в жидкой воде.
- Водородная связь, образованная в воде, является слабой, и ее прочность составляет одну двадцатую от силы ковалентной связи ОН.
- Срок службы этих связей также очень короткий, и они непрерывно разрываются и образуются в течение коротких периодов времени. Таким образом, в жидкой воде поддерживается динамическое равновесие.
- Точно так же все молекулы воды в жидкой воде имеют по крайней мере одну водородную связь с соседней молекулой воды, при этом свободные молекулы воды практически отсутствуют.
Характеристики / Свойства воды
Физические свойства воды
- Чистая вода — это прозрачная бесцветная жидкость без запаха, которая легко улавливает аромат любого растворенного в ней вещества.
- Температура замерзания, температура кипения, энтальпия плавления и энтальпия испарения воды выше по сравнению с гидридами других членов той же группы из-за межмолекулярных водородных связей между молекулами.
- Вода имеет высокий дипольный момент, что делает ее идеальной средой для растворения самых разных соединений.
- Высокая удельная теплоемкость воды позволяет ей поглощать тепло различных биохимических и физиологических реакций, происходящих внутри тела, с минимальным повышением температуры.
- Вода плохо проводит тепло и электричество, но добавление небольшого количества кислоты или щелочи делает ее электропроводящей.
Вода как растворитель
- Воду также называют универсальным растворителем из-за ее способности растворять самые разные вещества.
- Эта способность обусловлена интенсивной водородной связью и полярностью молекул воды.
- Полярность воды заставляет воду вести себя по-разному с полярными и неполярными соединениями.
- Полярные молекулы воды могут образовывать слабые электростатические взаимодействия с другими полярными молекулами и ионами.
- Таким образом, полярные молекулы и ионы взаимодействуют с частично положительными и частично отрицательными концами воды, причем положительные заряды притягивают отрицательные заряды.
- Когда количество молекул воды в растворе больше, чем молекул растворенного вещества, взаимодействия приводят к образованию трехмерной водной сферы, называемой гидратной оболочкой, вокруг молекул растворенного вещества.
- Формирование гидратной оболочки обеспечивает равномерное диспергирование молекул растворенного вещества по всему раствору.
- Однако неполярные молекулы не взаимодействуют с водой и не образуют гидратных оболочек из-за отсутствия заряженных взаимодействий.
Высокая удельная теплоемкость
- Благодаря интенсивной водородной связи вода имеет очень высокую удельную теплоемкость и высокую теплоту испарения.
- Эти свойства позволяют воде смягчать климат и температуру Земли, смягчая большие колебания температуры.
- Аналогичный процесс происходит в организме, где вода предотвращает быстрое повышение температуры тела в результате различных биохимических реакций.
- Скрытая теплота плавления и испарения воды также высока, что предотвращает таяние ледников и дрейфующих льдов.
Аномальное расширение воды
- Аномальное расширение воды — это ненормальное свойство воды, когда вода расширяется, а не сжимается, когда температура повышается с 4 ° C до 0 ° C.
- Таким образом, плотность воды максимальна при 4 ° C и уменьшается с понижением температуры.
- Это свойство воды является следствием того, что молекулы воды в замерзающем состоянии удерживаются вместе притяжением HO, а не притяжением OO.
- Но поскольку взаимодействие HO не такое сильное, как взаимодействие OO, при замерзании наблюдается небольшое расширение воды.
Биологические функции воды
Некоторые биологические функции воды перечислены ниже:
- Вода — это жизненно важная жидкость организма, которая необходима для регулирования таких процессов, как пищеварение, транспортировка питательных веществ и экскреция. Вода растворяет ионные и полярные органические соединения и позволяет транспортировать продукты пищеварения к нужным местам в организме.
- Вода регулирует температуру тела за счет потоотделения и испарения.
- Вода является средой для всех метаболических реакций в организме, поскольку все метаболические реакции в организме происходят в фазе растворения.
- Вода также обеспечивает среду обитания для различных животных в виде прудов, рек, морей и т. д.
- Вода необходима для прорастания семян и процесса фотосинтеза, с помощью которого растения готовят себе пищу.
- Вода — это среда для переноса минералов из почвы в различные части растений.
- Вода помогает поддерживать структуру растений, обеспечивая соответствующее давление на ткани растения.
- Вода также способствует образованию различных биологических мембран, взаимодействуя с различными органическими соединениями.
- Вода также влияет на основные компоненты всех клеток, такие как ДНК и белки, где водородные связи регулируют сворачивание белков и нуклеиновых кислот.
- Структура двойной спирали ДНК также поддерживается молекулами воды, которые упорядоченно окружают ДНК.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Структура, свойства и биологические функции воды



Жизнь на планете Земля зародилась в водной среде. Ни один организм не может обходиться без воды. Несмотря на простоту химического состава и строения, вода является одним из удивительных соединений, обладает уникальными физико-химическими свойствами и биологическими функциями.
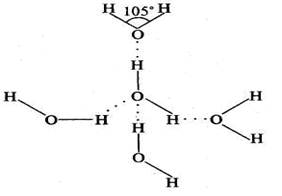
Молекула воды (Н2О) — полярное соединение, в котором электрофильный атом кислорода притягивает спаренные электроны от атомов водорода, приобретая частичный отрицательный заряд, в то время как атомы водорода приобретают частично положительные заряды. Важной особенностью воды является способность ее молекул объединяться в структурные агрегаты за счет образования водородных связей между разноименно заряженными атомами. Образующие ассоциаты (рис. 1) состоят из нескольких молекул воды, поэтому формулу воды правильнее было бы записать как (Н2О)л, где п = 2, 3, 4, 5. Водородные связи имеют исключительно важное значение при формировании структур биополимеров, надмолекулярных комплексов, в метаболизме.
Дж. Пиментел и О. Мак-Клеллан считают, что в химии живых систем водородная связь так же важна, как и связь углерод—углерод. Что же такое водородная связь?
Рис. 1. Ассоциат молекул воды (точками обозначены водородные связи)
Водородная связь — это взаимодействие атома водорода с более электроотрицательным атомом, имеющее частично донорно-акцепторный, частично электростатический характер. Любая химическая связь характеризуется энергией ее образования. По энергии водородная связь занимает промежуточное положение между ковалентной (200—400 кДж/моль) и ионной химическими связями и слабыми ван-дер-ваальсовыми взаимодействиями, находясь в пределах 12—30 кДж/моль.
Необычная структура воды обусловливает ее уникальные физико-химические свойства. Все биохимические процессы в организме протекают в водной среде. Вещества, находящиеся в водном растворе, имеют водную оболочку, которая образуется в результате взаимодействия полярных молекул воды с заряженными группами макромолекул или ионов. Чем больше такая оболочка, тем лучше растворимо вещество.
По отношению к воде молекулы или их части делят на гидрофильные (водорастворимые) и гидрофобные (водонерастворимые). Гидрофильными являются все органические и неорганические соединения, диссоциирующие на ионы, биологические мономеры и биополимеры, имеющие полярные группы. К гидрофобным следует отнести соединения, молекулы которых содержат неполярные группы или цепи (триацилглицерины, стероиды и др.). Молекулы некоторых соединений содержат как гидрофильные, так и гидрофобные группы; такие соединения называются амфифильными (от греч. amphy — двоякий). К ним относятся жирные кислоты, фосфолипиды и др. Из вышесказанного следует, что диполи воды способны взаимодействовать не только между собой, но ft с полярными молекулами органических и неорганических веществ, локализованных в клетке организма. Этот процесс получил название гидратации веществ.
Физико-химические свойства воды определяют ее биологические функции:
• Вода является прекрасным растворителем.
• Вода выполняет функцию регулятора теплового баланса организма, так как ее теплоемкость значительно превышает теплоемкость любого биологического вещества. Поэтому вода может долго сохранять тепло при изменении температуры окружающей среды и переносить его на расстояние.
• Вода способствует сохранению внутриклеточного давления и формы клеток (тургор).
• В определенных биохимических процессах вода выступает в качестве субстрата.
Содержание воды в организме человеказависит от возраста: чем моложе человек, тем выше содержание воды. У новорожденных вода составляет 75% от массы тела, у детей от 1 года до 10 лет — 60—65%, а у людей старше 50 лет — 50—55%. Внутри клеток содержится 2/3 общего количества воды, внеклеточная вода составляет 1/3. Необходимое содержание воды в организме человека поддерживается за счет поступления ее извне (примерно 2 л в сутки); около 0,3 л в сутки образуется в процессе распада веществ внутри организма. Нарушение водного баланса в клетках организма приводит к тяжелым последствиям вплоть до гибели клеток. Функции клеток зависят от общего количества внутриклеточной и внеклеточной воды, от водного окружения макромолекул и субклеточных структур. Резкое изменение содержания воды в организме приводит к патологии.
Источник