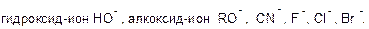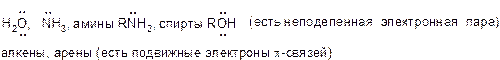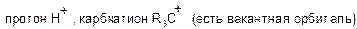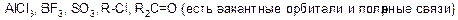- Нуклеофилы и электрофилы
- Нуклеофил
- Содержание
- Примеры
- Классификация
- По типу реагирующей орбитали
- По атому, образующему связь
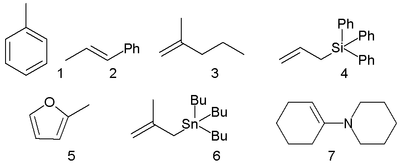
- Углеродные нуклеофилы
- Азотные нуклеофилы
- Кислородные нуклеофилы
- Серные нуклеофилы
- Шкалы нуклеофильности
- Уравнение Свена-Скотта
- Уравнение Ричи
- Уравнение Майра-Патца
- Объединенное уравнение
- См. также
- Примечания
- Полезное
- Смотреть что такое «Нуклеофил» в других словарях:
Нуклеофилы и электрофилы



Понятие кислоты и основания очень близко к понятиям электрофил и нуклеофил, которые широко используются в органической химии для обозначения характера реагирующих частиц.
Нуклеофил – это частица с электронодонорными свойствами, способная образовать связь со своим партнером в реакции (электрофилом), отдавая неподеленую электронную пару или пару связи. Нуклеофилы являются основаниями Льюса.
а) отрицательно заряженные:
Электрофил – это частица с электроноакцепторными свойствами, которая образует связь со своим партнером в реакции (нуклеофилом). У электрофила должна быть вакантная орбиталь или сильнополярная связь. Электрофилы являются кислотами Льюса.
а) положительно заряженные:
Для того чтобы прошла гетеролитическая реакция, нужны два реагента – нуклеофильный (донор электронов) и электрофильный (акцептор электронов).
Источник
Нуклеофил
Нуклеофил в химии (лат. nucleus «ядро», др.-греч. φιλέω «любить») — реагент, образующий химическую связь с партнером по реакции (электрофилом) по донорно-акцепторному механизму, предоставляя электронную пару, образующую новую связь [1] . Вследствие того, что нуклеофилы отдают электроны, они по определению являются основаниями Льюиса. В роли нуклеофилов теоретически могут выступать все ионы и нейтральные молекулы с неподеленной электронной парой.
Нуклеофил — электроноизбыточный химический реагент, способный взаимодействовать с электронодефицитными соединениями (электрофилами). Примерами нуклеофилов являются анионы (Cl − , Br − , I − ) и соединения с неподелённой электронной парой (NH3, H2O).
В ходе реакций замещения или присоединения нуклеофил атакует по месту полного или частичного положительного заряда на электрофиле. Название «нуклеофил» означает «любящий ядро» и отображает эту способность (атомное ядро заряжено положительно). Относительная реакционная способность нуклеофилов называется нуклеофильность. В пределах одного ряда периодической системы более сильные основания (с бóльшим значением pKa сопряженной кислоты) являются лучшими нуклеофилами. В пределах одной группы на нуклеофильность большее влияние оказывает поляризуемость — лёгкость, с которой деформируется электронное облако атома или молекулы. К примеру, в водных растворах иодид-ион I − более нуклеофилен, чем фторид F − [2] .
Амбидентные нуклеофилы имеют два и более реакционных центра. К примеру, тиоцианат-ион SCN − может атаковать электрофил либо атомом серы, либо атомом азота. Реакции галогеноалканов с SCN − часто приводят к образованию смеси RSCN (алкилтиоцианата) и RNCS (алкилизотиоцианата).
Термины «нуклеофил» и «электрофил» были введены в 1929 Кристофером Ингольдом [3] , заменив предложенные ранее (в 1925) Лэпворсом «катионоид» и «анионоид» [4] .
Содержание
Примеры
В показанном ниже примере бимолекулярного нуклеофильного замещения (SN2) атом кислорода гидроксид-иона донирует пару электронов на связывание с атомом углерода в молекуле бромэтана. Связь между атомами углерода и брома разрывается по гетеролитическому механизму: бром принимает оба электрона этой связи и уходит в виде иона Br − . В данной реакции OH − является нуклеофилом, а CH3CH2Br — электрофилом.
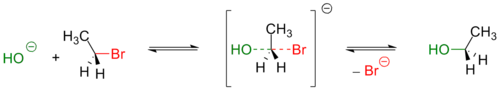
В данной реакции атака нуклеофила происходит со стороны, противоположной уходящей группе. Вследствие этого SN2-процессы сопровождаются обращением (инверсией) конфигурации.
Классификация
Нуклеофилы можно классифицировать несколькими способами: по типу орбитали, с которой донируются электроны, и по природе атома, который образует связь.
По типу реагирующей орбитали
В зависимости от природы орбитали, на которой располагались электроны, пошедшие на образование связи с электрофилом, можно выделить:
- π-нуклеофилы (электроны ушли с π-орбитали):
- алкены, диены, алкины;
- аллилсиланы, аллилгерманы, аллилстаннаны;
- алкил- и силиленоловые эфиры;
- ароматические соединения;
- n-нуклеофилы (электроны находились на несвязывающей орбитали — неподелённой электронной паре):
- амины;
- фосфины;
- фосфиты;
- анионы;
- σ-нуклеофилы (электроны ушли с σ-орбитали):
- доноры гидрид-иона H − .
По атому, образующему связь
Углеродные нуклеофилы
Нуклеофилами с реакционным центром на атоме углерода являются:
- алкил- и арилметаллогалиды (например, CH3MgBr, PhMgCl и т. д.) в реакциях Гриньяра, Реформатского, Барбье и др.
- органолитиевые реагенты (PhLi) и анионы терминальных алкинов (HC≡C − Li + );
- енолы и еноляты (RCH=CH−OH и RCH=CH−O − ) являются амбидентными нуклеофилами и могут реагировать как по атому углерода в α-положении, так и по атому кислорода. Обычно преобладают реакции по атому углерода (при этом енолят-ионы активнее енолов [2] ). Енолы и еноляты часто применяются в реакциях конденсации, например, в альдольной реакции или конденсации Кляйзена.
- другие частицы с полным или частичным отрицательным зарядом на атоме углерода (например, − CH2−NO2).
Азотные нуклеофилы
Примерами азотных нуклеофилов являются аммиак (NH3), органические амины (RNH2, R2NH, R3N) и азиды (R−N3).
Кислородные нуклеофилы
Типичными кислородными нуклеофилами являются вода (H2O), гидроксид-ион (OH − ), спирты (ROH) и алкоксиды (RO − ). В показанной ниже разновидности реакции Вильямсона сильное основание депротонирует спирт с образованием алкоксида. Атом кислорода затем внутримолекулярно замещает уходящую группу, приводя к образованию эпоксида − трёхчленного гетероцикла с одним атомом кислорода:
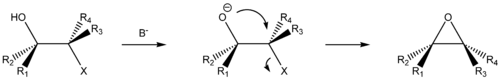
Серные нуклеофилы
Серосодержащие соединения обычно являются хорошими нуклеофилами, так как атом серы легко поляризуется, что облегчает передачу электронной пары. Типичные нуклеофилы этого класса — тиолы (RSH) и тиоляты (RS − ).
Шкалы нуклеофильности
Известно несколько способов количественного описания реакционной способности нуклеофилов. Приведенные ниже методы основаны на изучении экспериментальных данных о скорости определенных реакций с участием большого количества нуклеофилов и электрофилов. Как правило, реагенты с выраженным альфа-эффектом не включаются в эти корреляции.
Уравнение Свена-Скотта
Уравнение Свена-Скотта было выведено в 1953 году и является первой попыткой количественно описать реакционную способность нуклеофилов в реакциях SN2 [5] [6] :
В этом уравнении k — константа скорости реакции стандартного субстрата с данным нуклеофилом, k0 — константа скорости реакции субстрата со стандартным нуклеофилом (водой), S — параметр чувствительности субстрата к изменению нуклеофила (для CH3Br или CH3I S принимается равным 1), n — параметр нуклеофильности (для воды n = 0, табл. 1, 2).
Таким образом, для реакций
уравнение Свена-Скотта можно записать как

| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| SO3 2− | 5,16 | CN − | 5,10 | I − | 5,04 |
| SCN − | 4,77 | HO − | 4,20 | N3 − | 4,00 |
| Br − | 3,89 | HCO3 − | 3,80 | Cl − | 3,04 |
| CH3COO − | 2,72 | SO4 2− | 2,50 | F − | 2,00 |
| NO3 − | 1,03 | CH3OH | 0,70 | H2O | 0,00 |
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| F − | 2,7 | Cl − | 4,37 | Br − | 5,79 |
| I − | 7,42 | N3 − | 5,78 | NC − | 6,70 |
| CH3OH | H2O | 0,00 | CH3CO2 − | 4,3 | |
| PhO − | 5,75 | CH3O − | 6,29 | Пиридин | 5,23 |
| Анилин | 5,70 | Триэтиламин | 6,66 | PhSH | 5,7 |
Уравнение Ричи
Уравнение Ричи было выведено в 1972 году [9] и выражается следующим образом [10] :

где 


| Нуклеофил (растворитель) | Значение N + | Нуклеофил (растворитель) | Значение N + |
|---|---|---|---|
| H2O (H2O) | 0,0 | MeOH (MeOH) | 0,5 |
| CN − (H2O) | 3,8 | CN − (MeOH) | 5,9 |
| HO − (H2O) | 4,5 | MeO − (MeOH) | 7,5 |
| N3 − (H2O) | 5,4 | N3 − (MeOH) | 8,5 |
| PhS − (ДМСО) | 13,1 | PhS − (MeOH) | 10,7 |
Важной особенностью уравнения Ричи является отсутствие параметра чувствительности субстрата (σ в уравнении Свена-Скотта). Таким образом, принимается, что относительная реакционная способность двух нуклеофилов определяется только значением N + и не зависит от партнера по реакции. Это находится в резком противоречии с т. н. принципом взаимозависимости реакционной способности и селективности [11] . Из-за этого уравнение Ричи иногда называется «соотношение постоянной селективности» [12] . Явная упрощенность вызвала ряд публикаций о пределах его применимости [12] [13] .
Уравнение Майра-Патца
В 1994 г. Г. Майр и М. Патц, на основании исследования реакционной способности диарилметильных катионов и других соединений, предложили уравнение, описывающее реакционную способность достаточно большого количества нуклеофилов и электрофилов [14] :
В этом уравнении константа скорости реакции второго порядка k, измеренная при 20 °C, связывается с параметром электрофильности E (для бис(п-метоксифенил)метильного катиона E = 0), параметром нуклеофильности N и фактором чувствительности s (для реакций 2-метил-1-пентена s = 1). Для реакций незаряженных нуклеофилов константа скорости слабо зависит от растворителя и последний обычно не указывается.
Диарилметильные катионы были выбраны в качестве стандартных электрофилов потому, что их активностью можно управлять подбором заместителя R в пара-положении. Таким образом, оказалось возможным измерить реакционную способность очень разных нуклеофилов. Для протестированных соединений параметр N изменяется в диапазоне от −4,47 до 28,95 (Табл. 4) [15] .
| Нуклеофил | N (s) | Нуклеофил | N (s) |
|---|---|---|---|
| 1 | −4,47 (1,32) | 2 | −0,41 (1,12) |
| 3 | +0,96 (1) | 4 | −0,13 (1,21) |
| 5 | +3,61 (1,11) | 6 | +7,48 (0,89) |
| 7 | +13,36 (0,81) | PhC − (CN)CH3 [16] | 28,95 (0,58) |
Параметр элекрофильности E для некоторых карбокатионов можно грубо оценить по следующему уравнению [14] :

где kw — константа псевдопервого порядка для реакции карбокатиона с водой при 20 °C.
Нуклеофильность N в уравнении Майра-Патца связана с параметром Ричи N+ следующим соотношением:
Объединенное уравнение
В попытке объединить все вышеописанные уравнения Майр с сотрудниками предложили следующее выражение [17] :

где sE — параметр чувствительности электрофила; sN — параметр чувствительности электрофила; N и E имеют такое же значение, как и в уравнении Майра-Патца.
С помощью соответствующих подстановок данное выражение можно превратить в любое описанное ранее уравнение:
- при sE = 1 (для карбокатионов) это уравнение эквивалентно оригинальному уравнению Майра-Патца;
- при sN = 0.6 (для большинства n-нуклеофилов):


- при sE = 1 и sN = 0.6 получим:

См. также
Примечания
- ↑ Определение, данное ИЮПАК.pdf
- ↑ 12Кери Ф., Сандберг Р. Углубленный курс органической химии: Пер. с англ. = Advanced Organic Chemistry / Под ред. В. М. Потапова. — М .: Химия, 1981. — Т. 1. Структура и механизмы. — 520 с.
- ↑Ingold, C. K. // Recl. Trav. Chim. Pays-Bas. — 1929.
- ↑Lapworth, A. // Nature. — 1925. — Vol. 115. — P. 625.
- ↑C. Gardner Swain, Carleton B. Scott.Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides (англ.) // J. Am. Chem. Soc.. — 1953. — Vol. 75. — P. 141-147.
- ↑Swain–Scott equation (англ.) . IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (7 September 2009). Архивировано из первоисточника 7 мая 2012.Проверено 22 августа 2010.
- ↑ Химическая энциклопедия./ Нуклеофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 3.
- ↑R. G. Pearson, H. Sobel, J. Songstad.Nucleophilic reactivity constants toward methyl iodide and trans-[Pt(py)2Cl2] (англ.) // J. Am. Chem. Soc.. — 1968. — Vol. 90. — P. 319-326.
- ↑ 12C. D. Ritchie.Nucleophilic reactivities toward cations (англ.) // Acc. Chem. Res. — 1972. — Vol. 5. — P. 348−354. — DOI:10.1021/ar50058a005
- ↑Ritchie equation (англ.) . Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). IUPAC. doi:10.1351/goldbook.R05402. Архивировано из первоисточника 7 мая 2012.Проверено 22 августа 2010.
- ↑ «Чем более активен реагент, тем он менее селективен.»
- ↑ 12S. Minegishi, H. Mayr.How Constant Are Ritchie’s “Constant Selectivity Relationships”? A General Reactivity Scale for n-, π-, and σ-Nucleophiles (англ.) // J. Am. Chem. Soc.. — 2003. — Vol. 125. — P. 286−295. — DOI:10.1021/ja021010y
- ↑P. Denton, C. D. Johnson.Selectivity and the Ritchie equation (англ.) // J. Chem. Soc., Perkin Trans. 2. — 1995. — P. 477 — 481. — DOI:10.1039/P29950000477
- ↑ 12H. Mayr, M. Patz.Scales of Nucleophilicity and Electrophilicity: A System for Ordering Polar Organic and Organometallic Reactions (англ.) // Angew. Chem. Int. Ed. Engl. — 1994. — Vol. 33. — P. 938−957. — DOI:10.1002/anie.199409381
- ↑ 12H. Mayr et al.Mayr’s Database of Reactivity Parameters (англ.) . Архивировано из первоисточника 7 мая 2012.Проверено 2 сентября 2010.
- ↑ В ДМСО.
- ↑T. B. Phan, M. Breugst, H. Mayr.Towards a General Scale of Nucleophilicity? (англ.) // Angew. Chem. Int. Ed. — 2006. — Vol. 45. — P. 3869–3874. — DOI:10.1002/anie.200600542
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Нуклеофил» в других словарях:
нуклеофил — nukleofilas statusas T sritis chemija apibrėžtis Dalelė, turinti laisvą elektronų porą ar didesnį elektronų tankį. atitikmenys: angl. nucleophile rus. нуклеофил … Chemijos terminų aiškinamasis žodynas
Значение параметра нуклеофильности n для некоторых реагентов (вода, 25°С) — Нуклеофил Х: n S2O32 6,38 SO32 5,16 CN 5,10 … Химический справочник
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
ТЕЛЕ-ЗАМЕЩЕНИЕ — замещение (обычно нуклеоф.) в аро матич. или гетероароматич. ряду, при к ром входящая группа вступает в положение, находящееся через один или более атомов от уходящей группы; обозначается … Химическая энциклопедия
НИТРОСОЕДИНEНИЯ — (С нитросоединения), содержат в молекуле одну или неск. нитрогрупп, непосредственно связанных с атомом углерода. Известны также N и О нитро соединения (см. Нитрамины и Нитраты органические). Нитрогруппа имеет строение, промежуточное между двумя… … Химическая энциклопедия
НУКЛЕОФИЛЬНЫЕ РЕАКЦИИ — гетеролитич. р ции орг. соед. с нуклеоф. реагентами (нуклеофилами, от лат. nucleus ядро и греч. phileo люблю). К н у к л е о ф и л а м относят анионы и молекулы (орг. и неорг.), к рые при участии в р ции отдают свою пару электронов на образование … Химическая энциклопедия
Аммиак — Общие Химическая формул … Википедия
Реакции присоединения — (англ. addition reaction) в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может… … Википедия
БЕНЗОПИРИЛИЯ СОЛИ — (соли хромилия), содержат в молекуле катион бензопирилия структуры I или II. Хим. св ва этих структур различны вследствие фенольного характера кислорода в I и кетонного во II Соед. I не обменивает атом кислорода на др. гетеро атомы и не превращ.… … Химическая энциклопедия
ВАГНЕРА-МЕЕРВЕЙНА ПЕРЕГРУППИРОВКИ — общее назв. р ций, протекающих с 1,2 миграцией группы R(H, алкил или алициклич. фрагмент, арил, ацил, алкоксикарбонил и др.) к карбкатионному центру, возникающему в молекуле при нуклеоф. замещении, присоединении к кратной связи или элиминировании … Химическая энциклопедия
Источник