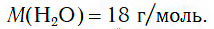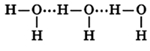- Урок 27. Состав и физические свойства воды
- Состав и строение воды
- Физические свойства воды
- Вода как растворитель
- Вода (H2O)
- Физические свойства воды
- Строение молекулы воды
- Химические свойства воды
- Растворимость веществ в воде
- Лекция. Химические и физические свойства природных вод
- Оглавление
- 1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
- 2. 2. ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ВОД
- 3. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
Урок 27. Состав и физические свойства воды
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Состав и строение воды
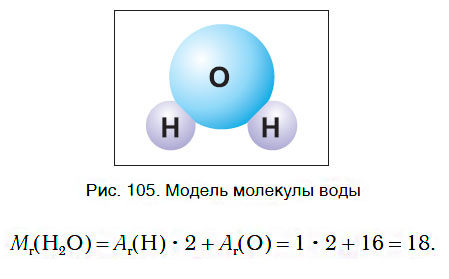
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
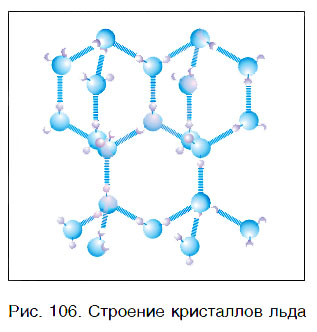
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см 3 , а плотность жидкой воды — примерно 1,00 г/см 3 . Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Вода (H2O)
Оксид водорода (H2O), гораздо более известный всем нам под названием «вода», без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом — в виде льда, в жикдом, собственно вода, в газообразном — в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. — это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см 3 ;
- вода — хороший растворитель.
Строение молекулы воды
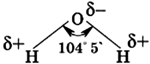
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода — положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры — чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии — образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода «охотно» вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
- с основными оксидами при н.у. вода реагирует с образованием оснований:
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества — в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества — в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества — в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды — такой «слоеный пирог» называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Лекция. Химические и физические свойства природных вод
| Сайт: | Дистанционное образование Казанского федерального университета |
| Курс: | Гидрология |
| Книга: | Лекция. Химические и физические свойства природных вод |
| Напечатано:: | Гость |
| Дата: | Четверг, 21 октября 2021, 14:27 |
Оглавление
1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
Вода — это простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом. По своей химической природе—это оксид (окись) водорода Н2О. В чистом виде вода — вещество бесцветное, не имеющее ни вкуса, ни запаха.
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине.
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд.
Оба атома водорода , лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды— величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т. е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде.
При повышении температуры наряду с упомянутым уплотнением «упаковки» молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения воды, при температуре выше 4°С — тепловое расширение , поэтому вода обладает «аномальным» свойством — наибольшей плотностью не при температуре плавления, а при 4°С.
Водород и кислород имеют несколько природных изотопов:
1 Н — «обычный» водород),
2 Н — «тяжелый» водород, или дейтерий),
3 Н — радиоактивный «сверхтяжелый» водород, или тритий).
16 О, 17 О, 18 О. Поэтому и сама вода имеет переменный изотопный состав.
Природная вода — это смесь вод разного изотопногосостава.
Наиболее распространена вода, состоящая из изотопов 1 Н и 16 О – «обычная» вода, доля других изотопных видов воды ничтожна — менее 0,27 %. Приведенные в дальнейшем сведения относятся только к «обычной» воде.
Одна из главных причин, приводящих к различию изотопного состава природных вод,— процесс испарения.
В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, а в результате конденсации — более легкими.
Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат «тяжелого» водорода ( 3 Н) и «тяжелого» кислорода ( 18 О) меньше, чем океанические воды.
Воду с изотопным составом ‘Н2 16 О называют «обычной» водой и обозначают просто Н2О, остальные виды воды (кроме 3 Н2О) называют «тяжелой» водой. Иногда «тяжелой» водой считают лишь дейтериевую воду 2 Н2О (или О2О). Вода с изотопным составом 3 Н2О (или Т2О) — так называемая «сверхтяжелая» вода. Ее на Земле находится всего 13—20 кг.
2. 2. ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ВОД
Вода — слабый электролит, диссоциирующий по уравнению:
Уравнение характеризует так называемое ионное равновесие воды. Состояние ионного равновесия природных вод отражает водородный показатель рН.
Благодаря особенностям молекулярного строения вода обладает свойством хорошо растворять различные химические вещества. Природная вода представляет собой слабый раствор.
В воде хорошо растворяются: соли, газы, биогенные вещества, микроэлементы.
Суммарное содержание в воде растворенных неорганических веществ (концентрация солей) выражают в виде минерализации М(мг\л, г\л), либо в относительных единицах (%, ‰).
Содержание растворенных в воде веществ в г/кг или в промилле (%о) называется соленостью воды
По содержанию солей (минерализации или солености) природные воды подразделяют на четыре группы:
Минерализация природных вод разного типа может изменяться в довольно широких пределах: от 0,01 г/л в атмосферных осадках до 600 г/л в рассолах.
К числу главных ионов солей, находящихся в природных водах, относятся: 1. Отрицательно заряженные ионы (анионы):
2. Положительно заряженные ионы (катионы) :
кальция Са 2+ , магния Ме 2+ , натрия Ка + и калия К + .
Все природные воды делятся по преобладающему аниону на три класса: гидрокарбонатный, сульфатный и хлоридный;
по преобладающему катиону на три группы: кальциевую, магниевую, натриевую.
Природные воды различного происхождения обычно имеют и различный солевой состав и относятся соответственно к разным классам и группам.
Речные воды , как правило, относятся к гидрокарбонатному классу и кальциевой группе.
Подземные воды нередко относятся к сульфатному классу и магниевой группе.
Воды океанов и морей принадлежат к хлоридному классу и натриевой группе.
Сумма концентрации наиболее распространенных двухвалентных катионов Са 2+ и Мg 2+ называется общей жесткостью воды.
Повышенная жесткость обусловлена растворением в воде горных пород, содержащих карбонаты и сульфаты кальция и магния.
Наиболее распространенные газы, растворенные в природных водах,— это кислород О2, азот N3, диоксид углерода С02, сероводород Н2S.
Газы хорошо растворяются в воде, если способны вступать с ней в химические связи. К таким газам относятся: аммиак NН3, сероводород Н2S, сернистый газ SО2, диоксид (двуокись) углерода, или углекислый газ СО2, и др.).
Прочие газы мало растворимы в воде.
При понижении давления, повышении температуры и увеличении солености растворимость газов в воде уменьшается.
Источниками поступления газов в воду служат:
— жизнедеятельность растений (О2),
— разложение органического вещества (СО2, СН4э Н25).
На практике нередко пользуются относительной характеристикой содержания в воде растворенных газов — процентом насыщения (А) — отношение фактического содержания газа (Ф) к равновесной концентрации (Р) в воде при данной температуре.
где Ф — фактическое содержание газа,
Р — его равновесная концентрация в воде при данной температуре.
Если фактическое содержание газа в поверхностном слое воды больше равновесной концентрации и величина А >100 %, то происходит выделение газа в атмосферу.
Если вода не насыщена газом и А радиоактивные вещества естественного (калий 40 К, рубидий 87 Rb, уран 258 U), радий 226 Rа и др.) и антропогенного (стронций 90 Sr, цезий 137 Сsи др.) или смешанного происхождения.
Таким образом, содержащиеся в растворенном состоянии в воде ионы солей, газы, биогенные и органические вещества, микроэлементы различаются как по концентрации, так и по роли в физических, химических и биологических процессах в водной среде.
Особую категорию содержащихся в воде соединений составляют так называемые загрязняющие вещества (3В), оказывающие вредное воздействие на живую природу и жизнедеятельность человека.
Это прежде всего нефтепродукты, ядохимикаты (пестициды, гербициды), удобрения, моющие средства (детергенты), некоторые микроэлементы (очень токсичны тяжелые металлы — ртуть, свинеци кадмий), радиоактивные вещества.
Большая часть загрязняющих веществ имеет антропогенное происхождение, хотя существуют и естественные источники загрязнения природных вод.
Особенности химического (и биологического) состава природных вод вместе с некоторыми их физическими свойствами, о которых речь пойдет ниже, часто объединяются в понятие «качество воды», при этом обычно имеют в виду пригодность вод для какого-либо использования.
Поэтому качество воды — характеристика состава и свойств воды, определяющая пригодность ее для конкретного водопользования.
3. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
Агрегатные состояния воды и фазовые переходы
Вода может находиться в трех агрегатных состояниях, или фазах,—
жидком (собственно вода),
газообразном (водяной пар).
Очень важно, что при реально существующих на Земле диапазонах атмосферного давления и температуры вода может находиться одновременно в разных агрегатных состояниях. В этом отношении вода существенно отличается от других физических веществ, находящихся в естественных условиях преимущественно либо в твердом (минералы, металлы), либо в газообразном (О2, Н2, СО2 и т. д.) состоянии.
Изменения агрегатного состояния вещества называют фазовыми переходами. В этих случаях свойства вещества (например, плотность) скачкообразно изменяются. Фазовые переходы сопровождаются выделением или поглощением энергии, называемой теплотой фазового перехода («скрытой теплотой»).
При давлении 610 Па и температуре 0,01 °С вода одновременно находится во всех трех агрегатных состояниях.
При нормальном атмосферном давлении (1,013 10 5 Па= 1,013 бар = 1 атм = 760 мм рт. ст.)
t замерзания воды (плавления льда) = 0 0 С
tкипения (конденсации) = 100 °С.
Температура замерзания и температура кипения воды зависят от давления.
1 амт=670 мм – от 0 до 0,01 0 С
2200 атм — -22 0 С
Последнее означает, что лед в нижней части толщи ледника, находящийся под давлением, может таять даже при небольшой отрицательной температуре.
При дальнейшем увеличении давления — быстро возрастает.
На максимальных глубинах в океане (около11 км) давление превышает 10 8 Па (увеличение глубины на каждые 10 м увеличивает давление приблизительно на 10 Па). При таком давлении температура замерзания пресной воды была бы около -12 °С.
На снижение температуры замерзания воды оказывает влияние ее соленость Увеличение солености на каждые 10 ‰при атмосферном давлении снижаетприблизительно на 0,54°С.
Температура кипения с уменьшением давления снижается, поэтому на больших высотах в горах вода кипит при температуре ниже, чем 100 °С.
При росте давления tкип. возрастает до так называемой «критической точки»
при Р = 2.2 10 -7 Па tкип. = 374 0 С
вода одновременно имеет свойства и жидкости и газа
Плотность — главнейшая физическая характеристика любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу его объема:
Плотность воды, как и других веществ, зависит, прежде всего, от температуры и давления (а для природных вод — еще и от содержания растворенных и тонкодисперсных взвешенных веществ) и скачкообразно изменяется при фазовых переходах.
При повышении температуры плотность воды, как и любого другого вещества, в большей части диапазона изменения температуры уменьшается (т.к. увеличивается расстояния между молекулами при росте температуры). Эта закономерность нарушается лишь при плавлении льда и при нагревании воды в диапазоне от 0 до 4°С (точнее 3,98 °С). Здесь отмечаются еще две очень важные «аномалии» воды:
1) плотность воды в твердом состоянии (лед) меньше, чем в жидком (вода), чего нет у подавляющего большинства других веществ,
2) в диапазоне температуры воды от 0 до 4 °С плотность воды с повышением температуры не уменьшается, а увеличивается .
Эти две «аномалии» воды имеют огромное гидрологическое значение: лед легче воды и поэтому «плавает» на ее поверхности; водоемы обычно не промерзают до дна, так как охлажденная до температуры ниже 4 °С пресная вода становится менее плотной и поэтому остается в поверхностном слое.
Плотность воды изменяется также в зависимости от содержания в ней растворенных веществ (солености) и увеличивается с ростом солености.
Увеличение солености на каждые 10 ‰ снижает температуру наибольшей плотности приблизительно на 2 °С.
Соотношения между температурами наибольшей плотности и замерзания влияют на характер процесса охлаждения воды и вертикальной конвекции — перемешивания, обусловленного различиями в плотности. Охлаждение воды в результате теплообмена с воздухом приводит к увеличению плотности воды и, соответственно, к опусканию более плотной воды вниз. На ее место поднимаются более теплые и менее плотные воды. Происходит процесс вертикальной плотностной конвекции.
Таким образом, в пресных или солоноватых водах зимой в придонных горизонтах температура воды оказывается выше, чем на поверхности и всегда выше температуры замерзания.
Это обстоятельство имеет огромное значение для сохранения жизни в водоемах на глубинах. Если бы у воды температуры наибольшей плотности и замерзания совпадали бы, как у всех других жидкостей, то водоемы могли промерзать до дна, что привело бы к неизбежной гибели большинства организмов.
Аномальное изменение плотности воды при изменении температуры влечет за собой такое же «аномальное» изменение объема воды :
— с возрастанием температуры от 0 до 4 °С объем химически чистой воды уменьшается, и лишь при дальнейшем повышении температуры — увеличивается;
— объем льда всегда заметно больше объема той же массы воды (вспомним, как лопаются трубы при замерзании воды).
Некоторое влияние на плотность воды оказывает также давление. Сжимаемость воды очень мала, но она на больших глубинах в океане все же сказывается на плотности воды. На каждые 1000 м глубины плотность вследствие влияния давления столба воды возрастает на 4,5—4,9 кг/м 3 .
Если бы вода была совершенно несжимаемой, уровень Мирового океана стоял бы на 30 м выше, чем в действительности.
Тепловые свойства воды
К важным особенностям изменения агрегатного состояния воды или так называемых фазовых переходов относятся большая затрата теплоты на плавление, испарение, кипение, возгонкуи большое выделение теплоты при обратных переходах.
В сравнении с другими веществами удельная теплота плавления льда и удельная теплота парообразования аномально высоки. Они представляют две очередные «аномалии» воды.
Удельная теплота плавления пресного льда Lпл– количество теплоты, затрачиваемое при превращении единицы массы льда при температуре плавления и нормальном атмосферном давлении в воду = 333 000 Дж/кг.
Столько же теплоты выделяется при замерзании (кристаллизации)
химически чистой воды.
Удельная теплота парообразования (испарения) LИСП — количество теплоты, необходимое для превращения единицы массы воды в пар (в Дж/кг)) зависит от температуры:
При 0 и 100 °С 1ИСП равны соответственно 2,510 6 и 2,26х х 10 6 Дж/кг.
Столько же теплоты выделяется при конденсации водяного пара.
Удельная теплота испарения льда (возгонки) складывается из удельной теплоты плавления и удельной теплоты испарения:
Для нагревания воды вне точек фазовых переходов необходимо затратить большое количество теплоты.
Удельная теплоемкость воды — количество теплоты, необходимое для нагревания единицы массы воды на один градус.
Удельная теплоемкость также аномально высока по сравнению с теплоемкостью других жидкостей и твердых веществ.
Удельная теплоемкость воды при постоянном давлении, при 15 °С
С увеличением содержания в воде солей удельная теплоемкость воды слабо уменьшается. Поэтому теплоемкость морской воды немного меньше, чем пресной.
Отмечается также небольшое уменьшение удельной теплоемкости воды с увеличением давления, что также имеет некоторое значение для тепловых процессов в толще океана.
Таким образом, отмеченные аномальные особенности тепловых свойств воды способствуют теплорегуляции процессов на Земле. При меньших значениях tпл, tисп поверхность Земли нагревалась бы и охлаждалась гораздо быстрее, возрос бы и диапазон изменения температуры. В таких условиях вся вода на Земле то замерзала бы, то испарялась, гидросфера имела бы совсем иные свойства, а жизнь в таких условиях вряд ли была бы возможна.
Из других тепловых свойств воды важное значение имеет теплопроводность.
Молекулярная теплопроводность воды очень мала, меньшую молекулярную теплопроводность имеет лишь воздух.
Малая теплопроводность воды способствует ее медленному нагреванию и охлаждению.
Снег предохраняет почву, а лед — водоемы от промерзания.
Передача теплоты в воде рек, озер и морей происходит в основном благодаря турбулентной (при динамическом перемешивании), а не молекулярной теплопроводности.
Некоторые другие физические свойства воды
Молекулярная вязкость воды (внутреннее трение).
Источник