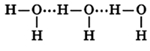- Вода это химические свойства
- Физические свойства воды
- Химические свойства воды
- Вода в жизнедеятельности человека. Водные растворы
- Вода (H2O)
- Физические свойства воды
- Строение молекулы воды
- Химические свойства воды
- Растворимость веществ в воде
- Свойства воды — химические и физические свойства воды в жидком состоянии
- Химические и физические свойства воды в жидком состоянии — термины, определения и комментарии
- Аномальные свойства воды
- Физические свойства воды
- Чистота
- Большая советская энциклопедия
- Запах
- Прозрачность
- Экологический энциклопедический словарь
- Словарь по гидрогеологии и инженерной геологии
- Словарь по гидрогеологии и инженерной геологии
- Температура
- Научно-технический энциклопедический словарь
- Научно-технический энциклопедический словарь
- Тройная точка воды
- Научно-технический энциклопедический словарь
- Поверхностное натяжение воды
- Адгезия и когезия воды
- Капиллярность
- Жесткость воды
- Морской словарь
- Научно-технический энциклопедический словарь
- Структура воды
- Минерализация воды
- Экологический энциклопедический словарь
- Вязкость воды
- Геологический словарь
- Критическая точка воды
- Диэлектрическая проницаемость
- Теплоёмкость воды
- Экологический словарь
- Научно-технический энциклопедический словарь
- Теплопроводность воды
- Текучесть
- Индуктивность
- Плотность воды
- Сжимаемость воды
- Электропроводность воды
- Радиоактивность
- Физико-химические свойства воды
- Словарь по гидрогеологии и инженерной геологии
- Растворимость
- Большой Энциклопедический словарь
- Справочник дорожных терминов
- Общая химия
- Физическая энциклопедия
- Кислотно-щелочное равновесие (pH воды)
- Окислительно-восстановительный потенциал воды
- Химические свойства воды
- Взаимодействие воды с металлами
- Взаимодействие воды с неметаллами
- Взаимодействие воды с электрическим током
- Взаимодействие воды с оксидами неметаллов
- Взаимодействие воды с оксидами металлов
- Гидраты и кристаллогидраты
- Био-синтез
- Выводы
Вода это химические свойства
Ключевые слова конспекта: вода, физические и химические свойства воды, водные растворы.
Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
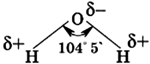
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н2О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь: 
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н2O. С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н2O = 2LiOH + Н2↑,
Са + 2Н2O = Са(ОН)2 + Н2↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н2O = ZnO + Н2↑,
3Fe + 4Н2O = Fe3O4 + 4Н2↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи:
Na2O + Н2O = 2NaOH,
СаО + Н2O = Са(ОН)2.
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты:
СO2 + Н2O = Н2СO3,
SO3 + Н2O = H2SO4.
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К2СO3 + Н2O = КНСО3 + КОН,
РСl3 + ЗН2O = Н3РО3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C2H5OH — реакция этилена С2Н4 с водой:
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са 2+ , Mg 2+ , Fe 2+ . Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО3)2, магния Mg(HCO3)2 и железа Fe(HCO3)2. При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO3)2 = СаСО3↓ + СO2↓ + Н2O,
Fe(HCO3)2 = FeCO3↓ + CO2↓ + Н2O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl2 + Na2CO3 = СаСO3↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Конспект урока по химии «Вода. Свойства воды. Водные растворы». Выберите дальнейшее действие:
Источник
Вода (H2O)
Оксид водорода (H2O), гораздо более известный всем нам под названием «вода», без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом — в виде льда, в жикдом, собственно вода, в газообразном — в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. — это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см 3 ;
- вода — хороший растворитель.
Строение молекулы воды
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода — положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры — чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии — образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода «охотно» вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
- с основными оксидами при н.у. вода реагирует с образованием оснований:
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества — в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества — в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества — в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды — такой «слоеный пирог» называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Свойства воды — химические и физические свойства воды в жидком состоянии
Свойства воды (СВ) должен знать каждый — поскольку они во многом определяют нашу жизнь и нас самих как таковых …
Химические и физические свойства воды в жидком состоянии — термины, определения и комментарии
Строго говоря, в этом материале мы кратко рассмотрим не только химические и физические свойства воды в жидком состоянии, но и свойства присущие ей в общем как таковой.
Более детально про свойства воды в твердом состоянии вы можете прочитать в нашей статье — ЛЁД – ТВЕРДОЕ СОСТОЯНИЕ ВОДЫ → .
Вода — сверх-значимое вещество для нашей планеты. Без нее на Земле жизнь невозможна, без нее не проходит ни один геологический процесс. Великий ученый и мыслитель Владимир Иванович Вернадский в своих работах писал, что не существует такого компонента, значение которого могло бы «сравниться с ней по влиянию на ход основных, самых грозных геологических процессов». Вода присутствует не только в организме всех живых существ нашей планеты, но и во всех веществах на Земле – в минералах, в горных породах … Изучение уникальных свойств воды постоянно открывает нам все новые и новые тайны, задает нам новые загадки и бросает новые вызовы.
Аномальные свойства воды
Многие физические и химические свойства воды удивляют и выпадают из общих правил и закономерностей и являются аномальными, так например:
- В соответствии с закономерностями, установленными по принципу подобия, в рамках таких наук как химия и физика, мы могли бы ожидать, что:
- вода будет закипать при минус 70°С, а замерзать при минус 90°С;
- вода будет не капать с кончика крана, а литься тонкой струйкой;
- лед будет тонуть, а не плавать на поверхности;
- в стакане вода не растворилось бы более нескольких крупинок сахара.
- Поверхность воды обладает отрицательным электрическим потенциалом;
- При нагревании от 0°C до 4°C (точнее 3,98°C) вода сжимается;
- Вызывает удивление высокая теплоёмкость воды жидком состоянии;
- …
Более подробно с аномальными свойствами Вы можете ознакомиться в нашей статье — АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ, ИЛИ УДИВИТЕЛЬНОЕ РЯДОМ → .
Вода имеет много и других аномалий, исследование которых вероятно принесет, в ближайшем будущем, новые неожиданные открытия.
Необходимо отметить, что вода в естественных природных условиях может существовать в трех агрегатных состояниях, более подробно, с которыми можно ознакомиться в нашей статье — АГРЕГАТНЫЕ СОСТОЯНИЯ ВОДЫ В ПРИРОДЕ → .
Как уже отмечалось выше, в данном материале мы перечислим основные физические и химические свойства воды и сделаем к некоторым из них краткие комментарии.
Физические свойства воды
ФИЗИЧЕСКИЕ СВОЙСТВА – это свойства, которые проявляются вне химических реакций.
Чистота
Чистота воды – зависит от наличия в ней примесей, бактерий, солей тяжелых металлов … , для ознакомления с интерпретацией термина ЧИСТАЯ ВОДА по версии нашего сайта необходимо прочитать статью — ЧИСТАЯ ВОДА → .
Цвет воды – зависит от химического состава и механических примесей
Для примера приведем определение «Цвета моря», данное «Большой советской энциклопедией».
Большая советская энциклопедия
Цвет моря. Цвет, воспринимаемый глазом, когда наблюдатель смотрит на поверхность моря, Цвет моря зависит от цвета морской воды, цвета неба, количества и характера облаков, высоты Солнца над горизонтом и др. причин.
Понятие Цвет моря следует отличать от понятия цвет морской воды. Под цветом морской воды понимают цвет, воспринимаемый глазом при отвесном осмотре морской воды над белым фоном. От поверхности моря отражается лишь незначительная часть падающих на неё световых лучей, остальная их часть проникает вглубь, где поглощается и рассеивается молекулами воды, частицами взвешенных веществ и мельчайшими пузырьками газов. Отражённые и выходящие из моря рассеянные лучи и создают Ц. м. Молекулы воды рассеивают сильнее всего синий и зелёные лучи. Взвешенные частицы почти одинаково рассеивают все лучи. Поэтому морская вода с малым количеством взвесей кажется сине-зелёной (цвет открытых частей океанов), а со значительным количеством взвесей — желтовато-зелёной (например, Балтийское море). Теоретическая сторона учения о Ц. м. разработана В. В. Шулейкиным и Ч. В. Раманом.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978
Запах
Запах воды – чистая вода как правило, не имеет запаха.
Прозрачность
Прозрачность воды — зависит от растворенных в ней минеральных веществ и содержания механических примесей, органических веществ и коллоидов:
Экологический энциклопедический словарь
ПРОЗРАЧНОСТЬ ВОДЫ — способность воды пропускать свет. Обычно измеряется диском Секки. Зависит в основном от концентрации взвешенных и растворенных в воде органических и неорганических веществ. Может резко снижаться в результате антропогенного загрязнения и эвтрофирования водоемов.
Экологический энциклопедический словарь. — Кишинев И.И. Дедю. 1989
Словарь по гидрогеологии и инженерной геологии
ПРОЗРАЧНОСТЬ ВОДЫ — способность воды пропускать световые лучи. Зависит от толщины слоя воды, проходимого лучами, наличия в ней взвешенных примесей, растворенных веществ и т. п. В воде сильнее поглощаются красные и желтые лучи, глубже проникают фиолетовые. По степени прозрачности, в порядке уменьшения ее, различают воды:
- прозрачные;
- слабо опалесцирующие;
- опалесцирующие;
- слегка мутные;
- мутные;
- сильно мутные.
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат. 1961
Вкус воды – зависит от состава растворенных в ней веществ.
Словарь по гидрогеологии и инженерной геологии
Вкус воды — свойство воды, зависящее от растворенных в ней солей и газов. Имеются таблицы ощутимой на вкус концентрации солей, растворенных в воде (в мг/л), например следующая таблица (по Штаффу).
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат. Составитель: А. А. Маккавеев, редактор О. К. Ланге. 1961
Температура
Температура плавления воды:
Научно-технический энциклопедический словарь
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — температура, при которой вещество переходит из ТВЕРДОГО СОСТОЯНИЯ в жидкое. Температура плавления твердого вещества равна температуре замерзания жидкости, например, температура плавления льда, О °С, равна температуре замерзания воды.
Научно-технический энциклопедический словарь.
Температура кипения воды: 99,974°C
Научно-технический энциклопедический словарь
ТЕМПЕРАТУРА КИПЕНИЯ, температура, при которой вещество переходит из одного состояния (фазы) в другое, т. е. из жидкости в пар или газ. Температура кипения возрастает при увеличении внешнего давления и понижается при его уменьшении. Обычно ее измеряют при стандартном давлении в 1 атмосферу (760 мм рт. ст.) Температура кипения воды при стандартном давлении составляет 100 °С.
Научно-технический энциклопедический словарь.
Тройная точка воды
Тройная точка воды: 0,01 °C, 611,73 Па;
Научно-технический энциклопедический словарь
ТРОЙНАЯ ТОЧКА, температура и давление, при которых все три состояния вещества (твердое, жидкое, газообразное) могут существовать одновременно. Для воды тройная точка находится при температуре 273,16 К и давлении 610 Ра.
Научно-технический энциклопедический словарь
Поверхностное натяжение воды
Поверхностное натяжение воды – определяет силу сцепления молекул воды друг с другом, например, от этого параметра зависит то, как усваивается та или иная вода организмом человека.
Адгезия и когезия воды
Адгезия и когезия — это свойства которые определяют «липкость воды» к другим материалам. Адгезия определяет «липкость» воды к другим веществам, а когезия это липкость молекул воды по отношению друг к другу.
Капиллярность
Капиллярность — свойство воды, благодаря которому вода может подниматься вертикально вверх в пористых материалах. Данное свойство реализуется через другие свойства воды, такие как — поверхностное натяжение, адгезия и когезия.
Жесткость воды
Жесткость воды – определяется количеством содержания солей, более подробно читайте в материалах — ЖЕСТКАЯ ВОДА — ЧТО ЖЕ ЭТО ТАКОЕ → и МИНЕРАЛИЗАЦИЯ ВОДЫ → .
Морской словарь
ЖЕСТКОСТЬ ВОДЫ (Stiffness of Water) — свойство воды, обескровливаемое содержанием растворенных в ней солей щелочноземельных металлов, гл. обр. кальция и магния (в виде двууглекислых солей — бикарбонатов), и солей сильных минеральных кислот — серной и соляной. Жёсткость воды измеряется в особых единицах, так наз. градусах жесткости. Градусом жесткости называется весовое содержание окиси кальция (СаО), равное 0,01 г в 1 л воды. Жесткая вода непригодна для питания котлов, так как способствует сильному образованию накипи на их стенках, что может вызвать пережог трубок котла. Котлы больших мощностей и особенно высоких давлений должны питаться совершенно очищенной водой (конденсат от паровых машин и турбин, очищенный посредством фильтров от примеси масла, а также дистиллят, приготовляемый в особых аппаратах-испарителях).
Самойлов К. И. Морской словарь. — М.-Л.: Государственное Военно-морское Издательство НКВМФ Союза ССР, 1941
Научно-технический энциклопедический словарь
ЖЕСТКОСТЬ ВОДЫ, неспособность воды образовывать пену с мылом из-за растворенных в ней солей, в основном кальция и магния.
Накипь в котлах и трубах образуется из-за присутствия в воде растворенного карбоната кальция, попадающего в воду при контакте с известняком. В горячей или кипящей воде карбонат кальция переходит в осадок в виде твердых известковых отложений на поверхностях внутри котлов. Карбонат кальция также не дает мылу пениться. Ионообменный контейнер(3), заполнен гранулами, покрытыми натрий-содержащими материалами. с которыми вода вступает в контакт. Ионы натрия как более активные, замещают ионы кальция Так как соли натрия остаются растворимыми даже при кипячении, накипь не образуется.
Научно-технический энциклопедический словарь.
Структура воды
Под структурой воды понимается определенное расположение молекул воды по отношению друг к другу. Это понятие активно используется в теории структурированной воды, читайте нашу статью — СТРУКТУРИРОВАННАЯ ВОДА — БАЗОВЫЕ ПОНЯТИЯ → .
Минерализация воды
Экологический энциклопедический словарь
МИНЕРАЛИЗАЦИЯ ВОДЫ — насыщение воды неорганич. (минеральными) веществами, находящимися в ней в виде ионов и коллоидов; общая сумма неорганических солей, содержащихся преимущественно в пресной воде, степень минерализации обычно выражают в мг/л или г/л (иногда в г/кг).
Экологический энциклопедический словарь. — Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989
Вязкость воды
Вязкость воды — характеризует внутреннее сопротивление частиц жидкости ее движению:
Геологический словарь
Вязкость воды (жидкости) — свойство жидкости, обусловливающее при движении возникновение силы трения. Является фактором, осуществляющим передачу движения от слоев воды, перемещающихся с большой скоростью, к слоям с меньшей скоростью. Вязкость воды зависит от температуры и концентрации раствора. Физически она оценивается коэф. вязкости, который входит в ряд формул движения воды.
Геологический словарь: в 2-х томах. — М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978
Различают два вида вязкости воды:
- Динамическая вязкость воды — 0,00101 Па•с (при 20°C).
- Кинематическая вязкость воды — 0,01012 см 2 /с (при 20°C).
Более подробно читайте в нашей статье — ВЯЗКОСТЬ ВОДЫ → .
Критическая точка воды
Критической точкой воды называется ее состояние при определенном соотношении давления и температуры, когда ее свойства одинаковы в газообразном и жидком состоянии (газообразной и жидкой фазе).
Критическая точка воды: 374°C, 22,064 MПа.
Диэлектрическая проницаемость
Диэлектрическая проницаемость, в общем, является коэффициентом показывающим, во сколько сила взаимодействия между двумя зарядами в вакууме больше чем в определенной среде.
В случае с водой этот показатель необычайно высок и для статических электрических полей равняется 81.
Теплоёмкость воды
Теплоёмкость воды — вода обладает на удивление высокой теплоемкостью:
Экологический словарь
Теплоемкость — свойство веществ поглощать тепло. Выражается в количестве тепла, поглощаемого веществом при его нагреве на 1°С. Теплоемкость воды около 1 кал/г, или 4,2 Дж/г. Теплоемкость почвы (при 14,5-15,5°С) колеблется (от песчаных до торфяных почв) от 0,5 до 0,6 кал (или 2,1-2,5 Дж) на единицу объема и от 0,2 до 0,5 кал (или 0,8-2,1 Дж) на единицу массы (г).
Экологический словарь. — Алма-Ата: «Наука». Б.А. Быков. 1983
Научно-технический энциклопедический словарь
УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ (обозначение с), тепло, необходимое для того, чтобы поднять температуру 1 кг вещества на 1К. Измеряется в Дж/К.кг (где Дж -ДЖОУЛЬ). Вещества с высокой удельной теплоемкостью, такие как вода, требуют большего количества энергии для поднятия температуры, чем вещества с низкой удельной теплоемкостью.
Научно-технический энциклопедический словарь
Теплопроводность воды
Теплопроводность вещества подразумевает его способность проводить тепло от своих более горячих частей к более холодным.
Передача тепла в воде происходит либо на молекулярном уровне, т. е. передаётся молекулами воды, либо благодаря движению / перемещению каких, либо объемов вод – турбулентная теплопроводность.
Теплопроводность воды зависит от температуры и давления.
Текучесть
Под текучестью веществ понимают их способность менять свою форму под влиянием постоянного напряжения или постоянного давления.
Текучесть жидкостей, так же определяется подвижностью их частиц, которые в состоянии покоя неспособны воспринимать касательные напряжения.
Индуктивность
Индуктивность определяет магнитные свойства замкнутых цепей электрического тока. Вода, за исключением некоторых случаев, электрический ток проводит, а следовательно и обладает определенной индуктивностью.
Плотность воды
Плотность воды — определяется отношением ее массы к объему при определенной температуре. Подробнее читайте в нашем материале — ЧТО ТАКОЕ ПЛОТНОСТЬ ВОДЫ → .
Сжимаемость воды
Сжимаемость воды – очень мала и зависит от солености воды и давления. Например у дистиллированной воды она равняется 0,0000490. В естественных природных условиях вода практически несжимаемая, но в промышленном производстве для технических целей воду сильно сжимают. Например, для резки твердых материалов, в том числе и таких как металлы.
Электропроводность воды
Электропроводность воды — во многом зависит от количества растворенных в них солей.
Радиоактивность
Радиоактивность воды – зависит от содержания в ней радона, эманации радия.
Физико-химические свойства воды
Словарь по гидрогеологии и инженерной геологии
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ — параметры, определяющие физико-химические особенности природных вод. К ним относятся показатели концентрации водородных ионов (рН) и окислительно-восстановительный потенциал (Eh).
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат. Составитель: А. А. Маккавеев, редактор О. К. Ланге. 1961
Растворимость
Разные источники данное свойство классифицируют по разному — одни относят его к физическим, другие к химическим свойствам вещества. Поэтому на данном этапе мы отнесли его к физико-химическим свойствам воды, что и подтверждается одним из определений растворимости, приведённом ниже.
Большой Энциклопедический словарь
РАСТВОРИМОСТЬ — способность вещества в смеси с одним или несколькими другими веществами образовывать растворы. Мера растворимости вещества в данном растворителе — концентрация его насыщенного раствора при данных температуре и давлении. Растворимость газов зависит от температуры и давления, растворимость жидких и твердых тел практически от давления не зависит.
Большой Энциклопедический словарь. 2000
Справочник дорожных терминов
Растворимость – свойство материала (веществ) образовывать однородные системы, имеющие одинаковый химический состав и физические свойства.
Справочник дорожных терминов, М. 2005
Общая химия
Растворимость – свойство газообразных, жидких и твердых веществ переходить в растворенное состояние; выражается равновесным массовым отношением растворенного вещества и растворителя при данной температуре.
Общая химия: учебник А. В. Жолнин; под ред. В. А. Попкова, А. В. Жолнина. 2012
Физическая энциклопедия
Растворимость — способность вещества образовывать с др. веществом растворы. Количественно характеризуется концентрацией вещества в насыщенном растворе. Растворимость определяется физ. и хим. сродством молекул растворителя и растворённого вещества, к-рое характеризуется т. н. энергией взаимообмена молекул раствора. Как правило, растворимость велика, если молекулы растворяемого вещества и растворителя обладают сходными свойствами («подобное растворяется в подобном»).
Зависимость растворимости от температуры и давления устанавливается с помощью Ле Шателъе- Брауна принципа. Растворимость возрастает с ростом давления и проходит через максимум при высоких давлениях; растворимость газов в жидкостях с ростом температуры падает, в металлах растёт.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988
Кислотно-щелочное равновесие (pH воды)
Кислотно-щелочной баланс воды определяется pH показателем, значение которого может изменяться от 0 до 14. Значение 7 — определяет кислотно-щелочной баланс воды как нейтральный, если меньше 7 — вода кислотная, более 7 — щелочная вода.
Окислительно-восстановительный потенциал воды
Окислительно-восстановительный потенциал воды (ОВП) — способность воды вступать в биохимические реакции.
Химические свойства воды
ХИМИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА – это свойства, которые проявляются в результате химических реакций.
Ниже приведены Химические свойства воды по учебнику «Основы химии. Интернет-учебник» авторов А. В. Мануйлова, В. И. Родионова.
Взаимодействие воды с металлами
При взаимодействии воды с большинством металлов происходит реакция с выделением водорода:
- 2Na + 2H2O = H2 + 2NaOH (бурно);
- 2K + 2H2O = H2 + 2KOH (бурно);
- 3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании).
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
При взаимодействии воды с благородными металлами, такими как золото, платина …, реакция отсутствует.
Взаимодействие воды с неметаллами
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
- C + H2O = H2 + CO (при сильном нагревании);
- CH4 + 2H2O = 4H2 + CO2 (при сильном нагревании).
Взаимодействие воды с электрическим током
При воздействии электрическим током вода разлагается на водород и кислород. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Взаимодействие воды с оксидами неметаллов
Вода вступает в реакцию со многими оксидами неметаллов и некоторыми оксидами металлов. Это не окислительно-восстановительные реакции, а реакции соединения:
- SO2 + H2O = H2SO3 (сернистая кислота);
- SO3 + H2O = H2SO4 (серная кислота);
- CO2 + H2O = H2CO3 (угольная кислота).
Взаимодействие воды с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.
Примеры таких реакций мы уже встречали:
CaO + H2O = Ca(OH)2 (гидроксид кальция (гашеная известь).
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Например: ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
Гидраты и кристаллогидраты
Вода образует соединения, гидраты и кристаллогидраты, в которых полностью сохраняется молекула воды.
- CuSO4 + 5 H2O = CuSO4.5H2O;
- CuSO4 — вещество белого цвета (безводный сульфат меди);
- CuSO4.5H2O — кристаллогидрат (медный купорос), синие кристаллы.
Другие примеры образования гидратов:
- H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты);
- NaOH + H2O = NaOH.H2O (гидрат едкого натра).
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
Био-синтез
Вода участвует в био-синтезе в результате, которого образуется кислород:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
Выводы
Мы видим, что СВ разнообразны и охватывают практически все аспекты жизни на Земле. Как сформулировал один из ученых … изучать воду необходимо комплексно, а не в контексте отдельных ее проявлений.
При подготовке материала использовалась информация с книг – Ю. П. Рассадкина «Вода обыкновенная и необыкновенная», Ю. Я. Фиалкова «Необычные свойства обычных растворов», Учебника «Основы химии. Интернет-учебник» авторов А. В. Мануйлова, В. И. Родионова и др.
Источник