- Вода это хороший растворитель или не очень
- Что такое вода
- Круговорот воды
- Водонапорная станция
- Очистка воды
- Вода как растворитель
- Жесткая вода
- Умягчение воды
- Загрязнение воды
- Краткая характеристика роли воды для организмов
- Вода как растворитель — свойства, значение и примеры
- Свойства воды как растворителя
- Какие вещества растворяются в воде
- Что не растворяется в воде
- Значение воды как растворителя
Вода это хороший растворитель или не очень
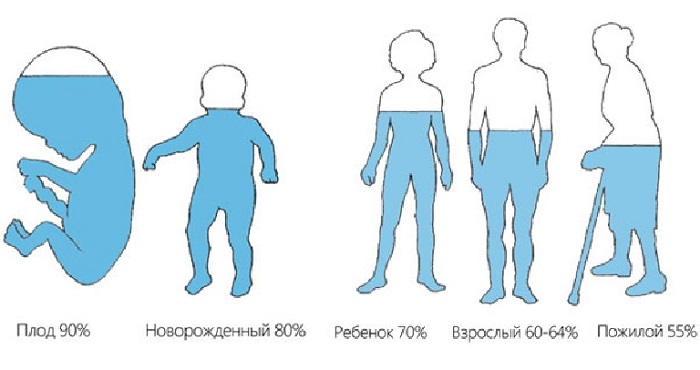
Вода — одно из самых распространенных соединений на Земле. Она есть не только в реках и морях; во всех живых организмах тоже присутствует вода. Без нее невозможна жизнь. Вода — хороший растворитель (в ней легко растворяются разные вещества). Кровь животных и сок растений состоят преимущественно из воды. Вода существует вечно; она постоянно переходит из почвы в атмосферу и организмы и обратно. Более 70% земной поверхности покрыто водой.
Что такое вода
Вода — это химическое соединение. Молекула воды состоит из двух атомов водорода и связанного с ними атома кислорода. Химическая формула воды — Н2О, оксид водорода. При сгорании водорода в воздухе образуется вода. Чистая, т.е. не содержащая примесей вода закипает при 100°С и замерзает при 0°С. Наличие растворенных в ней примесей влияет на температуру кипения и замерзания. Измерение температуры кипения — один из способов определить, есть ли в воде примеси. При кипении воды образуется газ — водяной пар. Кристаллизуясь, вода образует лед. В отличие от других веществ при замерзании вода расширяется, так что вода плотнее льда. Поэтому лед плавает на поверхности воды. Лед не тонет, потому что он менее плотный, чем вода. Благодаря этому рыбы и другие животные могут жить в арктических водах подо льдом. Живущие в полярных областях животные (например, тюлени) ныряют под плавающую в океане льдину и в воде добывают себе пищу — рыб и других морских животных (см. статью «Жизнь в океанах«).
Круговорот воды
Вода рек, морей, озер постоянно испаряется, превращаясь в мельчайшие капли водяного пара. Капли собираются вместе, образуя облака, из которых вода проливается на землю в виде дождя. В этом состоит круговорот воды в природе. В облаках пар охлаждаемся и возвращается на землю в виде дождя, снега или града. Сточные воды из канализации и с заводов очищаются и затем сбрасываются в море.
Водонапорная станция
Речная вода обязательно содержит примеси, поэтому ее необходимо очищать. Вода поступает в водохранилища, где отстаивается и твердые частицы оседают на дно. Затем вода проходит через фильтры, задерживающие оставшиеся твердые частицы. Вода просачивается через слои чистого гравия, песка или активированного угля, где она очищается от грязи и твердых примесей. После фильтрации воду обрабатывают хлором, чтобы убить болезнетворные бактерии, после чего закачивают ее в резервуары и подают в жилые дома и на заводы. Прежде чем сточная вода уйдет в море, ее нужно очистить. На водоочистной станции ее пропускают через фильтры, задерживающие грязь, затем перекачивают в отстойники, где твердые частицы должны осесть на дно. Бактерии уничтожают остатки органических веществ, разлагая их на безвредные компоненты.
Очистка воды
Вода — хороший растворитель, поэтому она обычно содержит примеси. Очистить воду можно с помощью дистилляции (см. статью «Соединения и смеси»), но более эффективный метод очистки — деионизация (обессоливание). Ионы — это атомы или молекулы, утратившие или приобретшие электроны и в силу этого получившие положительный или отрицательный заряд. Для деионизации берется вещество, называемое ионитом. В нем есть положительно зараженные ионы водорода (Н + ) и отрицательно заряженные ионы гидроксида (ОН — ) Когда загрязненная вода проходит через ионит, ионы примесей заменяются ионами водорода и гидроксида из ионита. Ионы водорода и гидроксида соединяются, образуя новые молекулы воды. Вода, прошедшая через ионит, уже не содержит примесей.
Вода как растворитель
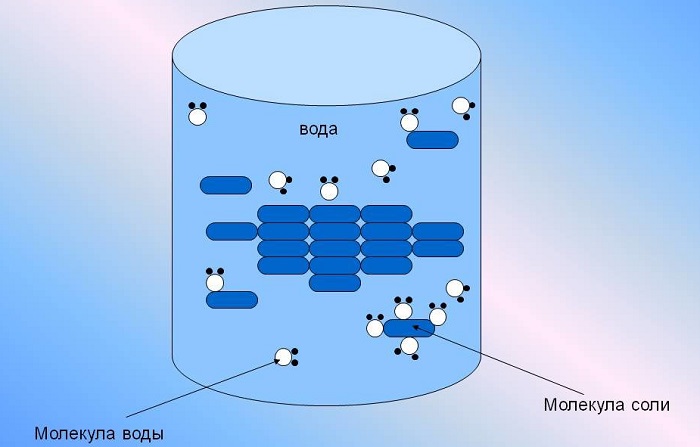
Вода — превосходный растворитель, очень многие вещества легко растворяются в ней (см. так же статью «Химические реакции«). Именно поэтому в природе редко встречается чистая вода. В молекуле воды электрические заряды слегка разделены, так как атомы водорода располагаются с одной стороны молекулы. Из-за этого ионные соединения (соединения, состоящие из ионов) так легко растворяются в ней. Ионы заряжены, и молекулы воды притягивают их.
Вода, как и все растворители, может растворить только ограниченное количество вещества. Раствор называется насыщенным, когда растворитель не может растворить дополнительную порцию вещества. Обычно количество вещества, которое способен растворить растворитель, возрастает при нагревании. В горячей коде сахар растворяется легче, чем в холодной. Шипучие напитки — это водные распоры углекислого газа. Чем выше давление, тем большее количество газа способен поглотить раствор. Поэтому когда мы открываем банку с напитком и тем самым, уменьшаем давление, из напитка вырывается углекислый газ. При нагревании растворимость газов уменьшается. В 1 литре речной и морской воды обычно растворено около 0,04 грамма кислорода. Этого хватит водорослям, рыбам и другим обитателям морей и рек.
Жесткая вода
В жесткой воде растворены минералы, попавшие туда из горных пород, по которым текла вода. В такой воде мыло плохо мылится, потому что оно вступает в реакции с минералами и образует хлопья. Существует жесткая вода двух видов; разница между ними в типе растворенных минералов. Тип минералов, растворенных в воде, зависит от типа горных пород, по которым течет вода (см. рис.). Временная жесткость воды возникает при реакции известняка с дождевой водой. Известняк — это нерастворимый карбонат кальция, а дождевая вода — слабый раствор угольной кислоты. Кислота вступает в реакцию с карбонатом кальция и образует гидрокарбонат, который растворяется в воде и придаст ей жесткость.
При кипении или испарении воды с временной жесткостью часть минералов выпадает в осадок, образуя накипь на дне чайника или сталактиты и сталагмиты в пещере. Вода с постоянной жесткостью содержит другие кальциевые и магниевые соединения, например гипс. Эти минералы при кипячении не выпадают в осадок.
Умягчение воды
Удалить минералы, делающие воду жесткой, можно путем добавления в раствор стиральной соды или путем ионного обмена — процесса, аналогичного деионизации воды при очистке. Вещество, содержащее ионы натрии, которые обмениваются с находящимися в воде ионами кальция и магния. В ионообменнике жесткая вода проходит через цеолит — вещество, содержащие натрий. В цеолите ионы кальция и магния замешаются на ионы натрия, которые не придают воде жесткости. Стиральная сода — это карбонат натрия. В жесткой воде она вступает в реакцию с соединениями кальция и магния. В результате получаются нерастворимые соединения, не образующие хлопьев.
Загрязнение воды
Когда неочищенная вода с заводов и из домов попадает в моря и реки, происходит загрязнение воды. Если в воде слишком много отходов, бактерии, разлагающие органические вещества, размножаются и поглощают почти весь кислород. В такой воде выживают только болезнетворные бактерии, способные жить в воде без кислорода. Когда уровень растворенного а воде кислорода снижается, рыбы и растения умирают. В воду также попадает мусор, пестициды и нитраты из удобрении, ядовитые металлы — свинец, ртуть. Ядовитые вещества, в том числе металлы, попадают в организм рыб, а от них — в организмы других животных и даже человека. Пестициды убивают микроорганизмы и животных, нарушая тем самым природный баланс. Удобрения с полей и моющие средства, содержащие фосфаты, попадая в воду, вызывают усиленный рост растений. Растения и бактерии, питающиеся мертвыми растениями, поглощают кислород, снижая его содержание в воде.
Краткая характеристика роли воды для организмов
Вода — важнейшее неорганическое соединение, без которого невозможна жизнь на планете Земля. Это вещество является и важнейшей частью живого вещества, и играет большую роль как внешний фактор для всех живых существ.
На планете Земля вода встречается в трех агрегатных состояниях: газообразном (пары в атмосфере), жидком (вода в гидросфере и туманообразная в атмосфере) и твердом (вода в ледниках, айсбергах и т.д.). Формула парообразной воды — Н2О, жидкой (Н2О)2 (при Т = 277 К) и (Н2O)n — для твердой воды (кристаллы льда), где n = 3, 4, … (зависит от температуры — чем ниже температура, тем больше величина n). Молекулы воды объединяются в частицы с формулой (Н2O)n в результате образования особых химических связей, называемых водородными; такие частицы называются ассоциатами; за счет образования ассоциатов возникают более рыхлые структуры, чем жидкая вода, поэтому при температуре ниже 277 К плотность воды, в отличие от других веществ, не увеличивается, а уменьшается, в результате лед плавает на поверхности жидкой воды и глубокие водоемы не промерзают до дна, тем более что вода имеет малую теплопроводность. Это имеет большое значение для организмов, живущих в воде, — они не погибают при сильных морозах и выживают во время зимних холодов до наступления более благоприятных температурных условий.
Наличие водородных связей обусловливает высокую теплоемкость воды, что делает возможным жизнь на поверхности Земли, так как наличие воды способствует уменьшению перепада температур днем и ночью, а также зимой и летом, ведь при охлаждении вода конденсируется и тепло выделяется, а при нагревании вода испаряется, на разрыв водородных связей затрачивается энергия и поверхность Земли не перегревается.
Молекулы воды образуют водородные связи не только между собой, но и с молекулами других веществ (углеводов, белков, нуклеиновых кислот), что является одной из причин возникновения комплекса химических соединений, в результате образования которого и возможно существование особого вещества — живого вещества, образующего различные живые организмы.
Экологическая роль воды огромна и имеет два аспекта: она является как внешним (первый аспект), так и внутренним (второй аспект) экологическим фактором. Как внешний экологический фактор вода входит в состав абиотических факторов (влажность, среда обитания, составная часть климата и микроклимата). Как внутренний фактор вода играет большую роль внутри клетки и внутри организма. Рассмотрим роль воды внутри клетки.
В клетке вода выполняет следующие функции:
1) среда, в которой располагаются все органоиды клетки;
2) растворитель как для неорганических, так и для органических веществ;
3) среда для протекания различных биохимических процессов;
4) катализатор для реакций обмена между неорганическими веществами;
5) реагент для процессов гидролиза, гидратации, фотолиза и т.д.;
6) создает определенное состояние клетки, например тургор, что делает клетку упругой и механически прочной;
7) выполняет строительную функцию, состоящую в том, что вода входит в состав различных клеточных структур, например мембран, и т. д.;
8) является одним из факторов, объединяющих все клеточные структуры в единое целое;
9) создает электрическую проводимость среды, переводя неорганические и органические соединения в растворенное состояние, вызывая электролитическую диссоциацию ионных и сильно полярных соединений.
В организме роль воды состоит в том, что она:
1) выполняет транспортную функцию, так как переводит вещества в растворимое состояние, а полученные растворы за счет различных сил (например, осмотического давления и др.) перемещаются от одного органа к другому;
2) осуществляет проводящую функцию за счет того, что в организме содержатся растворы электролитов, способные проводить электрохимические импульсы;
3) связывает воедино отдельные органы и системы органов за счет наличия в воде особых веществ (гормонов), осуществляя при этом гуморальную регуляцию;
4) является одним из веществ, которые регулируют температуру тела организма (вода в виде пота выделяется на поверхность тела, испаряется, за счет чего теплота поглощается и организм охлаждается);
5) входит в состав пищевых продуктов и т. д.
Значение воды вне организма охарактеризовано выше (среда для обитания, регулятор температуры внешней среды и т. д.).
Для организмов большую роль играет пресная вода (содержание солей менее 0,3%). В природе химически чистой воды практически не существует, наиболее чистой является дождевая вода сельской местности, удаленной от крупных населенных пунктов. Для организмов пригодна вода, содержащаяся в пресных водоемах — реках, прудах, пресных озерах.
Источник
Вода как растворитель — свойства, значение и примеры
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
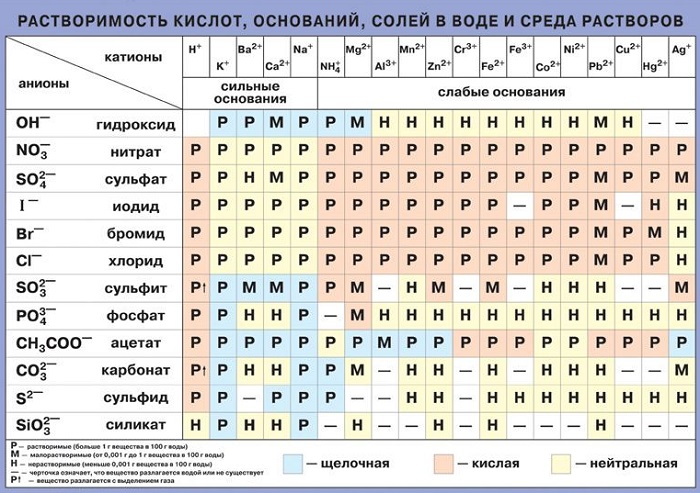
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Источник