Неорганические соединения. Вода и ее свойства
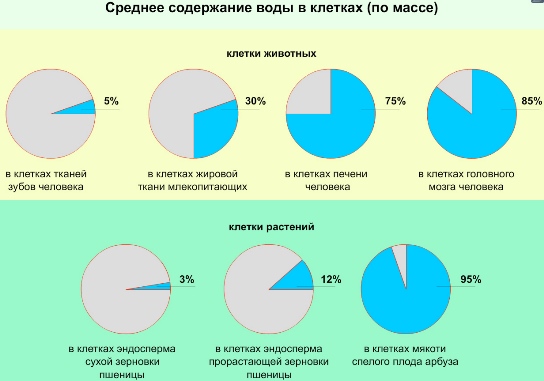
Среди всех веществ на первом месте по массе находится вода. Она составляет около 60-70 %, а в некоторых организмах-до 98 % содержимого. В эмали зубов — 10 %, в нервных клетках — до 85 %. Содержание воды зависит от возраста организма, его активности. Наиболее высокое содержание воды у эмбрионов (90-95 %). У эмбриона человека в 1,5 месяца вода составляет 97,5 %, у восьмимесячного — 83 %, у новорожденного ребенка 74 %, у взрослого человека — в среднем 66 %. С возрастом содержание воды постепенно уменьшается. Содержание воды в разных тканях различное и зависит от их метаболической активности: чем более интенсивные процессы обмена веществ, тем выше содержание воды.
Плотность
Теплоемкость воды и метана. Плотность и структура воды и льда. Гидратация: глицерин, катион и анион.
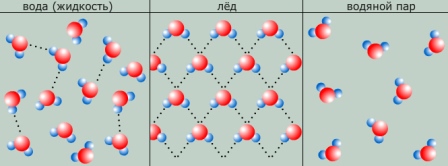
Вода имеет наибольшую плотность при 4 °С, а плотность льда меньше, чем плотность воды. Поэтому водоемы промерзают очень медленно, снаружи покрываясь льдом.
Вода почти не сжимается, что важно для придания формы и упругости клеткам, органам и тканям, обеспечивает тургорное давление, необходимое положение органов и частей организма в пространстве. В сравнении с другими жидкостями вода характеризуется высокой температурой кипения, плавления, большей теплотой испарения (что обеспечивает защиту организма от перегревания). Объясняется это тем, что молекулы воды более крепко связаны между собой, чем молекулы других растворителей.
Форма
Вода находится в двух формах — свободной и связанной (структурированной). Свободная вода составляет 95 % всей воды клетки. Используется преимущественно как растворитель и среда для коллоидной системы цитоплазмы. Связанная вода составляет 4-5% всей воды клетки.
Полярность
Молекулы воды полярны, состоят из двух атомов водорода, которые соединены с атомом кислорода ковалентной связью. Они способны образовывать диполя (в области водорода преобладает положительный заряд, в области кислорода — отрицательный), которые формируют вокруг веществ (белков) водную оболочку и не позволяют им склеиваться. Вода неустойчиво соединена водородными и другими связями с белками.
Молекулы воды способны притягиваться одна к другой положительным и отрицательным зарядами, образуя водородные связи. Водородные связи слабее, чем ковалентные, в 15-20 раз. В жидком состоянии молекулы воды находятся в постоянном движении. Водородные связи при этом то создаются, то разрываются, создавая текучесть.
Растворитель
Вода хороший растворитель, лучше других жидкостей. В ней хорошо растворяется много минеральных и органических веществ, газов. Свойства растворителя обусловлены особенностями ее внутренней молекулярной структуры.
Вещество растворяется, если энергия притяжения молекул воды к молекулам любого вещества большая, чем энергия притяжения между молекулами воды. Вещества делятся, в зависимости от этого, на гидрофильные (от греч. гидрос — вода и филио — люблю), которые хорошо растворяются, и гидрофобные (от греч. гидрос — вода, фобос — бояться), которые практически не растворимы. Гидрофильные вещества: большинство солей натрия, калия, некоторые белки, кислоты и т. п. Гидрофобные — преимущественно неполярные вещества: жиры, жирообразные вещества, каучук, полисахариды и т. п. Они содержат неполярные группы, которые не взаимодействуют с молекулами воды. Проникновение веществ в клетку и выведение из нее продуктов диссимиляции возможно преимущественно только в растворенном виде.
Вода является важной, основной средой, где протекают важные химические реакции.
Вода непосредственно принимает участие в биохимических реакциях — реакциях гидролиза (от греч. гидрос — вода и лизис — расщепление). Например, расщепление белков, углеводов и других веществ происходит вследствие взаимодействия их с водой с участием ферментов.
Вода образуется вследствие многих химических реакций обмена веществ.
Теплоемкость
Вода имеет большую теплоемкость (способность поглощать тепло при незначительных изменениях собственной температуры) и высокую теплопроводность. То есть она является идеальной жидкостью для поддержания теплового равновесия организма, защищает клетку от резких колебаний температуры.
Вода является источником ионов водорода и кислорода при фотосинтезе. Водород используется для восстановления продуктов ассимиляции углекислого газа.
Вода активно участвует в поддержке осмотического давления в клетке. Осмосом (от греч. осмос — давление) называется проникновение молекул растворителя через полупроницаемую мембрану в раствор большей концентрации растворенного вещества. То есть осмос — это односторонняя диффузия молекул воды в направлении растворенного вещества. Переход молекул воды сквозь мембрану прекращается при выравнивании концентраций растворов или при повышении давления в более концентрированном растворе вследствие поступления в него воды. Давление, с которым вода проникает сквозь мембрану, называется осмотическим. Величина осмотического давления возрастает с увеличением концентрации раствора. Осмотическое давление жидкостей организма человека и млекопитающих равняется давлению 0,85% раствора хлорида натрия. Это — изотонический раствор. Два раствора с одинаковым осмотическим давлением, независимо от химического состава растворенных веществ, называются изотоническими (от греч. изос — равный и тонус — сила, напряжение). Более концентрированный раствор называется гипертоническим, менее — гипотоническим.
На явлениях осмоса основано движение воды проводящими тканями растений и напряженное состояние стенок растительных клеток — тургор (от лат. turgere — быть набухшим). Вода, которая всасывается корневыми волосками растений, содержит мало растворенных веществ. Вода проникает в клетки сквозь мембраны и создает в них повышенное давление, придает упругость (тургор) листьям, лепесткам цветов, стеблям травы.
Вода — это основное средство движения веществ в организме и клетке. Благодаря этому происходит обмен веществ между тканями.
Вода с растворенными в ней веществами изменяет температуру замерзания и кипения. Это свойство предотвращает замерзание клеток, организмов.
Источник
Биология в лицее
Сайт учителей биологии МБОУ Лицей № 2 г. Воронежа, РФ 







Site biology teachers lyceum № 2 Voronezh city, Russian Federation
Неорганические вещества клетки. Вода
Все имеющиеся в клетке соединения можно разбить на две группы: органические и неорганические .
Неорганические вещества — это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим).

Среднее содержание воды в клетках составляет 80% от их общей массы. Однако, в зависимости от таксономической и тканевой принадлежности клеток, а также их возраста и состояния содержание воды может изменяться в широких пределах.
Вода — универсальная среда живой материи на клеточном уровне. В клетке вода находится в двух формах: связанная (5%) — формирует гидратные оболочки ионов и молекул, и свободная (95%) — участвует в транспорте веществ цитоплазмы.
165 лет назад Гумбольт и Гей-Люссак доказали, что 2 атома водорода и атом кислорода, соединяясь в молекулу, рождают воду.
Воде была дана волшебная власть стать соком жизни на Земле. (Леонардо да Винчи)
Уникальные свойства воды определяются структурой её молекулы
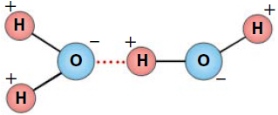
В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Положительные заряды сосредоточены у атомов водорода в силу электроотрицательности кислорода. Молекула представляет собой диполь. Молекула воды испытывает сильное электростатическое притяжение, образуя водородные связи с другими молекулами.
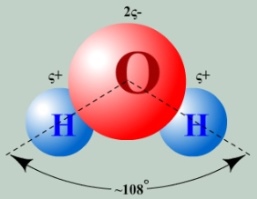
В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Из-за большой разности электроотрицательностей атомов водорода и кислорода электроны всех атомов, составляющих молекулу воды, сильно смещены в сторону кислорода. Вследствие этого атом кислорода приобретает частичный отрицательный заряд. Поэтому молекула воды — диполь : та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно.
Физические и химические свойства воды во многом обусловлены наличием водородных связей между молекулами воды — диполями.
Свойства воды
В жидкой воде наряду с обычными молекулами Н2О содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)x благодаря образованию водородных связей. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
- высокая температура и удельная теплота плавления и кипения (по сравнению с соединениями водорода с похожим молекулярным весом);
- высокая теплоёмкость и низкая вязкость жидкой воды;
- аномальное тепловое расширение при замерзании (при нагревании от 0 до 4°C вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах когда температура падает ниже 4 °C, более холодная вода, как менее плотная, остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура);
- вода — почти универсальный растворитель. Это самый распространённый амфотерный полярный растворитель на Земле. В воде можно растворить большое число веществ, молекулы или ионы которых способны проявлять кислотные и (или) основные свойства.
Вода обладает теплоёмкостью, то есть способностью поглощать теплоту при минимальном изменении собственной температуры. Высокая теплоёмкость и теплопроводность воды обеспечивают регуляцию температуры организма, предохраняя клетку от резких колебаний температур.
Вода обладает большой теплотой испарения. Испарение сопровождается охлаждением, что обусловливает участие воды в терморегуляции организма.
Благодаря своей способности образовывать слабые химические связи с другими веществами вода — прекрасный растворитель гидрофильных веществ. В виде ионов происходит клеточный транспорт веществ. Все вещества по отношению к воде делятся на гидрофильные и гидрофобные .
Гидрофильные вещества (греч. hydor — вода и philia — любовь) — вещества, хорошо растворимые в воде.
Гидрофильностью (хорошей смачиваемостью водой) обладают вещества с ионными кристаллическими решетками (оксиды, гидроксиды, силикаты, сульфаты, фосфаты, глины и т. д.), вещества с полярными группами —ОН, —СООН, —NO 2 и др.

Гидрофобностью (плохой смачиваемостью) обладает большинство органических веществ с углеводородными радикалами, металлы, полупроводники и т. д.
Понятия гидрофильности и гидрофобности относятся не только к телам и веществам, у которых они являются свойством поверхности, но и к отдельным молекулам, их группам, атомам, ионам.
Значение воды
Вода обеспечивает осмотическое поступление веществ в клетку, поддерживает тургор, изменяет плотность тканей.
Под действием некоторых ферментов-катализаторов она вступает в реакции гидролиза, то есть в реакции, при которых к свободным валентностям различных молекул присоединяются группы OH — или H + воды. В результате образуются новые вещества с новыми свойствами. Содержание воды в организме зависит от его возраста и метаболической активности.
Биологическая роль воды в организме
| Роль | Пояснение |
|---|---|
| Растворение | Вода — универсальный амфотерный растворитель. Благодаря полярности, молекулы взаимодействуют с положительно и отрицательно заряженными ионами, способствуя тем самым растворению веществ |
| Продукт химических реакций | Молекулы воды вступают в химические реакции или являются конечным продуктом реакций в процессе обмена веществ |
| Транспорт | Поступление большинства веществ в клетку и удаление их из клетки происходит преимущественно в виде растворов. Выделение растворимых продуктов обмена веществ из организма возможно только при достаточном количестве воды |
| Терморегуляция | Вода, как основной компонент живых организмов, принимает участие в процессе терморегуляции благодаря способности к медленному нагреванию и медленному остыванию. Вода, выделяемая млекопитающими вместе с потом, осуществляет охлаждение организма |
| Поддержание упругости клеток и организмов | Вода поддерживает тургор клеток за счет осмотического давления. У организмов, не имеющих скелетных образований, упругие клетки и (или) полостная жидкость формируют гидроскелет |
Влаголюбивые представители флоры ярко-зелёной окраски (осока, камыш, лапчатка гусиная, мать-и-мачеха, конский щавель, крапива, папоротник) предпочитают расти там, где грунтовые воды подходят близко к поверхности земли. Отыскать на местности водоносные жилы, чтобы не промахнуться с рытьём колодца, можно и с помощью других народных примет. К примеру, давно замечено, что вишни и яблони плохо растут там, где грунтовые воды подходят близко к поверхности земли. А вот ива, верба, ольха, берёза, напротив, чувствуют себя в таких местах чудесно.
Рыжие муравьи воду недолюбливают. В местах, где они устраивают свои муравейники, рыть колодец — дело почти безнадёжное: до воды не докопаешься.
О «живой» и «мёртвой» воде
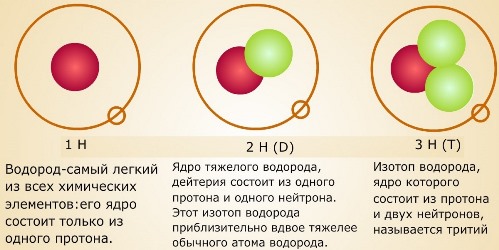
В народных сказках часто встречаются сюжеты о «живой» и «мертвой» воде. Современная наука пришла к выводу, что аналоги этих сказочных веществ на самом деле существуют. Это так называемые «легкая» и «тяжелая» вода.

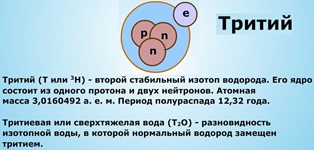
Таким образом, существуют три разновидности воды: обычная или лёгкая ( 1 H2 16 O); дейтериевая или тяжелая (D2O); тритиевая или сверхтяжелая (Т2О). Основную массу природной воды — свыше 99% — составляет лёгкая вода. Одна молекула тяжёлой воды приходится на 3200 молекул лёгкой, а сверхтяжёлой воды во всей гидросфере одновременно насчитывается лишь около 20 кг. Однако чистой 1 H2 16 O в естественных условиях не существует. Во всем мире такую воду получают в немногих специальных лабораториях, путем многократной очистки природной воды, или в результате синтеза.
Различается вода и по изотопному составу кислорода. Помимо кислорода 16 O, в природе существуют еще два природных изотопа — 17 O и 18 O. В природных водах в среднем на каждые 10 тысяч атомов изотопа 16 O приходится 4 атома изотопа 17 O и 20 атомов изотопа 18 O. По современным данным число изотопных разновидностей воды может достигать 135.
Тяжелая вода применяется в ядерных реакторах для торможения нейтронов. А вот использование её для поливки растений приводило к прекращению их роста. Ещё более неутешительными были результаты опытов на животных: получая тяжёлую воду в больших концентрациях, животные погибали, когда половина воды в их теле была дейтерирована. Однако некоторые микроорганизмы хорошо себя чувствуют в 70% растворе D2O, а бактерии способны жить даже в чистой тяжёлой воде.
«Легкая вода», где дейтерий и тяжелый кислород отсутствуют или их содержание значительно снижено, напротив, обладают целым рядом полезных биологических свойств.
Экспериментально были получены результаты: мыши, получившие значительную дозу облучения, имели больший срок жизни, если они пили легкую воду. Кроме того, эксперименты показали, что «легкая вода» замедляет рост некоторых типов опухолей, стимулирует рост.
Источник