Химия, Биология, подготовка к ГИА и ЕГЭ
Размышления ( не учебный материал . ) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
свойства молекулы воды
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
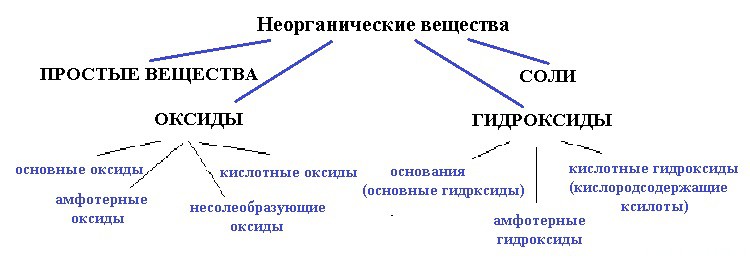
Ниже приведена схема:
вода — точно не простое вещество, так как образована атомами разных элементов;
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2H2 + O2 → 2H2O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
Взаимодействие с кислотами.
Взаимодействие с кислотными оксидами.
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
Взаимодействие со щелочами.
Взаимодействие основными оксидами.
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу : реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H + и анион OH — .
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: H2O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
Взаимодействие с амфотерными гидроксидами.
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
Реакции с металлами.
Реакции с основными и амфотерными оксидами.
Реакции с основаниями и амфотерными гидроксидам.
Реакции с солями.
Для сильных кислот так же реакции ионного обмена.
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H2↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H + и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H2↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Сформулируем основные положения теории «Вода — кислота»:
Молекула воды по свойствам — слабая (очень слабая) кислота.
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
Вода как кислота образует соли — гидроксаты.
К гидроксатам относятся амфотерные и основные гидроксиды.
Формула воды: HOH.
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Источник
Вода это растворимый гидроксид
Среди многоэлементных соединений важную группу составляют гидроксиды. Некоторые из них проявляют свойства оснований (основные гидроксиды) – NaOH , Ba ( OH )2 и т.п.; другие проявляют свойства кислот (кислотные гидроксиды) – HNO 3 , H 3 PO 4 и другие. Существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как свойства оснований, так и свойства кислот – Zn ( OH )2, Al ( OH ) 3 и т.п.
3.1. Классификация, получение и свойства оснований
Основаниями (основными гидроксидами) с позиции теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов ОН — .
По современной номенклатуре их принято называть гидроксидами элементов с указанием, если необходимо, валентности элемента (римскими цифрами в скобках): КОН – гидроксид калия, гидроксид натрия NaOH , гидроксид кальция Ca ( OH )2, гидроксид хрома ( II ) – Cr ( OH )2, гидроксид хрома ( III ) – Cr ( OH )3.
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами — Li , Na , K , Cs , Rb , Fr , Ca , Sr , Ba и поэтому называемые щелочами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов ОН — в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее, небольшие равновесные концентрации иона ОН — даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
По числу гидроксильных групп (кислотность) , способных замещаться на кислотный остаток, различают:
— однокислотные основания – KOH , NaOH ;
— двухкислотные основания – Fe ( OH )2, Ba ( OH )2;
— трехкислотные основания – Al ( OH )3, Fe ( OH )3.
1. Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль.
При получении нерастворимых в воде оснований, обладающих амфотерными свойствами, следует избегать избытка щелочи, так как может произойти растворение амфотерного основания, например,
В подобных случаях для получения гидроксидов используют гидроксид аммония, в котором амфотерные оксиды не растворяются:
Гидроксиды серебра, ртути настолько легко распадаются, что при попытке их получения обменной реакцией вместо гидроксидов выпадают оксиды:
2. Щелочи в технике обычно получают электролизом водных растворов хлоридов:
(суммарная реакция электролиза)
Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
2 Li + 2 H 2 O = 2 LiOH + H 2 ↑ ,
Химические свойства оснований
1. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов:
2. Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
3. Щелочи взаимодействуют с кислотными и с амфотерными оксидами:
4. Основания могут вступать в реакцию с кислыми солями:
5. Необходимо особенно подчеркнуть способность растворов щелочей реагировать с некоторыми неметаллами (галогенами, серой, белым фосфором, кремнием):
2 NaOH + Cl 2 = NaCl + NaOCl + H 2 O (на холоду),
6 KOH + 3 Cl 2 = 5 KCl + KClO 3 + 3 H 2 O (при нагревании),
6. Кроме того, концентрированные растворы щелочей при нагревании способны растворять также и некоторые металлы (те, соединения которых обладают амфотерными свойствами):
Растворы щелочей имеют рН > 7 (щелочная среда), изменяют окраску индикаторов (лакмус – синяя, фенолфталеин – фиолетовая).
Источник
Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
Среди многоэлементных соединений важную группу составляют гидроксиды. Некоторые из них проявляют свойства оснований (основные гидроксиды) – NaOH, Ba(OH) 2 и т.п.; другие проявляют свойства кислот (кислотные гидроксиды) – HNO 3 , H 3 PO 4 и другие. Существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как свойства оснований, так и свойства кислот – Zn(OH) 2 , Al(OH) 3 и т.п.
ОСНОВАНИЯ
Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента .
NaOH – гидроксид натрия,
KOH – гидроксид калия,
Ca(OH) 2 – гидроксид кальция,
Fe(OH) 3 – гидроксид железа (III),
Ba(OH) 2 – гидроксид бария.
Классификация оснований
Щёлочи – это основания растворимые в воде.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH) 2 , Sr(OH) 2 , Ba(OH) 2 . Остальные основания — нерастворимые .
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью как кислоты.
Классификация оснований по числу групп ОН:
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н 2 ↑
2Na + 2H 2 O = 2NaOH + H 2
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na 2 O + H 2 O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra, Sr)
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
Ме х А у + Ме * (OH) n = Me(OH) у ↓+Ме * х А n
CuSO 4 + 2 NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Классифицируйте формулы:
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P 2 O 5 , Ca(OH) 2 , CO, Al(OH) 3 , BeO, Mg(OH) 2 , K 2 O, ZnO, KOH, CrO 3
№3. Приведите по два уравнения реакций получения следующих оснований:
Источник