Биология в лицее
Сайт учителей биологии МБОУ Лицей № 2 г. Воронежа, РФ 







Site biology teachers lyceum № 2 Voronezh city, Russian Federation
Неорганические вещества клетки. Вода
Все имеющиеся в клетке соединения можно разбить на две группы: органические и неорганические .
Неорганические вещества — это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим).

Среднее содержание воды в клетках составляет 80% от их общей массы. Однако, в зависимости от таксономической и тканевой принадлежности клеток, а также их возраста и состояния содержание воды может изменяться в широких пределах.
Вода — универсальная среда живой материи на клеточном уровне. В клетке вода находится в двух формах: связанная (5%) — формирует гидратные оболочки ионов и молекул, и свободная (95%) — участвует в транспорте веществ цитоплазмы.
165 лет назад Гумбольт и Гей-Люссак доказали, что 2 атома водорода и атом кислорода, соединяясь в молекулу, рождают воду.
Воде была дана волшебная власть стать соком жизни на Земле. (Леонардо да Винчи)
Уникальные свойства воды определяются структурой её молекулы
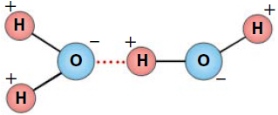
В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Положительные заряды сосредоточены у атомов водорода в силу электроотрицательности кислорода. Молекула представляет собой диполь. Молекула воды испытывает сильное электростатическое притяжение, образуя водородные связи с другими молекулами.
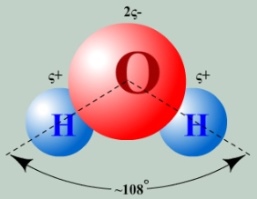
В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Из-за большой разности электроотрицательностей атомов водорода и кислорода электроны всех атомов, составляющих молекулу воды, сильно смещены в сторону кислорода. Вследствие этого атом кислорода приобретает частичный отрицательный заряд. Поэтому молекула воды — диполь : та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно.
Физические и химические свойства воды во многом обусловлены наличием водородных связей между молекулами воды — диполями.
Свойства воды
В жидкой воде наряду с обычными молекулами Н2О содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)x благодаря образованию водородных связей. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
- высокая температура и удельная теплота плавления и кипения (по сравнению с соединениями водорода с похожим молекулярным весом);
- высокая теплоёмкость и низкая вязкость жидкой воды;
- аномальное тепловое расширение при замерзании (при нагревании от 0 до 4°C вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах когда температура падает ниже 4 °C, более холодная вода, как менее плотная, остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура);
- вода — почти универсальный растворитель. Это самый распространённый амфотерный полярный растворитель на Земле. В воде можно растворить большое число веществ, молекулы или ионы которых способны проявлять кислотные и (или) основные свойства.
Вода обладает теплоёмкостью, то есть способностью поглощать теплоту при минимальном изменении собственной температуры. Высокая теплоёмкость и теплопроводность воды обеспечивают регуляцию температуры организма, предохраняя клетку от резких колебаний температур.
Вода обладает большой теплотой испарения. Испарение сопровождается охлаждением, что обусловливает участие воды в терморегуляции организма.
Благодаря своей способности образовывать слабые химические связи с другими веществами вода — прекрасный растворитель гидрофильных веществ. В виде ионов происходит клеточный транспорт веществ. Все вещества по отношению к воде делятся на гидрофильные и гидрофобные .
Гидрофильные вещества (греч. hydor — вода и philia — любовь) — вещества, хорошо растворимые в воде.
Гидрофильностью (хорошей смачиваемостью водой) обладают вещества с ионными кристаллическими решетками (оксиды, гидроксиды, силикаты, сульфаты, фосфаты, глины и т. д.), вещества с полярными группами —ОН, —СООН, —NO 2 и др.

Гидрофобностью (плохой смачиваемостью) обладает большинство органических веществ с углеводородными радикалами, металлы, полупроводники и т. д.
Понятия гидрофильности и гидрофобности относятся не только к телам и веществам, у которых они являются свойством поверхности, но и к отдельным молекулам, их группам, атомам, ионам.
Значение воды
Вода обеспечивает осмотическое поступление веществ в клетку, поддерживает тургор, изменяет плотность тканей.
Под действием некоторых ферментов-катализаторов она вступает в реакции гидролиза, то есть в реакции, при которых к свободным валентностям различных молекул присоединяются группы OH — или H + воды. В результате образуются новые вещества с новыми свойствами. Содержание воды в организме зависит от его возраста и метаболической активности.
Биологическая роль воды в организме
| Роль | Пояснение |
|---|---|
| Растворение | Вода — универсальный амфотерный растворитель. Благодаря полярности, молекулы взаимодействуют с положительно и отрицательно заряженными ионами, способствуя тем самым растворению веществ |
| Продукт химических реакций | Молекулы воды вступают в химические реакции или являются конечным продуктом реакций в процессе обмена веществ |
| Транспорт | Поступление большинства веществ в клетку и удаление их из клетки происходит преимущественно в виде растворов. Выделение растворимых продуктов обмена веществ из организма возможно только при достаточном количестве воды |
| Терморегуляция | Вода, как основной компонент живых организмов, принимает участие в процессе терморегуляции благодаря способности к медленному нагреванию и медленному остыванию. Вода, выделяемая млекопитающими вместе с потом, осуществляет охлаждение организма |
| Поддержание упругости клеток и организмов | Вода поддерживает тургор клеток за счет осмотического давления. У организмов, не имеющих скелетных образований, упругие клетки и (или) полостная жидкость формируют гидроскелет |
Влаголюбивые представители флоры ярко-зелёной окраски (осока, камыш, лапчатка гусиная, мать-и-мачеха, конский щавель, крапива, папоротник) предпочитают расти там, где грунтовые воды подходят близко к поверхности земли. Отыскать на местности водоносные жилы, чтобы не промахнуться с рытьём колодца, можно и с помощью других народных примет. К примеру, давно замечено, что вишни и яблони плохо растут там, где грунтовые воды подходят близко к поверхности земли. А вот ива, верба, ольха, берёза, напротив, чувствуют себя в таких местах чудесно.
Рыжие муравьи воду недолюбливают. В местах, где они устраивают свои муравейники, рыть колодец — дело почти безнадёжное: до воды не докопаешься.
О «живой» и «мёртвой» воде
В народных сказках часто встречаются сюжеты о «живой» и «мертвой» воде. Современная наука пришла к выводу, что аналоги этих сказочных веществ на самом деле существуют. Это так называемые «легкая» и «тяжелая» вода.

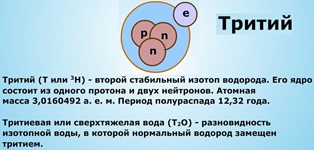
Таким образом, существуют три разновидности воды: обычная или лёгкая ( 1 H2 16 O); дейтериевая или тяжелая (D2O); тритиевая или сверхтяжелая (Т2О). Основную массу природной воды — свыше 99% — составляет лёгкая вода. Одна молекула тяжёлой воды приходится на 3200 молекул лёгкой, а сверхтяжёлой воды во всей гидросфере одновременно насчитывается лишь около 20 кг. Однако чистой 1 H2 16 O в естественных условиях не существует. Во всем мире такую воду получают в немногих специальных лабораториях, путем многократной очистки природной воды, или в результате синтеза.
Различается вода и по изотопному составу кислорода. Помимо кислорода 16 O, в природе существуют еще два природных изотопа — 17 O и 18 O. В природных водах в среднем на каждые 10 тысяч атомов изотопа 16 O приходится 4 атома изотопа 17 O и 20 атомов изотопа 18 O. По современным данным число изотопных разновидностей воды может достигать 135.
Тяжелая вода применяется в ядерных реакторах для торможения нейтронов. А вот использование её для поливки растений приводило к прекращению их роста. Ещё более неутешительными были результаты опытов на животных: получая тяжёлую воду в больших концентрациях, животные погибали, когда половина воды в их теле была дейтерирована. Однако некоторые микроорганизмы хорошо себя чувствуют в 70% растворе D2O, а бактерии способны жить даже в чистой тяжёлой воде.
«Легкая вода», где дейтерий и тяжелый кислород отсутствуют или их содержание значительно снижено, напротив, обладают целым рядом полезных биологических свойств.
Экспериментально были получены результаты: мыши, получившие значительную дозу облучения, имели больший срок жизни, если они пили легкую воду. Кроме того, эксперименты показали, что «легкая вода» замедляет рост некоторых типов опухолей, стимулирует рост.
Источник
Неорганические вещества клетки. Вода.



Вода – самое распространенное в живых организмах неорганическое соединение. Ее содержание колеблется в широких пределах: в клетках эмали зубов вода составляет по массе около 10%, а в клетках развивающегося зародыша – более 90%.
Без воды жизнь невозможна. Она не только обязательный компонент живых клеток, но и среда обитания организмов. Биологическое значение воды основано на ее химических и физических свойствах. Химические и физические свойства воды необычны. Они объясняются, прежде всего, малыми размерами молекул воды, их полярностью и способностью соединяться друг с другом водородными связями.
В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Молекула полярна: кислородный атом несет частичный отрицательный заряд, а два водородных – частично положительные заряды. Это делает молекулу воды диполем. Поэтому при взаимодействии молекул воды друг с другом между ними устанавливаются водородные связи. Они слабее ковалентной, но, поскольку каждая молекула воды способна образовывать 4 водородные связи, они существенно влияют на физические свойства воды. Большая теплоемкость, теплота плавления и теплота парообразования объясняются тем, что большая часть поглощаемого водой тепла расходуется на разрыв водородных связей между ее молекулами. Вода обладает высокой теплопроводностью, благодаря чему в различных участках клетки поддерживается одинаковая температура. Вода практически не сжимается, прозрачна в видимом участке спектра. Наконец, вода – единственное вещество, плотность которого в жидком состоянии больше, чем в твердом.
|
Вода – хороший растворитель ионных (полярных) соединений, а также некоторых не ионных, в молекуле которых присутствуют заряженные (полярные) группы. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами вещества, то молекулы гидратируются и вещество растворяется. По отношению к воде различают гидрофильные вещества – вещества, хорошо растворимые в воде и гидрофобные вещества – вещества, практически нерастворимые в воде. Есть органические молекулы, у которых один участок – гидрофилен, другой – гидрофобен. Такие молекулы называют амфипатическими, к ним относятся, например, фосфолипиды, образующие основу биологических мембран.
Вода является непосредственным участником многих химических реакций (гиролитическое расщепление белков, углеводов, жиров и др.), необходима как метаболит для реакций фотосинтеза.
Большинство биохимических реакций может идти только в водном растворе; многие вещества поступают в клетку и выводятся из нее в водном растворе. Благодаря большой теплоте испарения воды, происходит охлаждение организма.
Максимальная плотность воды при +4°С, при понижении температуры вода поднимается вверх, а так как плотность льда меньше плотности воды, то лед образуется на поверхности, поэтому при замерзании водоемов подо льдом остается жизненное пространство для водных организмов.
Благодаря силам когезии (электростатическому взаимодействию молекул воды, водородным связям) и адгезии (взаимодействию с окружающими ее стенками) вода обладает свойством подниматься по капиллярам – один из факторов, обеспечивающих движение воды в сосудах растений.
Несжимаемость воды определяет напряженное состояние клеточных стенок (тургор), а также выполняет опорную функцию (гидростатический скелет, например, у круглых червей).
Итак, значение воды для организма заключается в следующем:
1. Является средой обитания для многих организмов;
2. Является основой внутренней и внутриклеточной среды;
3. Обеспечивает транспорт веществ;
4. Обеспечивает поддержание пространственной структуры растворенных в ней молекул (гидратирует полярные молекулы, окружает неполярные молекулы, способствуя их слипанию);
5. Служит растворителем и средой для диффузии;
6. Участвует в реакциях фотосинтеза и гидролиза;
7. При испарении участвует в терморегуляции организма;
8. Обеспечивает равномерное распределение тепла в организме;
9. Максимальная плотность воды при +4°С, поэтому лед образуется на поверхности воды.
Источник
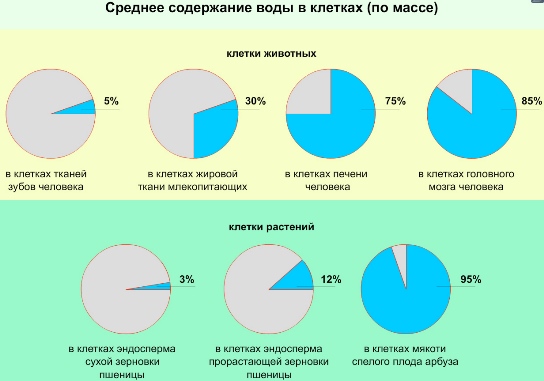
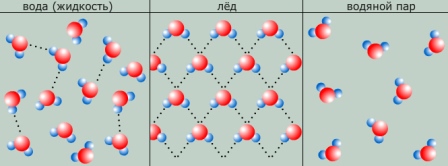
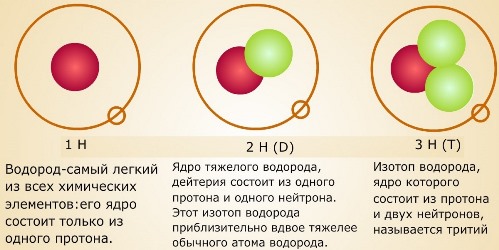



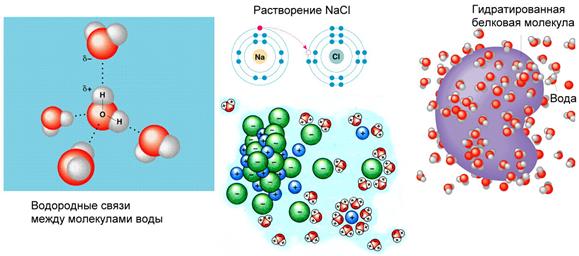 Рис. . Вода. Значение воды.
Рис. . Вода. Значение воды.


