Химия, Биология, подготовка к ГИА и ЕГЭ
Размышления ( не учебный материал . ) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
свойства молекулы воды
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
Ниже приведена схема:
вода — точно не простое вещество, так как образована атомами разных элементов;
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2H2 + O2 → 2H2O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
Взаимодействие с кислотами.
Взаимодействие с кислотными оксидами.
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
Взаимодействие со щелочами.
Взаимодействие основными оксидами.
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу : реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H + и анион OH — .
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: H2O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
Взаимодействие с амфотерными гидроксидами.
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
Реакции с металлами.
Реакции с основными и амфотерными оксидами.
Реакции с основаниями и амфотерными гидроксидам.
Реакции с солями.
Для сильных кислот так же реакции ионного обмена.
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H2↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H + и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H2↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Сформулируем основные положения теории «Вода — кислота»:
Молекула воды по свойствам — слабая (очень слабая) кислота.
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
Вода как кислота образует соли — гидроксаты.
К гидроксатам относятся амфотерные и основные гидроксиды.
Формула воды: HOH.
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Источник
вода — это оксид
Вода́ (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме) , запаха и вкуса (при нормальных условиях) . Химическая формула: Н2O.
КЛАССИФИКАЦИЯ И
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
(поз. 2 опорного конспекта)
Оксиды делят на две группы: несолеобразующие (их немного, например NО, СО) и солеобразующие (их подавляющее большинство) .
В отличие от несолеобразующего каждому солеобразующему оксиду соответствует определенный гидроксид (основание, амфотерный гидроксид или кислота) . В зависимости от этого солеобразующие оксиды подразделяют на основные, амфотерные и кислотные.
Основные оксиды образованы металлами с низким значением степени окисления (+1, +2), например Nа2О, K2O, CaO, MgO.
Все основные оксиды – твердые вещества.
Кислотные оксиды могут быть образованы как неметаллами в различных степенях окисления, так и металлами только в высокой степени окисления (больше 4), например СО2, Сl2O, P2O5, CrO3.
Кислотные оксиды, образованные металлами при обычных условиях, – твердые вещества, а образованные неметаллами – не только твердые, но и жидкие, и газообразные.
Амфотерные оксиды образованы металлами, находящимися в периодической системе химических элементов Д. И. Менделеева либо в главных подгруппах вблизи диагонали бор–астат, например Аl2О3, либо в побочных подгруппах (при этом степень окисления элемента в оксиде чаще всего промежуточная) , например Сr2О3. Все амфотерные оксиды – твердые вещества. Изображение лягушки (представитель класса амфибий) указывает на двойственный характер амфотерных оксидов, проявляемый ими при химических реакциях.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
(поз. 3 опорного конспекта)
Bce основные оксиды реагируют с кислотами, кислотные – с щелочами, амфотерные – с кислотами и щелочами. Продукты таких реакций – соль и ВОДА.
То есть вода это всего лишь продукт реакции
Источник
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
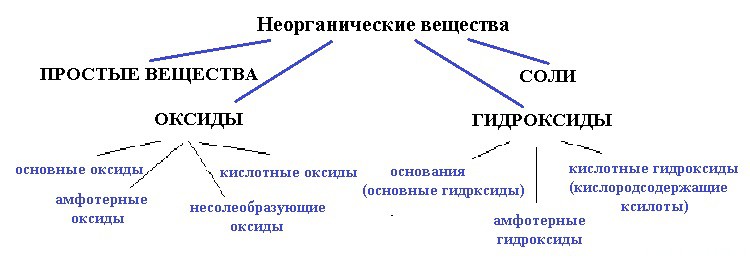
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
» jsaction=»rcuQ6b:WYd;»>
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент — фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF 2 .
Называются они просто — «оксид + название элемента» (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
оксид углерода ( II )
оксид железа (III )
оксид азота ( II )
оксид марганца (VII )
» jsaction=»rcuQ6b:WYd;»>
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
» jsaction=»rcuQ6b:WYd;»>
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксидыметаллов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO — оксид цинка и BeO – оксид берилия):
2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO 3 -оксид хрома (VI), Mn 2 O 7 — оксид марганца (VII)):
3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV , а также цинк и бериллий (Например, BeO, ZnO, Al 2 O 3 , Cr 2 O 3 ).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
Растворимы в воде.
Исключение –SiO 2
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
I «А» и II «А» групп,
исключение Be ,Mg)
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
Физические свойства оксидов
При комнатной температуре большинство оксидов — твердые вещества (СаО, Fe 2 O 3 и др.), некоторые — жидкости (Н 2 О, Сl 2 О 7 и др.) и газы (NO, SO 2 и др.).
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO 2 = CaSO 3
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
СO 2 + H 2 O = H 2 CO 3 , SiO 2 – не реагирует
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO 2 = CaSO 3
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Источник