- Общеклинические исследования
- 1. Вода — универсальный биологический растворитель
- Вода как растворитель — свойства, значение и примеры
- Свойства воды как растворителя
- Какие вещества растворяются в воде
- Что не растворяется в воде
- Значение воды как растворителя
- Вода, химия жизни
- Что такое рН?
- Антиоксиданты блокируют опасное окисление
Общеклинические исследования
1. Вода — универсальный биологический растворитель
Растворителем, в котором работают почти все известные живые системы, служит окись водорода, или вода (H 2O). В молекуле воды атом кислорода соединен с двумя атомами водорода одинарными ковалентными связями. Чтобы понять, почему это важно и на что это влияет, нам придется ввести несколько дополнительных понятий из общей химии.
Электроотрицательность — сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Это понятие ввел Лайнус Полинг (Linus Carl Pauling). Самый электроотрицательный элемент — фтор, за ним на шкале электроотрицательности следует кислород. Иными словами, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора (который в биологической химии практически не встречается). Запомним этот факт.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующие ее электроны никуда не смещены (в рамках старинной планетарной модели атома можно сказать, что они находятся точно посредине между атомами, как на картинке). Такая ковалентная связь называется неполярной.
Если ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого выше электроотрицательность. Такая связь называется полярной. При очень большой разнице в электроотрицательности она может даже стать ионной — это случится, если один атом полностью “отберет” у другого общую пару электронов.
Связь между водородом и кислородом в молекуле воды — типичный пример ковалентной полярной связи. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на кислороде возникает маленький отрицательный заряд, а на водороде маленький положительный; эти заряды принято обозначать буквой δ (“дельта”).
Связи кислорода с водородом или углеродом (H-O или C-O) — всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде. В то же время связь между углеродом и водородом (C-H) считается неполярной: разница в электроотрицательности между этими элементами так мала, что смещение электронов незаметно. Например, молекулы углеводородов в силу этого полностью неполярны, они не несут никаких частичных зарядов ни на каких атомах.
При наличии полярных связей между водородом и кислородом частичные заряды на этих атомах (отрицательные на кислороде и положительные на водороде) притягиваются друг к другу, образуя водородные связи. Эти связи гораздо слабее ковалентных, но могут давать сильный эффект, если их много. Например, именно из-за колоссального количества водородных связей у воды очень высокая теплоемкость — ее трудно нагреть и трудно остудить. Строго говоря, водородная связь может образоваться не только с кислородом, но и с другими электроотрицательными атомами (например, с азотом или фтором).
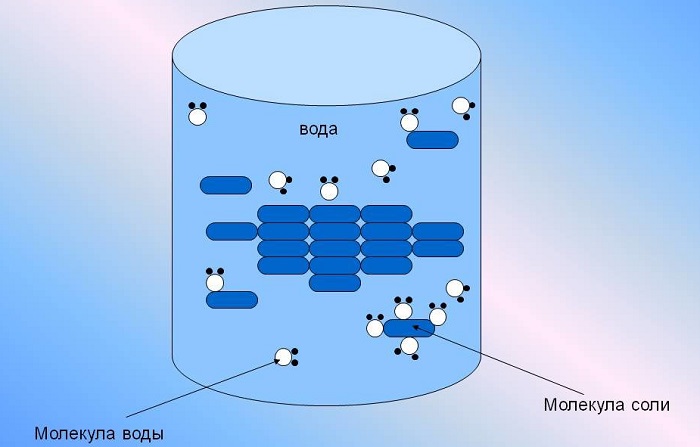
Любые заряженные частицы в водном растворе гидратируются, то есть окружаются молекулами воды — конечно, по-разному ориентированными в зависимости от того, положительная это частица или отрицательная. Любые ионы, растворенные в воде, на самом деле присутствуют там в гидратированном состоянии, то есть с водной оболочкой. На картинке для примера показана растворенная поваренная соль (NaCl) — образец чисто ионного вещества.
Полярные молекулы (а тем более ионы) хорошо взаимодействуют с водой, образуя с ней водородные связи и (или) подвергаясь гидратации. Такие вещества хорошо растворяются в воде и называются гидрофильными. Неполярные молекулы взаимодействуют с водой гораздо слабее, чем друг с другом. Такие вещества плохо растворяются в воде и называются гидрофобными. Типичные гидрофобные вещества — углеводороды. Типичные гидрофильные вещества — спирты, такие как этанол или показанный на картинке глицерин. Вообще кислородсодержащие соединения углерода, как правило, гидрофильны, если только в них нет совсем уж огромных углеводородных радикалов.
Могут ли подойти для жизни другие растворители, кроме воды? Ответ — да. Например, двуокись углерода (CO 2) при более высоких давлениях, чем наше атмосферное, становится жидкостью и представляет собой хороший гидрофильный растворитель, в котором успешно идут многие биохимические реакции. В этом растворителе могут жить даже земные микроорганизмы: например, на дне Окинавского желоба в Восточно-Китайском море обнаружено целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии (Inagaki et al., 2006).
Некоторые исследователи предполагают, что океаны жидкой двуокиси углерода могут существовать на планетах-“суперземлях” с массой, в несколько раз превосходящей массу Земли (Budisa, Schulze-Makuch, 2014). На картинке — художественное изображение планеты GJ1214b в созвездии Змееносца.
На крупнейшем спутнике Сатурна — Титане — есть углеводородные озера и даже моря, состоящие из метана (CH 4), этана (C 2H 6) и пропана (C 3H 8). Это гидрофобный растворитель, в котором тоже иногда предполагают существование жизни, хотя прямых подтверждений тому пока нет. На картине — пейзаж Титана. Жидкой воды на поверхности Титана нет, там слишком холодно.
Аммиак (NH 3) — гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом, и напоминающий воду по физико-химическим свойствам. На более холодных планетах, чем Земля, аммиак находится в жидком состоянии и вполне может быть средой для жизни.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами (на картинке художественное изображение такой планеты). Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть сомнения, то углеродную жизнь в неводном растворителе представить гораздо легче.
Можно придумать и другие экзотические варианты — например, океан из плавиковой кислоты (HF) на планете, описанной в фантастической повести Ивана Ефремова “Сердце Змеи”. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…” Возвращаясь к земной биохимии, будем помнить, что она — не единственная теоретически возможная.
Источник
Вода как растворитель — свойства, значение и примеры
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
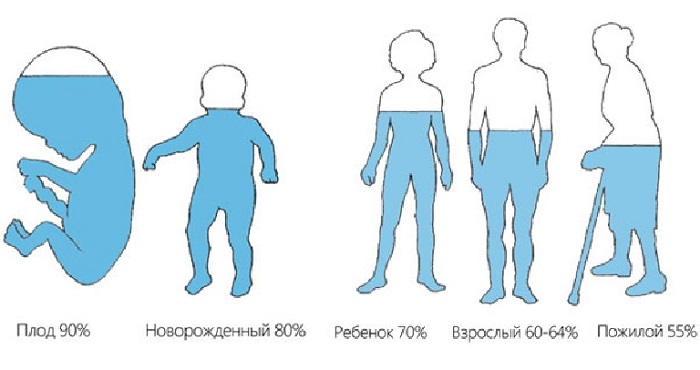
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Источник
Вода, химия жизни

Большая часть живого, как растений, так и животных, основано на воде. Вся жизнь на Земле, как полагают, возникла из воды. Тела всех живых организмов состоят в основном из воды. От 70 до 90 процентов всей органической материи — это вода.
Химические реакции во всех растениях и животных, которые поддерживают жизнь, происходят в водной среде. Вода не только обеспечивает среду, которая делает возможными эти поддерживающие жизнь реакции, но вода сама по себе часто является важным реагентом или продуктом этих реакций. Короче, химия жизни — это химия воды.
Вода — универсальный растворитель
Вода является универсальным, прекрасным растворителем из-за заметной полярности молекулы воды и ее тенденции к формированию водородных связей с другими молекулами. Одна молекула воды, обозначаемая химическим символом Н2О, состоит из 2 атомов водорода и 1 атома кислорода.

Единственный электрон водорода и 8 электронов кислорода — это ключ к химии жизни, потому что именно здесь атомы водорода и кислорода соединяются, чтобы образовать молекулу воды или расщепиться, чтобы образовать ионы.
Водород стремится ионизироваться путем потери своего единственного электрона и образования одиночных ионов Н+, которые являются просто изолированным протонами, поскольку атом водорода не содержит нейтронов. Водородная связь образуется, когда электрон одиночного атома водорода делится с другим электроотрицательным атомом, таким как кислород, у которого не достает электрона.
Полярность молекул воды
В молекуле воды два атома водорода ковалентно связаны с 
Оболочки атомов водорода, из-за того, что их электроны ближе к кислороду, приобретают слегка положительный заряд. Это означает, что молекулы воды стремятся к образованию слабых связей с молекулами воды, поскольку кислородный конец молекулы отрицателен, а водородный конец — положителен.
Атом водорода, оставаясь ковалентно связанным с кислородом собственной молекулы, может образовывать слабую связь с кислородом другой молекулы. Точно так же кислородный конец молекулы может образовывать слабое притяжение с водородными концами других молекул. Поскольку молекулы воды обладают такой полярностью, вода является непрерывной химической сущностью.
Эти слабые связи играют решающую роль в стабилизации формы многих больших молекул, обнаруживаемых в живой материи. Поскольку эти связи слабы, они готовы порваться и снова образовываться в ходе нормальных физиологических реакций. Разрыв и восстановление таких слабых связей является сутью химии жизни.
Чтобы проиллюстрировать способность воды разрушать другие вещества, рассмотрим простой пример, когда небольшое количество поваренной соли помещается в стакан водопроводной воды. У сухой соли (NaCl) притяжение между положительными атомами натрия (Na+) и отрицательными атомами хлора (Cl-) соли очень сильно до тех пор, пока ее не поместят в воду. После того, как соль помещена в воду, притяжение отрицательного кислорода молекулы воды в отношении положительно заряженных ионов натрия, и одновременно притяжение положительного водородного конца молекулы воды в отношении отрицательно заряженных ионов хлора оказывается больше, чем взаимное притяжение между ионами Na+ и Cl-. В воде ионные связи в молекуле хлористого натрия легко рвутся из-за конкурирующего действия многочисленных молекул воды.
Как видно из этого простого примера, даже хрупкая конфигурация отдельных молекул воды позволяет им разорвать относительно более сильные связи «общими усилиями». Вот почему мы зовем воду универсальным растворителем. Естественное растворение рвет связи в более крупных и комплексных молекулах. Это и есть химия жизни на Земле, в воде и на суше.
В основном восстановление означает добавление электрона (е-), а его противоположность, окисление означает отбор электрона. Добавление электрона, восстановление, накапливает энергию в восстановленном соединении. Отбор электрона, окисление, высвобождает энергию из окисляемого соединения. Когда одно вещество восстанавливается, другое — окисляется.
Чтобы пояснить термины, рассмотрим две молекулы, например, А и В. Когда молекулы А и В приходят в соприкосновение, вот что получается:
В захватывает электрон из молекулы А.
Молекула А окисляется, поскольку она потеряла электрон.
Чистый заряд В был восстановлен (уменьшен), поскольку она получила отрицательный электрон (е-).
В биологических системах отбор или добавление электрона составляет наиболее распространенный механизм окислительно-восстановительных реакций. Эти окислительно-восстановительные реакции часто называют ОВР.
Кислота — это вещество, которое увеличивает концентрацию ионов водорода (Н+) в воде.
Основание — это вещество, которое уменьшает концентрацию ионов водорода, увеличивая концентрацию гидроксидных ионов ОН+.
Степень кислотности или щелочности раствора измеряется в терминах величины, известной, как рН, которая является отрицательным логарифмом концентрации ионов водорода:
Что такое рН?
По шкале рН, которая имеет диапазон от 0 на кислотном конце до 14 на щелочном конце, раствор является нейтральным, если его рН равно 7. При рН 7 вода содержит равные концентрации ионов Н+ и ОН-. Вещества с рН меньше 7 являются кислотами, поскольку они содержат более высокую концентрацию ионов Н+. Вещества с рН более 7 являются щелочами, поскольку они содержат более высокую концентрацию ОН-, чем Н+. Шкала рН является логарифмической шкалой, поэтому изменение рН на единицу означает десятикратное изменение концентрации ионов водорода.
Важность балансирования рН
Все живое чрезвычайно чувствительно к рН и функционирует наилучшим образом (за некоторыми исключениями, такими как определенные отделы пищеварительного тракта), когда растворы близки к нейтральным. Большая часть внутренней живой материи (за исключением ядер клеток) имеет рН около 6,8.
Плазма крови и другие жидкости, окружающие клетки в теле, имеет рН от 7,2 до 7,3. Многочисленные специальные механизмы помогают стабилизировать эти жидкости, так чтобы клетки не подвергались ощутимым флуктуациям рН. Вещества, которые служат в качестве механизма стабилизации рН, называются буферами. Буферы обладают способностью связывать ионы и удалять из из раствора, когда их концентрация начинает расти. Соответственно, буферы могут высвобождать ионы, когда их концентрация начинает падать. Таким образом, буферы помогают минимизировать флуктуации рН. Это важная функция, поскольку многие биохимические реакции, нормально протекающие в живых организмах, или высвобождают, или используют ионы.
Кислород: слишком много хорошего?
Кислород очень важен для жизни. В воздухе он относительно стабилен, но, будучи в слишком больших количествах поглощен телом, он может стать активным и нестабильным, и имеет тенденцию прикреплять себя к биологическим молекулам, включая молекулы здоровых клеток. Химическая активность таких свободных радикалов обусловлена одной или более пар несвязанных электронов.
Около 2% кислорода, которым мы обычно дышим, становятся активным кислородом, и это количество возрастает примерно до 20% при занятиях аэробикой.

Активный кислород в теле
Однако, возникают проблемы, когда слишком много таких свободных радикалов высвобождается в теле, где они могут повредить также и нормальные ткани.
Разложение начинается, когда микробы из воздуха поглощают белки, пептиды и аминокислоты яиц, рыбы и мяса. Результатом является масса неприятных веществ, таких как:
Сероводород
Аммиак
Гистамины
Индолы
Фенолы
Скатолы
Эти вещества также образуются естественным образом в пищеварительном тракте, когда мы перевариваем пищу, что приводит к неприятному запаху фекалий. Разложение испорченных продуктов вызывается микробами, присутствующими в воздухе, этот естественный процесс воспроизводится в пищеварительном тракте кишечными микробами. Все эти отходы пищеварения патогенны, то есть они могут вызвать болезнь в теле.
Сероводород и аммиак являются тканевыми токсинами, которые могут разрушать печень. Гистамины вносят свой вклад в аллергические расстройства, такие как аллергический дерматит, крапивница и астма. Индолы и фенолы считаются канцерогенными. Поскольку такие продукты, как сероводород, аммиак, гистамины, фенолы и индолы являются токсичными, защитные механизмы организма пытаются удалить их, высвобождая нейтрофилы (тип лейкоцитов или белых кровяных телец). Эти нейтрофилы вырабатывают активный кислород, нетипичные молекулы кислорода, которые способны очистить разлагающиеся ткани, отбирая электроны у молекул токсичных клеток.
Однако возникают проблемы, когда организм вырабатывает слишком много молекул активного кислорода или свободных радикалов. Они чрезвычайно активны и могут присоединяться к нормальным, здоровым клеткам и повреждать их генетически. Такие активные кислородные радикалы крадут электроны у нормальных, здоровых биологических молекул. Такой захват электронов активным кислородом окисляет ткань и может вызвать болезнь.
Эффект окисления жизненно важных органов
Поскольку активный кислород может повредить нормальные ткани, очень важно удалить такой активный кислород из организма до того, как он сможет вызвать разложение здоровой ткани. Если мы можем найти эффективный метод блокировки окисления здоровой ткани активным кислородом, мы можем попытаться предотвратить болезнь.
Сероводород, аммиак, гистамины, индолы,
фенолы и скатолы присутствуют в пищеварительном
тракте человеческого организма
Y
Чтобы защитить организм от нарушений, вызываемых
сероводородом, аммиаком, гистаминами, индолами,
фенолами и скатолами, нейтрофилы (лейкоциты)
вырабатывают активный кислород для окисления этих
отходов пищеварения
Y
Происходит избыток в производстве активного кислорода
Y
Избыточный активный кислород может повредить
Молекулы нормальных, здоровых биологических клеток
и изменить их генетический код
Антиоксиданты блокируют опасное окисление
Один их путей защитить здоровую ткань от разрушений окисления, вызванного активным кислородом, — это дать свободные электроны активным кислородным радикалам, таким образом, нейтрализуя их высокий окислительный потенциал и предотвращая их реакцию со здоровой тканью.
Исследования связи между диетой и раком далеки от завершения, но некоторые факты указывают: то, что мы едим, может повлиять на нашу восприимчивость к раку. Некоторые виды пищи, возможно, помогают защититься от рака, другие, возможно, способствуют его развитию.
Многие нарушения, вызываемые канцерогенными веществами в пище, могут происходить из-за окислительной реакции в клетке. В этом процессе нетипичные молекулы кислорода могут нарушать генетический код клетки. Некоторые исследователи полагают, что вещества, которые предотвращают окисление, называемые АНТИОКСИДАНТАМИ, могут блокировать повреждения. Это, естественно, приводить к теории о том, что прием естественных антиоксидантов может быть важным аспектом защиты организма от рака. Вещества, которые, по их мнению, защищают от рака, включают витамин С, витамин Е, бета-каротин, селен и глутатион (аминокислота). Эти вещества являются восстановительными агентами. Они поставляют электроны свободным радикалам и блокируют взаимодействие свободных радикалов с нормальной тканью.
Как можно избежать болезни
Как было отмечено ранее, присутствие токсичных отходов пищеварения, таких как сероводород, аммиак, гистамины, индолы, фенолы и скатолы влияют на неприятный запах человеческих фекалий. Из медицинской практики хорошо известно, что пациенты, страдающие гепатитом или циррозом, имеют особенно зловонный стул.
Особое зловоние стула вызвано присутствием токсинов, которые являются индикаторами определенных заболеваний, а организм реагирует на присутствие таких токсинов выработкой лейкоцитов нейтрофилов для высвобождения активного кислорода в попытке нейтрализовать нарушения в организме, которые могут быть вызваны такими отходами пищеварения. Но когда производится избыточное количество активного кислорода, он может разрушать здоровые клетки одновременно с нейтрализацией токсинов. Это приводит нас к заключению о том, что мы можем минимизировать вредное действие радикалов активного кислорода путем их восстановления, обильно поставляя электроны.
Вода, нейтральный раствор
Нет замены здоровой, сбалансированной диете особенно богатой ангтиоксидантами, такими как витамин С, витамин Е, бета-каротин и другими полезными питательными веществами. Однако эти вещества не являются лучшими источниками свободных электронов, которые могут остановить окисление здоровой ткани активным кислородом.
Вода, обработанная электролизом для увеличения восстановительного потенциала, является наилучшим решением проблемы обеспечения безопасным источником свободных электронов для прекращения окисления нормальной ткани радикалами свободного кислорода. Мы полагаем, что восстановленная вода, вода с избытком свободных электронов, чтобы доставить их активному кислороду, является наилучшим решением, поскольку:
Восстановительный потенциал воды может быть существенным образом увеличен по сравнению с другими антиоксидантами в пище или витаминными добавками.
Молекулярный вес восстановленной воды низок, что делает ее быстродействующей, способной проникнуть во все ткани организма в короткий срок.
Что такое ИОНИЗИРОВАННАЯ ВОДА (Микровода)?
Ионизированная вода — это продукт умеренного электролиза, который происходит в приборе для ионизации воды. Производство ионизированной воды, ее свойства и как она работает в человеческом организме — все это описано в следующем разделе. Ионизированная вода — это обработанная водопроводная вода, которая была не только отфильтрована, но также была преобразована так, что получилась восстановленная вода с огромным количеством электронов, которые могут быть доставлены активному кислороду в организме, чтобы прекратить окисление нормальных клеток.
Водопроводная вода: чем она является и чем не является?
Нормальная водопроводная вода, например, с рН = 7, почти нейтральна по шкале рН от 0 до 14. Если измерить ее окислительно-восстановительный потенциал с помощью специального измерителя, он окажется равным примерно от + 400 до +500 мВ. Поскольку вода имеет положительный окислительно-восстановительный потенциал (ОВП), она стремится к захвату электронов и окислению других молекул. Восстановленная Ионизированная Вода, с другой стороны, имеет отрицательный ОВП примерно от — 250 до — 350 мВ. Это означает, что у нее есть огромная масса электронов, готовых поступить к страдающему недостатком электронов активному кислороду.

Сравнение окислительно-восстановительного потенциала
После ионизации в устройстве Ионизации Воды, восстановленная вода выходит из катодной части, а окисленная вода — из анодной части. Сравним измерения для этих трех типов воды: водопроводной воды до электролиза, восстановленной воды и окисленной воды.
Источник