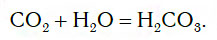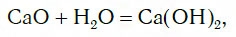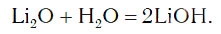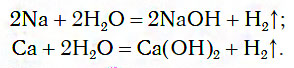- I. Реакции, в которых вода играет роль окислителя
- II. Реакции, в которых вода играет роль восстановителя
- III. Реакции внутримолекулярного окисления — восстановления воды.
- Реакции гидратации
- II. Гидратация оксидов
- III. Гидратация органических соединений, содержащих кратные связи
- Реакции гидролиза
- Урок 28. Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
- Водород
- Окислительно-восстановительные свойства воды.
- Коррозия металлов
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н + 2О = 2NaOH + H 0 2↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2) Взаимодействие с неметаллами, имеющими низкую ЭО
(реакции происходят в жестких условиях)
C + Н + 2О = CO + H 0 2↑ («водяной газ»)
В присутствии щелочей кремний вытесняет водород из воды:
3) Взаимодействие с гидридами металлов
NaH + Н + 2 O = NaOH + H 0 2↑
4) Взаимодействие с угарным газом и метаном
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O2 или до пероксид-анионов [O2] 2- . В исключительном случае (в реакции с F2) образуется кислород со c o. +2.
1) Взаимодействие с фтором
2) Взаимодействие с атомарным кислородом
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
III. Реакции внутримолекулярного окисления — восстановления воды.
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
Термическое разложение — процесс обратимый; степень термического разложения воды невелика.
Реакции гидратации
I. Гидратация ионов.
Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
II. Гидратация оксидов
III. Гидратация органических соединений, содержащих кратные связи
Реакции гидролиза
I. Гидролиз солей
а) по катиону соли
Fe 3+ + Н2O = FeOH 2+ + Н + ; (кислая среда. рН
б) по аниону соли
СО3 2- + Н2O = НСО3 — + ОН — ; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
NH4 + + СН3СОО — + Н2O = NH4OH + СН3СООН (среда, близкая к нейтральной)
II. Гидролиз карбидов металлов
III. Гидролиз силицидов, нитридов, фосфидов
IV. Гидролиз галогенов
V. Гидролиз органических соединений
Классы органических веществ
Продукты гидролиза (органические)
Альдегиды или кетоны
Галогенангидриды карбоновых кислот
Ангидриды карбоновых кислот
Сложные зфиры карбоновых кислот
Карбоновые кислоты и спирты
Глицерин и высшие карбоновые кислоты
Ди- и полисахариды
Пептиды и белки
Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза)
Источник
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
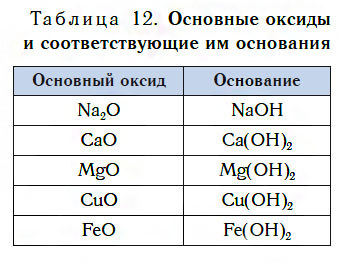
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).
Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
Методом газификации угля, торфа, сланца
Электролизом водных растворов щелочей
Каталитическим окислением кислородом (неполное окисление)
Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
Взаимодействием активных металлов с водой
Реакцией цинка или алюминия с раствором щелочи
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Химические свойства:
- Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реакции с основными и кислотными оксидами
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3).
Реакция с гидридами активных металлов
Реакции с C, CO, CH4
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Окислительно-восстановительные свойства воды.
В окислительно-восстановительных процессах вода, а также составляющие ее катионы водорода гидроксид-ионы могут выступать в роли окислителя и восстановителя. Как восстановитель, вода может окисляться до кислорода. Этому процессу в кислой и щелочной средах соответствует ОВПОТ полуреакций:
О2 + 4H + + 4e 2H2O E o = +1,23B, в кислой рН = 0
О2 + 2Н2О + 4e 4OН — Е о = +0,40В, в щелочной рн = 14
Значения ОВПОТ показывают, что вода очень слабый восстановитель.
Как окислитель вода характеризуется потенциалом реакции восстановления с образованием водорода:
2Н + + 2е Н2 E o = 0B, в кислой среде
2Н2О + 2е → Н2 + 2ОН — Е о =- 0,83В, в щелочной.
Очевидно, что все восстановители, имеющие потенциалы ниже потенциала восстановления водорода, могут выделять водород из водных растворов. Практически из-за кинетических затруднений выделения молекулярного водорода граница восстановительной способности водных растворов на несколько десятых вольт ниже (например не -0,83В, а -1,23В). Эта дополнительная разность потенциалов называется перенапряжением выделения водорода. Перенапряжение выделения водорода определяется механизмом реакции и зависит, в частности, от природы и поверхности восстановителя-металла. Например, перенапряжение выделения водорода на ртутном электроде составляет 0,8 В, а на черненной платине, катализирующий этот процесс, равно нулю. Свинец плохо растворяется в соляной и разбавленной серной кислотах не только из-за образовании плотной солевой пленки, но и из-за высокого перенапряжения выделения водорода на свинце. На рисунке показан пунктирной линией средний эффективный потенциал выделения водорода с учетом перенапряжения в 0,5В. Практически это означает, что большинство металлов растворяются в кислотах с выделением водорода, а наиболее активные – щелочные, щелочно-земельные, лантаноиды и актиноиды – в воде и щелочных растворах.
Коррозия металлов
Коррозия – это процесс самопроизвольного разрушения под воздействием окружающей среды. От 5 до 30% добываемого количества металлов в год разрушается в процессе коррозии. Выходят из строя машины, механизмы, их детали, что требует ремонта, демонтажа оборудования, приводя к большим экономическим потерям – примерно 4% национального дохода в промышленно развитых странах.
Причина коррозии – термодинамическая неустойчивость металлов в окружающей среде, т.е. процесс окисления металлов с участием кислорода – самопроизвольный процесс ∆G 2 ·год), мг/(м 2 ·ч). Для определения скорости коррозии используют массовые, объемные и физические методы. Массовые методы затруднены процессом удаления продуктов коррозии, поэтому чаще всего определяют общий привес образца и качественный состав продуктов окисления, а затем перерасчетом устанавливают количество потерянного металла. Объемный метод основан на измерении объема поглощенного кислорода или выделившегося водорода (применяется для электрохимической коррозии). Физические методы применяются для оптического измерения толщины пленок, образовавшихся на поверхности металла. В случае электрохимической коррозии измеряют величины коррозионного тока (или плотности тока) и рассчитывают массу прореагировавшего металла в соответствии с законом Фарадея. На скорость коррозии влияют различные факторы: температура, состав электролита, кислотность среды (рН), присутствие анионов хлора, брома, йода, ускоряющих коррозионные процессы. Температурная зависимость скорости электрохимической коррозии неоднозначна, т.к. с ростом температуры растворимость кислорода снижается, что существенно тормозит процесс коррозии при, температурах, близких к 100 о С. Влияние рН сильно сказывается на коррозионном процессе: для алюминия минимальная скорость коррозии при рН = 7; изменение рН как в большую, так и в меньшую сторону приводят к резкому увеличению скорости коррозии. Иначе ведет себя железо: с ростом рН скорость коррозии уменьшается, а в щелочной среде наступает пассивация.
Существует 10-тибальная шкала коррозионной стойкости металлов:
Коэф. стойкости v(мг/(м 2 ·год)
— абсолютно стойкие 1 10 -3
— хорошо устойчивые 2-3 10 -3 — 10 -2
— относительно стойкие 3-4 10 -2 — 10 -1
— относительно стойкие 8-9 1-10
В практике используются металлы с коэффициентом стойкости 3-4.
Коррозионная стойкость металлов в периодической таблице:
1гр. – устойчивость увеличивается Cu, Ag, Au;
2гр. — нестойкие Be, Ba; более стойкие Zn, Cd, Hg;
3гр. – Al (покрыт прочной оксидной пленкой);
4гр. – химически стойкие Sn, Pb (оксидная пленка).
Металлы 5,6, 7,8 групп в четных рядах обладают высокой способностью к пассивации, и следовательно устойчивы к коррозии: Тi, V, Cr, Co, Mo. Наиболее коррозионно стойкие – это металлы 8 группы, особенно более тяжелые: Оs, Ir, Pt.
Источник