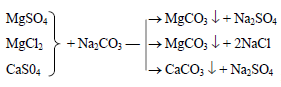Вода — основа жизни и базовое промышленное сырье
Вода является основой жизни и сырьем для огромного количества технологий во всех отраслях промышленности.
Вода — прекрасный растворитель как неорганических, так и многих органических веществ и газов, что объясняется ее сильнополяризованной структурой. Из-за этого в чистом виде она в природе не существует. Все природные воды являются растворами тех или иных веществ, с которыми вода контактировала в процессе круговорота. Эти вещества могут быть полезны или вредны для человеческого организма при использовании воды для питьевых целей или в пищевой промышленности. При использовании воды в промышленности для многих технологических процессов действуют жесткие ограничения по содержанию в ней тех или иных примесей.
Вода содержится в поверхностных или подземных источниках. Подземные воды содержат в основном природные компоненты — продукты растворения пород, с которыми контактировала вода. Состав таких вод относительно стабилен. Воды одного горизонта, отобранные в разных точках, даже отстоящих на большом расстоянии, достаточно близки по составу. При этом воды из находящихся рядом скважин, пробуренных в разные горизонты, могут различаться достаточно сильно. В поверхностных водах наряду с природной составляющей во все большем количестве присутствуют техногенные загрязнения. Поверхностные воды интенсивно загрязняются отходами сельского хозяйства, промышленности, энергетики, городскими стоками и т. п. Состав таких вод зависит от большого количества факторов: времени года, дождей, наличия притоков, режима работы промышленных, сельскохозяйственных и муниципальных предприятий и т. п. Поэтому состав вод по течению реки до и после населенных пунктов может значительно отличаться.
Состав воды по макро- и микрокомпонентам для питьевого или промышленного применения должен удовлетворять определенным нормам, которые рассмотрены ниже. Очистка воды до заданных концентраций по различным загрязнителям осуществляется многочисленными методами, которые были разработаны ранее, совершенствуются и создаются в настоящее время.
Источник
Воздух и вода как сырье химической промышленности
Химическая промышленность использует воздух и воду в огромных количествах и для самых разнообразных целей. Это объясняется комплексом ценных свойств воздуха и воды, их доступностью и удобствами применения.
Воздух в химической промышленности применяют в основном как сырье или как реагент в технологических процессах, а также для энергетических целей.
Технологическое применение воздуха обусловлено химическим составом атмосферного воздуха; сухой, чистый воздух содержит (объемная доля в %): N2 ‑ 78,10; О2 ‑ 20,93; Аr ‑ 0,93; СО2
0,03 и незначительные количества Не, Nе, Кr, Хе, Н2, СН4, О3, NО.
Чаще всего используют кислород воздуха в качестве окислителя: окислительный обжиг сульфидных руд цветных металлов, серосодержащего сырья при получении диоксида серы в сернокислотном, целлюлозно-бумажном производствах; неполное окисление углеводородов при получении спиртов, альдегидов, кислот и др. Кислород, выделяемый ректификацией жидкого воздуха, в больших количествах расходуют для кислородной плавки металлов, в доменном процессе и т. п.; при ректификации получают также азот и инертный газы, в основном аргон.
Азот используют в качестве сырья в производстве синтетического аммиака и других азотсодержащих веществ и как инертный газ. Воздух, применяемый в качестве реагента, подвергается, в зависимости от характера производства, очистке от пыли, влаги и контактных ядов. Для этого воздух пропускают через промывные башни с различными жидкими поглотителями (Н2О, щелочи, этаноламины и др.), мокрые и сухие электрофильтры, аппараты с влагопоглотительными сорбентами и пр.
Энергетическое применение воздуха связано, прежде всего, с использованием кислорода как окислителя для получения тепловой энергии при сжигании различных топлив.
Воздух используется также как хладоагент при охлаждении газов и жидкостей через теплообменные поверхности холодильников или в аппаратах прямого контакта (например, охлаждение воды в градирнях), при грануляции расплавов некоторых соединений (например, аммиачной селитры). В других случаях нагретый воздух используется как теплоноситель для нагрева газов или жидкостей.
В пневматических барботажных смесителях используют сжатый воздух для перемешивания жидкостей и пульпы, в форсунках ‑ для распыления жидкостей в реакторах и топках.
Вода обладает универсальными свойствами, благодаря чему находит в народном хозяйстве разнообразное применение как сырье, в качестве химического реагента, как растворитель, тепло- и хладоноситель.
Например, из воды получают водород различными способами, водяной пар в тепловой и атомной энергетике; вода служит реагентом в производстве минеральных кислот, щелочей и оснований, в производстве органических продуктов ‑ спиртов, уксусного альдегида, фенола и других многочисленных реакциях гидратации и гидролиза. Водяной пар и горячая вода имеют значительные преимущества перед другими теплоносителями ‑ высокую теплоемкость, простоту регулирования температуры в зависимости от давления, высокую термическую стойкость и пр., вследствие чего являются уникальными теплоносителями при высоких температурах. Воду используют также как хладоагент для отвода теплоты в экзотермических реакциях, для охлаждения атомных реакторов, где необходима “сверхдистиллированная” вода.
Природные воды содержат различные примеси минерального и органического происхождения. К минеральным примесям относятся газы N2, О2, СО2, Н2S, NН3, растворенные в воде соли, кислоты и основания находятся в основном в диссоциированном состоянии в виде катионов и анионов. К органическим примесям относятся коллоидные частицы белковых веществ и гуминовых кислот. Состав и количество примесей зависят главным образом от происхождения воды.
По происхождению различают атмосферные, поверхностные и подземные воды.
Атмосферная вода ‑ вода дождевых и снеговых осадков ‑ характеризуется небольшим содержанием примесей. В этой воде содержатся в основном растворенные газы и почти полностью отсутствуют растворенные соли.
Поверхностные воды ‑ воды речных, озерных и морских водоемов ‑ отличаются разнообразным составом примесей ‑ газы, соли, основания, кислоты. Наибольшим содержанием минеральных примесей отличается морская вода (солесодержание более 10 г/кг).
Подземные воды ‑ воды артезианских скважин, колодцев, ключей, гейзеров ‑ характеризуются различным составом растворенных солей, который зависит от состава и структуры почв и горных пород. В подземных водах обычно отсутствуют примеси органического происхождения.
Качество воды определяется ее физическими и химическими характеристиками, такими как прозрачность, цвет, запах, температура, общее солесодержание, жесткость, окисляемость и реакция воды. Эти характеристики показывают наличие или отсутствие тех или иных примесей.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей.
Для большинства производств основным качественным показателем служит жесткость воды, обусловленная присутствием в воде солей кальция и магния. Жесткость выражается в миллиграмм-эквивалентах ионов Са или Мg в 1 кг воды, т. е. за единицу жесткости принимают содержание 20,04 мг/кг ионов кальция или 12,16 мг/кг ионов магния. Различают три вида жесткости: временную, постоянную и общую.
Временная (карбонатная или устранимая) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка (накипи):
Са(НСО3)2 = СаСО3 + Н2О + СО2
2Мg(НСО3)2 = МgСО3 . Мg(ОН)2 + ЗСО2 + Н2О
Постоянная (некарбонатная, неустранимая) жесткость обусловливается содержанием в воде всех других солей кальция и магния, остающихся при кипячении в растворенном состоянии.
Сумма временной и постоянной жесткости называется общей жесткостью. Принята следующая классификация природной воды по значению общей жесткости (h в мг-экв/кг): h 12,0 ‑ очень высокая.
Окисляемость воды характеризуется наличием в воде органических примесей и выражается в миллиграммах кислорода, расходуемого на окисление веществ, содержащихся в 1 кг воды.
Активная реакция воды ‑ ее кислотность или щелочность характеризуется концентрацией водородных ионов. Реакция природных вод близка к нейтральной; рН ‑ водородный показатель, равный (-lg aH+), колеблется в пределах 6,8-7,3.
Производства в зависимости от целевого назначения воды предъявляют строго определенные требования к ее качеству, к содержанию примесей
в ней; допустимые количества примесей регламентируются соответствующими ГОСТами. Природная вода, поступающая в производство, подвергается очистке различными методами в зависимости от характера примесей и требований, предъявляемых к воде данным производством.
В промышленности в целях экономии расхода воды применяют так называемую оборотную воду, т. е. использованную и возвращенную в производственный цикл.
Источник
6.Вода как сырье и компонент химического производства
Природные воды обычно подразделяют на атмосферные, поверхностные и подземные. В зависимости от солесодержания природные воды подразделяют на:
пресную воду – солесодержание до 1г/кг;
солоноватую – 1…10 г/кг;
соленую – более 10 г/кг
Воды различают также по преобладающему в них аниону: гидрокарбонатныйтип воды с преобладающим анионом HCO3или суммой анионов НСО3 – и СО3 2– ;сульфатныеводы;хлоридныеводы. В зависимости от назначения потребляемая вода условно подразделяется напромышленнуюипитьевую
Важнейшими показателями качества водыявляются такие ее физические и химические характеристики, как
-запах -сухой остаток,
-прозрачность — реакция воды
— цвет, — общая щелочность,
-содержание взвешенных веществ — жесткость,
Общее солесодержание (сухой остаток) — масса вещества, остающаяся после испарения воды и высушивания полученного остатка при 105-110°С (мг/л).
Окисляемость воды (мг/л) – количество кислорода, необходимое для окисления примесей, содержащихся в 1 л воды. Обусловлено присутствием органических веществ и быстроокисляющихся соединений железа, сероводорода, нитритов.
Активная реакция воды, т.е. степень ее кислотности или щелочности, количественно характеризуется концентрацией водородных ионов или значением рН.
Общей щелочностью воды(Що) называется суммарная концентрация содержащихся в воде анионов ОН – , НСО3 – ,CO3 2– ,PO4 3– ,HSiO3,SiO3 2– и некоторых солей слабых органических кислот (гуматов), выраженная в (ммоль/л). В зависимости от типа анионов, обусловливающих щелочность, различают гидрокарбонатную щелочность Щгк(НСО3 – ), карбонатную Щк(СО3 2– ), силикатную Щс(SiO3 – ), гидратную Щг(ОН – ), фосфатную ЩФ(Н2РО4 – ,НРО4 2– , РО4 3– ). Общая щелочность Що= Щгк+ Щк+ Щс+ Щг+ Щф.
В природных водах присутствуют только гидрокарбонат–ионы, поэтому для этих вод характерно, чтоЩо = Щгк
Жесткость воды – один из важнейших показателей ее качества. Жесткость природных вод связана с наличием в них солей кальция и магния. Она выражается в ммоль/л или ммоль/кг ионов Са 2+ или Mg 2+ . Различают три вида жесткости:
временная(карбонатная или устранимая)
постоянная(некарбонатная) наличие Сl — , NO3 — , SO4 2- , SiO3 2- , PO4 3-
и общая − сумма временной и постоянной жесткости Жо = Жв + Жп
По общей жесткости (ммоль/л) природные воды подразделяют на мягкую(Жо 10).
Схемы водооборота
←Цикл с охлаждением оборотной воды
Цикл с очисткой оборотной воды→
1 –цех, 2- насосная станция,
3-градирня, 4- очистные сооружения,
5-камера для пополнения потерь воды
←Цикл с очисткой и охлаждением оборотной воды
Гради́рниУстройство для охлаждения большого количества воды направленным потоком атмосферного воздуха. Иногда градирни называют такжеохладительными башнями
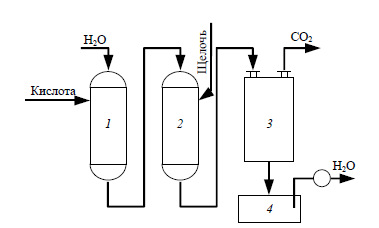
Промышленная водоподготовка
Умягчением воды называется ее очистка от соединений кальция и магния, обусловливающих жесткость воды.
Физические методы(термический, дистилляция, вымораживание);
Химические (известково-содовый, содо-натровый, фосфатный);
Физико-химические (электродиализ, электроосмос, электрокоагуляция и ионнообмен)
2. Реагентный метод
1) Известковый метод(обработка гашеной известью для устранения временной жесткости, удаления ионов железа и связывания СО2)
2) Содо-натровый метод (для устранения постоянной жесткости:
3) Фосфатный метод (используют для доумягчения воды до полного осажде-ния катионов Са 2+ и Mg 2+ ) Т ›100ºС
Ионообменный способ основан на способности ионитов (труднорастворимые твердые вещества) обменивать свои ионы на ионы солей, растворенных в воде
Иониты подразделяются на:1) катиониты (Na+, H+) (алюмосиликаты: пермутит, цеолит, полимерные вещества)
2) аниониты (OH-)(искусственные смолы) Катиониты соответственно называются Na-катионитами и Н-катионитами.
Источник