Роль воды в химических процессах
В презентации отражены физические свойства воды; дана классификация веществ по растворимости в воде; определения водных растворов и электролитов. Представлены основные положения теории электролитической диссоциации ( ТЭД ). Даны определения кислот, оснований и солей с позиции ТЭД Показана роль воды как транспортного средства и как участника химических реакций
Скачать:
| Вложение | Размер |
|---|---|
| rol_vody_v_khimicheskikh_protsessakh.pptx | 1.27 МБ |
Предварительный просмотр:
Подписи к слайдам:
Выполнила ученица 11 класса Голикова Ольга Презентация по химии на тему: Роль воды в химических реакциях
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Систематическое наименование : оксид водорода Традиционные названия : вода Химическая формула : Н 2 O Молярная масса : 18,01528 г/моль
Вода – это жидкость без цвета, запаха и вкуса, t кип = 100 °C, t пл = 0 °C, p= 1г/см 3 (при 4 °С). Вода не проводит электрический ток, плохо проводит тепло, удельная теплоемкость воды очень высокая. Вода — единственное вещество, которое при затвердении сжимается. Поэтому плотность льда меньше плотности жидкой воды. Вот почему лёд плавает на поверхности воды. Вода
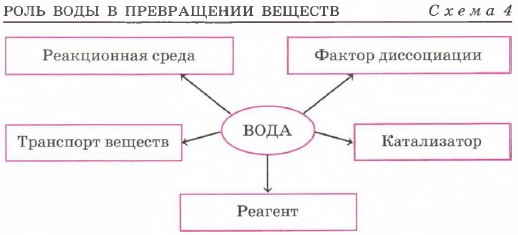
Вода – уникальное химическое вещество, роль которого в химических реакциях трудно переоценить вода Реакционная среда Фактор диссоциации Транспорт веществ реагент катализатор
Огромное число химических реакций протекает в водной среде. По растворимости в воде все вещества условно делятся на три группы Растворимость веществ в воде
Это гомогенные системы, состоящие из молекул воды, частиц растворенного вещества и продуктов их взаимодействия Процесс гидратации – результат взаимодействия воды с молекулами растворяемого вещества Водные растворы —
Вещества, которые в растворах распадаются на ионы – диссоциируют . Отношение числа молей вещества, распавшегося на ионы, к общему количеству растворенного вещества называют степенью электролитической диссоциации Все электролиты подразделяют на: — сильные ( степень диссоциации стремится к единицы) — слабые (в растворах диссоциируют очень незначительно ) Электролиты
Сванте Август Аррениус (1859-1927) Шведский химик и физик. В 1887 окончательно сформулировал теорию электролитической диссоциации, в 1887 объяснил отступление растворов электролитов от законов Вант-Гоффа и закон Рауля (показал физический смысл поправочного коэффициента i). Создал учение об изогидричности , разработал теорию гидролиза солей. Установил экзотермический характер большинства процессов диссоциации электролитов и зависимость скорости и полноты протекания этих процессов от температуры. Теория электролитической диссоциации
Кислоты – это электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка; Основания – это электролиты, диссоциирующие на катионы металла (аммония или органического основания) и гидроксид-анионы Соли – это электролиты, диссоциирующие на катионы металла (аммония или органического основания) и анионы кислотного остатка Три типа электролитов
Все жидкие среды более чем на 90-98 % состоят из воды; Кровь разносит по организму кислород, питательные вещества, гормоны и другие соединения, удаляя при этом углекислый газ и продукты распада Роль воды как транспортного средства
Реакция гидратации (реакция присоединения) реакция гидратации ацетиленовых соединений с образованием карбонильных соединений. При гидратации ацетилена образуется ацетальдегид, в случае замещенных ацетиленов — главным образом кетоны Вода как участник химических реакций
Является источником получения чистых водорода и кислорода. Взаимодействие водорода и кислорода служит той реакцией, которая позволяет выводить на орбиту космические корабли Вода участвует в процессах электролиза
Источник
§ 17. Роль воды в химических реакциях
Если взглянуть на нашу планету из космоса (рис. 108), то мы увидим, что большая часть поверхности Земли покрыта водой.
Вода — уникальное химическое вещество, роль которого в химических реакциях трудно переоценить. Схема 4 не полностью отражает многогранность роли, которую вода играет в превращениях веществ.
Как и все вещества, вода подчиняется строгой логической линии «состав — строение — свойства». (Вспомните состав и строение молекул воды, роль межмолекулярных водородных связей при ассоциации их в жидкую и твёрдую воду.)
Огромное число химических реакций протекает в водной среде. По растворимости в воде все вещества условно делят на три группы:
- растворимые (в 100 г воды растворяется более 1 г вещества: гидроксиды щелочных металлов, почти все нитраты, все моносахариды, низшие спирты и карбоновые кислоты и др.);
- малорастворимые (в 100 г воды растворяется от 0,01 до 1 г вещества: гидроксид кальция, фториды бария и алюминия, сульфаты серебра и свинца, анилин и фенол при комнатной температуре и др.);
- практически нерастворимые (в 100 г воды растворяется менее 0,01 г вещества: почти все фосфаты и карбонаты, кроме солей щелочных металлов и аммония, все углеводороды, высшие спирты, альдегиды и карбоновые кислоты и др.).
Практическим пособием для определения растворимости веществ в воде является таблица растворимости гидроксидов и солей в воде.
Растворение — это не просто физический процесс — результат диффузии. При растворении веществ в воде происходит их химическое взаимодействие с ней — гидратация. Результатом такого взаимодействия является образование растворов. Именно этой точки зрения на растворение придерживался и отстаивал её великий русский химик Д. И. Менделеев.
Почему в определении растворов мы так осторожно подчеркнули: «. частиц вещества и продуктов их взаимодействия»? Как вы помните из § 11 «Дисперсные системы», истинные растворы делят на молекулярные, ионные и ионно-молекулярные. Ведь даже в молекулярных растворах веществ содержатся уже совсем не те молекулы, из которых было построено исходное вещество, например молекулы спиртов. Эти молекулы окружены оболочкой из молекул воды. Такие молекулы называют гидратированными. Они представляют собой результат взаимодействия воды с молекулами растворяемого вещества — процесса гидратации.
Косвенным доказательством гидратации как химического процесса является существование твёрдых кристаллогидратов, например солей, в состав которых входит вода. Её в этом случае называют кристаллизационной. Наиболее известными кристаллогидратами являются медный купорос CuSO4 • 5Н2O, гипс CaSO4 • 2Н2O и кристаллическая сода Na2CO3 • 10Н2O.
Если для молекулярных растворов всё только этим и заканчивается, то для растворов электролитов следует продолжение. Напомним:
Электролиты диссоциируют по-разному — одни хорошо, другие не очень. Эту способность электролита к диссоциации характеризует величина, называемая степенью электролитической диссоциации.
Источник
Роль воды в химических реакциях. Строение молекулы воды. Физические и химические свойства



Вода- уникальное химическое вещество, роль которого в химическихреакциях трудно переоценить.
По отношению к воде как растворителю все вещества условно делят на следующие группы:
— растворимые (в 100г воды растворяется более 1г вещества);
— малорастворимые ( в 100 г воды растворяется от 0,01 до 1г вещества)
— практические нерастворимые (в 100г воды растворяется менее 0,01 г вещества).
Растворение – это не просто физический процесс – результат диффузии. При растворении веществ в воде происходит их химическое взаимодействие с ней – гидратация. Результатом такого взаимодействия является образование растворов.
Водные растворы – это гомогенные системы, состоящие из молекул воды, частиц растворенного вещества и продуктов их взаимодействия.
Молекулы окруженные оболочкой из молекул воды называют гидратированными. Это результат процесса гидратации – взаимодействия воды с молекулами растворяемого вещества.
Косвенным доказательством гидратации как химического процесса является существование твердых кристаллогидратов. Наиболее известными кристаллогидратами являются медный купорос, гипс и кристаллическая сода.
Значительна роль воды для транспортировки вещества в сферу реакции.
Не менее значима роль воды как участника химических реакций, как реагента.
Взаимодействие ацетилена с водой было известно до М.Г. Кучерова:
С водой при обычных условиях энергично реагируют щелочные и щелочноземельные металлы, При этом образуется щелочь и водород:
Источник
Роль воды в химической реакции
Вода играет огромную роль на планете. Входит в состав многих веществ, большую роль играет как растворитель, т.к. в большинстве своѐм вещества растворяются в ней.
Химические свойства Н2О:
Вода – очень активный реагент по следующим причинам:
а) за счет ориентационного взаимодействия с полярными молекулами других веществ;
б) установления водородных связей;
в) проявления донорных свойств со стороны атома кислорода по отношению к частицам – акцепторам электронных пар;
г) электролитической диссоциации при обычных условиях (ионы Н + гидратируются, образуя ионы Н3О + ).
1. При температуре выше 1000°С диссоциация водяного пара, но равновесие сдвинуто в сторону воды.
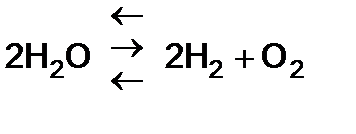
2. Оксиды металлов и неметаллов соединяются с водой, образуя основания и кислоты (гидрооксиды).
3. Некоторые соли образуют с водой кристаллогидраты. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения, т.е. за счет ион -дипольного взаимодействия.
Например: кристаллогидрат сульфата натрия Na2SO4×10H2O (глауберова соль), Na2CO3×10H2O — кристаллическая сода.
Гидраты, образующиеся в результате донорно-акцепторного взаимодействия (где ионы растворенного вещества выступают обычно в качестве акцепторов, а молекулы растворителя в качестве доноров электронных пар) представляют собой частный случай комплексных соединений.
Аквакомплексы– лигaндами является вода, [Co(H2O)6]Cl2, [Al(H2O)6]Cl3, [Cr(H2O)6]Cl3 и др. Некоторые аквакомлексы в кристаллическом состоянии удерживают кристаллизационную воду [Cu(H2O)4]SO4×H2O – медный купорос.
Виды растворов. Истинные растворы. Классификация веществ по их растворимости в воде.
Раствор-это однородная смесь веществ, состоящая из нескольких компонентов.
Различаютистинные, коллоидные растворы и суспензии.
Истинные растворы характеризуются прозрачностью, имеют малые размеры растворённых частиц, легко проходят через биологические мембраны. В зависимости от концентрации солей существует три типа растворов: изотонические; гипертонические; гипотонические.
И з о т о н и ч е с к и ер а с т в о р ыимеют одинаковую концентрацию солей, как и в плазме крови, и такое же осмотическое давление.
К ним относят растворы, имеющие концентрацию солей 0,9%.
Одним из таких растворов является физиологический раствор — это раствор хлорида натрия — NaCl 0,9%. В таком растворе в клетку и из клетки молекулы воды будут перемещаться в равном количестве в обе стороны.
Применение физиологического раствора.
Вводят физраствор через рот, внутривенно, внутримышечно, подкожно, в прямую кишку:
· при некоторых заболеваниях – тяжелые длительные поносы, холера, неукротимая рвота, обширные ожоги хлорид натрия выделяется из организма в больших количествах, чем обычно. Также его много теряется с потом при работе в горячих цехах. В таких случаях в организме возникает его недостаточность, что сопровождается развитием ряда болезненных явлений: спазмы, судороги, нарушения кровообращения, угнетение ЦНС;
· при интоксикациях, кровопотерях, обезвоживании, высокой температуре для промывания глаз, носовой полости.
· натрий хлористый является составной частью растворов применяющихся в качестве кровозамещающих (плазмозамещающих) жидкостей.
Г и п е р т о н и ч е с к и й р а с т в о р(2%, 5%, 10%, 15%) — это раствор в котором концентрация солей выше, чем в плазме крови.
К ним относятся растворы, содержащие более 0,9% солей. Если клетку поместить в такой раствор, то вода из клетки поступает в окружающую среду, при этом падает в клетке тургорное (осмотическое) давление, содержимое клетки сжимается, она теряет форму, происходит обезвоживание. Это явление называется – плазмолиз.Явление плазмолиза обратимое, если поместить клетку в гипотонический раствор, то в таком растворе она восстановит объем и форму Н2 0 клетка.
Применяют гипертонический раствор для:
· полосканий горла, для ванн, обтираний;
· назначают при запорах для опорожнения кишечника.
· в виде компрессов и примочек применяются при лечении гнойных ран, раны очищаются от гноя;
· 2 – 5% растворы используют для промывания желудка при отравлении нитратом серебра;
· внутривенно используют при отёке лёгких и внутренних кровотечениях.
Г и п о т о н и ч е с к и й р а с т в о р- это раствор, имеющий меньшую концентрацию солей, чем в плазме крови. К ним относят дистиллированную воду, талую воду ледников. Если клетку поместить в гипотонический раствор, то в нее из раствора будет поступать вода, осмотическое давление возрастает, клетка набухает. Это явление получило название – деплазмолиз.
Применяют гипотонические растворы в качестве растворителей для водорастворимых лекарственных препаратов. Путём пиноцитоза в клетки поступают питательные вещества из кровяного русла, гормоны, ферменты, лекарственные вещества.
Суспензии, или взвеси, — мутные жидкости, частицы которых размером более 0,2 мкм. При отстаивании взвешенные частицы оседают.
Коллоидные растворы.Если частицы имеют промежуточные размеры от 0,1 до 0,001 мкм, т. е. слишком велики, чтобы образовать истинный раствор, но и слишком малы, чтобы выпасть в осадок, возникает коллоидный раствор (греч. со11а— клей).
По агрегатному состоянию растворы делятся натвердые, жидкие и газообразные. Твердые – сплавы металлов, газообразные – воздух.
Любой раствор, особенно жидкий, как правило, состоит из двух компонентов.
Классификация веществ по их растворимости в воде:
- Хорошо растворимые — если при комнатной температуре в 100 г воды растворяется больше 1 г этого вещества.
- Малорастворимые – если при таких условиях растворяется меньше 1 г вещества в 100 г воды.
- Практически нерастворимые вещества – такие вещества, растворимость которых меньше 0,01 г в 100 г воды.
Виды растворов:
Насыщенный раствор — в котором при данной температуре вещество больше не растворяется.
Ненасыщенный раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
Пересыщенный раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Растворение — это химический процесс-взаимодействие молекул растворителя с частицами растворенного вещества.
3.Факторы, от которых зависит растворимость веществ в воде:
1.Природа реагирующих веществ. Полярные молекулы веществ способны растворяться в полярном растворителе – воде.
2. При увеличении температуры жидкости и твердые вещества растворяются лучше, а газы – хуже.
3. При увеличении давления, объем уменьшается и молекул чаще сталкиваться друг с другом, поэтому растворение увеличивается.
4.Значение водныхрастворов для организма человека:
Все вещества поступают в клетки в растворенном виде и выводятся яды из клеток так же в виде растворов.
Вода является участников большинства химических реакций, протекающих в нашем организме. Наш организм на 70% состоит из воды. Содержание растворенного вещества в растворе называют концентрацией.
Способы выражения концентрации растворов: массовая доля растворенного вещества: w(раств.в-ва) = m(вещества) m(раствора) х100%.
Дата добавления: 2018-02-28 ; просмотров: 3306 ; Мы поможем в написании вашей работы!
Источник