- 18. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обусловливающие ее уникальную роль как единственного биорастворителя.Автопротолиз воды. Константа автопротолиза воды.
- 2.3. Автопротолиз воды
- Вода как растворитель. Значение растворов в жизнедеятельности организмов
- ВОДА КАК РАСТВОРИТЕЛЬ И ЕЕ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМА
18. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обусловливающие ее уникальную роль как единственного биорастворителя.Автопротолиз воды. Константа автопротолиза воды.
Организм человека на 60% состоит из воды, из них 42 приходится на внутриклеточную жидкость, а остальная часть на внеклеточную.
Вода – компонент высокоорганизованных процессов, универсальный растворитель.
1) высокое поверхностное натяжение(σ = 7,6 10 -3 Н \ м)
2) низкая вязкость
3) обладает большой теплотой испарения
4) высокая теплоемкость
5) высокий дипольный момент, связан со строением воды.
На двух гибридных орбиталях находятся по 2 неподеленных пары электронов, что обуславливает сильный отрицательный заряд, электронная плотность водорода смещается к кислороду, что обеспечивает положительный заряд на атоме водорода.
имеет аномально высокие температуры кипения и плавления – способность образовывать водородные связи.
Высокая диэлектрическая проницаемость (ξ = 78,8)
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы (F,O,N,Cl,S).
Водородная связь широко распространена и играет важную роль при ассоциации молекул и в процессе диссоциации
Энергия водородной связи = 20 – 25 кДж \ моль
Наряду с межмолекулярной водородной связью существует внутримолекулярная водородная связь.
Именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей.
Водородная связь определяет вторичную и третичную структуру белков, а также устройство двойной спирали ДНК.
2.3. Автопротолиз воды
Все растворители условно можно разделить на две большие группы: апро-тонные и протолиты (или протонные растворители). Первые не обладают кислотно-основными свойствами (углеводороды, бензол, CS2, СС14 и др.), а вторые (Н О, С2Н5ОН, СН3СООН, HF, NH3, H2S04 и др.) — участники реакций протолиза.
Н20 — основной растворитель в биологических системах, является амфолитом, способным самопроизвольно подвергаться слабой электролитической диссоциации или реакции автопротолиза:
кис. осн. сопр. осн. сопр. кис.
Константа этого протолитического равновесия в соответствии с законом действующих масс равна:
Кс = [ОН-]-[Н30 + ]/[Н20] 2 . Равновесная концентрация растворителя [Н20] практически является величиной постоянной, т. к. концентрация молекул Н20, распавшихся на ионы, по сравнению с концентрацией недиссоциированных молекул, как правило, очень мала. Поэтому две константы Кс и [Н20] объединяют в одну константу Ks = Кс • [Н20] 2 , отсюда Ks = [ОН» ] • [Н30 + ]. Индекс «s» — первая буква английского слова solvent — растворитель, дляводы принят индекс «в» — вода.
Величину Ksназывают ионным произведением растворителя или константой автопротолиза растворителя.
Для воды = Ks = [ОН-] • [Н30 + ] = 1 • Ю- 14 при t = 25°С. Автопротолиз воды процесс эндотермический.
Н20 + Н20 Ц ОН» + Н30 + ; DH = 55,9 кДж/моль
кис. осн. сопр. осн. сопр. кис.
В обычных условиях (t=25°) Кв = 1 • Ю -14 (моль/л) 2 , а т. к. в чистой воде [ОН — ] = [Н30 + ], то концентрация каждого из ионов при 25°С будет равна:
(Кв) 1/2 = (10- 14 ) 1/2 = Ю- 7 моль/л
Следовательно, в чистой воде, где [ОН» ] = [Н30 + ] = 1*10″ 7 моль/л, среда будет нейтральной. Исходя из этого ясно, что при:
6 . 10″ 1 моль, среда будет кислой.
8 . 10″ 14 моль, среда будет щелочной. Так как отрицательные степенные выражения неудобны в количественных расчетах, их заменяют логарифмическими функциями, которые называются показателями, таким образом:
рН — водородный показатель, это отрицательный десятичный логарифм концентрации ионов водорода:
рОН — гидроксильный показатель, отрицательный десятичный логарифм концентрации гидроксид-ионов:
PH=-lg[OH-], рК^ — показатель ионного произведения воды.
Для чистой воды: рК^рН + рОН = 14 или рН = рОН =7 — среда нейтральная.
В кислых растворах: [Н30 + ] > Ю -7 ; рН + ] -7 ; рН > 7- среда щелочна
Автопротолиз воды – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого вещества за счет передачи протона от одной молекулы к другой.
Понятие автопротолиза вытекает из протонной теории кислот и оснований Бренстеда-Лоури.
Также легко проходит и обратный процесс:
Н3О + +ОН — =2 Н2О или упрощенно
Константа данного равновесия при 22 градусах равна:
Источник
Вода как растворитель. Значение растворов в жизнедеятельности организмов



Самым распространенным растворителем на нашей планете является вода. У животных и растительных организмов содержание воды составляет обычно более 50%, а в ряде случаев достигает 90-95%.
Вода хорошо растворяет многие ионные и полярные соединения. Такое свойство воды связано с ее высокой диэлектрической проницаемостью (e= 78,5). В результате многие ионные соединения диссоциируют и отличаются высокой растворимостью в воде. Другой класс веществ, хорошо растворимых в воде, составляют полярные органические соединения (спирты, альдегиды, кетоны). Их растворимость обусловлена образованием водородных связей с молекулами воды.
Важны и другие аномальные свойства воды: высокое поверхностное натяжение, низкая вязкость, высокие температуры плавления и кипения, более высокая плотность в жидком состоянии, чем в твердом.
Вследствие высокой полярности вода вызывает гидролиз веществ (эфиров, амидов и др.). Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Биохимические процессы в живых организмах протекает в водных растворах.
В жидких средах организма поддерживается постоянство рН, концентрации солей и органических веществ, постоянство осмотического давления. Такое постоянство называется гомеостазом. Приведенные примеры показывают, что учение о растворах представляет особый интерес для медиков.
Источник
ВОДА КАК РАСТВОРИТЕЛЬ И ЕЕ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМА
Организм человека на 60 % состоит из воды, из них 42 % приходится на внутриклеточную жидкость, а остальная часть на внеклеточную (межклеточную) жидкость, которую подразделяют на внутрисосудистую и интерстициальную (межтканевую) жидкость.
Вода — это не только среда, но также активный участник процессов жизнедеятельности. Если организм человека теряет 20 % воды, то в клетках происходят необратимые изменения и человек погибает. Потребность в воде взрослого человека составляет 35 г в день на 1 кг массы тела, а грудного ребенка — в 3-4 раза больше.
Большая роль воды в живой природе связана с рядом уникальных ее свойств, благодаря которым вода является средой, растворителем и метаболитом для живых организмов. Вследствие высокой теплоемкости (75,3 Дж/(моль • К)) и большой теплоты испарения (40,8 кДж/моль) вода обеспечивает термостатирование нашего организма. Высокая диэлектрическая проницаемость воды (s = 78,5) способствует растворению солей, кислот, оснований и их диссоциации на ионы, так как сила электростатического взаимодействия между ионами обратно пропорциональна диэлектрической проницаемости среды. Ионное состояние веществ в водной среде обуславливает высокие скорости протекания биохимических реакций, быструю миграцию ионов через биологические мембраны и практически мгновенную передачу нервных импульсов.
Высокий дипольный момент молекулы воды (1,82 Д) и способность образовывать четыре водородные связи: две — как донор протонов и две — как акцептор протонов, не только увеличивают растворяющую способность воды по отношению к полярным веществам, но и благоприятствуют формированию определенных структур водных
 |
ассоциатов в самой воде, а также у молекул биополимеров в водных растворах. Перечисленные особенности воды и ее низкая вязкость (0,001 Па • с при 293 К) способствуют выполнению ею транспортных функций, а также возникновению жидкокристаллического состояния у водных растворов некоторых биосубстратов.
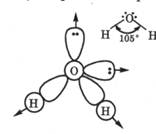
Геометрически молекула воды представляет собой угловую систему, в центре которой находится атом кислорода с sр 3 -гибри-дизацией валентных атомных орбиталей (разд. 2.1.3). При этом в двух вершинах тетраэдра находятся атомы водорода, а к двум
другим направлены атомные орбитали атома кислорода с неподеленными электронными парами. За счет двух атомов водорода, несущих частично положительный заряд, и двух неподеленных электронных пар атома кислорода каждая молекула воды может образовывать четыре водородные связи с соседними молекулами воды. Именно такая меж молекулярная система реализуется в замерзшей воде, т. е. у льда (рис. 6.1, а).
Лед имеет тетраэдрическую кристаллическую решетку, где атом кислорода одной молекулы воды расположен в центре тетраэдра, а в четырех его вершинах находятся атомы кислорода соседних молекул, которые соединены водородными связями с центральной молекулой и молекулами ближайших тетраэдров. Подобная структура энергетически выгодна при условиях близких к нормальным, и поэтому она устойчива при этих условиях. Ажурность и наличие внутренних пустот определяют рыхлость и меньшую плотность льда (0,92 г/см 3 ) по сравнению с жидкой водой.
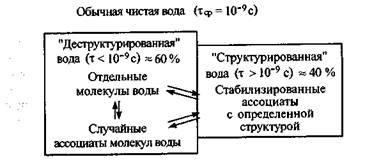
При плавлении льда частично рвутся водородные связи и появляются: ассоциаты, в которых сохраняется каркасная структура за счет водородных связей, полости между ассоциатами и внутри них, а также отдельные молекулы воды (рис. 6.1, б). В чистой жидкой воде имеется динамическое равновесие как между ассоциатами, так и между ассоциатами и свободными молекулами воды, блуждающими в полостях между ассоциатами или внутри них. Среднее время жизни молекул воды в этих образованиях тср=10 -9 с. С повышением температуры параллельно происходят два процесса: первый связан с увеличением размеров полостей и уменьшением размеров ассоциатов, что приводит к уменьшению плотности системы; второй — с увеличением степени заполнения полостей отдельными молекулами воды, за счет чего плотность системы увеличивается. В интервале температур от 0 °С до 4 °С преобладает второй процесс, и поэтому плотность воды максимальна при 4 °С (1,000 г/см 3 ), а при температуре выше 4 °С доминирует первый процесс и плотность воды уменьшается, так как происходит разрыхление структуры воды. Однако ассоциаты с трехмерной сеткой водородных связей сохраняются в жидкой воде при любой температуре.
 |
В стандартных условиях, согласно статистическим расчетам, около 30 % всех молекул воды находятся в виде отдельных молекул, а 70 % входит в состав ассоциатов. Среди них 40 % приходится на стабилизированные ассоциаты с определенной структурой, т. е. на «структурированную» воду, а 30 % — на случайные ассоциаты, которые не имеют определенной структуры. Совокупность случайных ассоциатов и отдельных молекул воды составляют «деструктурированную» воду (всего 60 %). В «структурированной» воде время жизни молекул воды в ассоциатах больше (т > тср = 10 -9 с), чем среднее время их жизни в воде в целом. В «деструктурированной» воде этот показатель, наоборот, меньше (т + и ОН-, возникающих за счет диссоциации воды, или радикалов, образующихся при радиационном воздействии на воду. В стандартных
Рис. 6.2. Состояние молекул воды в чистой воде
условиях одной из энергетически выгодных структур для ассоциатов чистой воды является льдоподобная структура. При условиях, отличающихся от стандартных, или при воздействии какого-либо поля возможно возникновение энергетически выгодных ассоциатов с другой структурой. Подобное происходит в воде, например, после ее обработки при сверхкритических температуре и давлении или при мощном импульсном электрическом разряде в объеме жидкости и некоторых других методах обработки воды.
Увеличению структурных единиц воды способствуют:
— расплавление льда (талая вода) с последующим поддержанием низкой температуры (ниже 10 °С);
— длительный контакт с поверхностью нерастворимых в воде минералов: апатита, кальцита, кварца, кремнезема, кремня, шунгита, глины и некоторых других, приводящий к образованию родниковой воды;
— растворение в воде веществ, для ионов или молекул которых характерна положительная гидратация (см. дальше);
— воздействие вибрации и различных полей: акустического, магнитного, электрического, обладающих определенными характеристиками;
— воздействие сверхкритических температуры и давления.
Вода с повышенным содержанием «структурированной» воды, имеющей льдоподобную структуру, для живых организмов полезна и поэтому часто называется «живой» водой. Это можно объяснить тем, что такая вода лучше усваивается организмами, поскольку без существенной перестройки используется для гидратации тканей, белков и других биосубстратов.
Наличие в воде различных ассоциатов, имеющих разную структуру и разное время жизни, позволяет обосновать еще одну особенность воды — структурно-информационную память. По мнению автора, эта особенность воды часто лежит в основе не всегда понятных изменений ее физико-химических свойств, биологических и физиологических функций при воздействии астро-гелиогеофизических факторов или после обработки экстрасенсами, а также действия гомеопатических средств. Способность перехода в различные структурно-информационные состояния присуща не только чистой воде, но и ее растворам и водным системам живых организмов.
Вода — уникальный растворитель, что объясняется следующими ее особенностями:
— высокой диэлектрической проницаемостью (е = 78,5);
— способностью проявлять протонодонорные и протоноакцепторные свойства, так как вода — амфолит;
— способностью проявлять электронодонорные и электроноакцепторные свойства;
— наличием внутренних пустот в жидкой воде из-за ажурности ее структуры.
В соответствии с принципом «подобное в подобном» в воде хорошо растворяются вещества, молекулы которых содержат ионные связи или полярные функциональные группы и поэтому хорошо сольватируются водой. В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные («любящие воду») и гидрофобные («боящиеся воды»). К гидрофильным относятся ионы и полярные группы: гидроксильная —ОН, амино —NH2, карбоксильная —СООН, нитро —NO2, фосфатная —ОРО(ОН)2, сульфо —SO3H. К гидрофобным относятся неполярные группы: углеводородные радикалы предельных (—CnH2n+1), непредельных (—CnH2n-1) и ароматических (—С6Н5) соединений. Гидрофобные свойства характерны также для веществ, молекулы которых неполярны: О2, N2, СО2, CI2, СH4 и так далее. Если молекулы вещества содержат и гидрофильный и гидрофобный фрагменты, то их называют дифильными, а соответствующие вещества — дифильными соединениями (например, мыло, фосфолипиды, белки). Дифильные молекулы принято изображать в виде «головастика», у которого головка соответствует полярному, а хвост — гидрофобному фрагменту молекулы.
При растворении в воде соединений с ионной связью происходит их диссоциация, а образующиеся ионы окружаются гидратной оболочкой, содержащей плотный и рыхлый слои «связанной» воды. В плотном гидратном слое молекулы воды в значительной степени поляризованы и удерживаются сильным иондипольным взаимодействием, а их пространственная структура определяется свойствами иона (катиона или аниона). Между плотным гидратным слоем и «свободной» водой, не участвующей в гидратации ионов, находится рыхлый «деструктурированный» слой гидратной оболочки, состоящий в основном из одиночных молекул воды и мелких ассоциатов. Подвижность молекул воды в рыхлом слое больше, чем в «свободной» воде. Рыхлый слой гидратной оболочки обеспечивает сродство между «свободной» водой и плотным слоем вокруг иона, имеющим специфическую структуру в зависимости от природы иона. Толщина плотного и рыхлого слоев, а также среднее время жизни молекул воды в гидратной оболочке зависят от природы иона электролита (рис. 6.3), его концентрации и температуры.
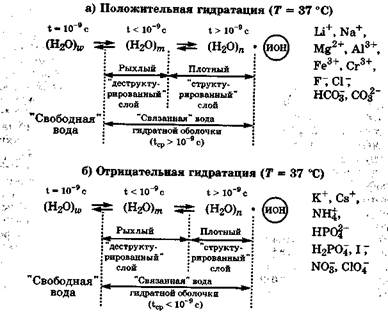 |
В зависимости от средней продолжительности жизни молекул воды в гидратной оболочке иона различают положительную и отрицательную гидратацию (О. Я. Самойлов, 1957). Ионы, имеющие высокую поверхностную плотность заряда, т. е. ионы с большим зарядом и малым радиусом, такие как Li + , Na+, Mg 2+ , Al 3+ , Fe 3+ , Cr 3+ , F-, CI-, CO3 2- , HC03— которые прочно связывают молекулы воды в гидратной оболочке, характеризуются положительной гидратацией. В этих случаях среднее время жизни молекул воды в гидратной оболочке иона больше, чем в «свободной» воде, не участвующей в гидратации. Ионы с положительной гидратацией способствуют увеличению в растворе содержания «структурированной» воды. Вероятно, поэтому катионы Na + и анионы Сl- в основном сосредоточены в межклеточной жидкости.
Рис. 6.3. Схема двухслойной гидратной оболочки иона
Для многозарядных катионов А1 3+ , Ре 3+ , Сг 3+ , которые наиболее сильно удерживают молекулы воды, время жизни молекул воды в гидратном слое достигает секунд, минут и даже часов. Это объясняется переходом ион-дипольного взаимодействия данных ионов с ближайшими молекулами воды в ковалентную связь между ними с возникновением комплексных катионов [А1(Н20)6] 3+ , [Fe(H20)e] 3+ , [Cr(H20)6] 3+ , устойчивость которых значительно выше, чем устойчивость любых ассоциатов воды.
 |
Ионы с малой поверхностной плотностью заряда: К + , Cs + , NН4+, I-, Br-, НРO4-, Н2РO4-, NO3-, СO4 — и поэтому слабо притягивающие молекулы воды, имеют в гидратной оболочке тонкий плотный «структурированный» слой и толстый рыхлый «деструктурированный» слой (рис. 6.3) и характеризуются отрицательной гидратацией (тср -9 с). Ионы с отрицательной гидратацией способствуют уменьшению в растворе содержания «структурированной» воды. Вероятно, поэтому ионы К + , HP042-, Н2Р04 являются ионами внутриклеточной жидкости, способствуя увеличению содержания в ней «деструктурированной» воды.
Рис 6.4. Различия в структуре гидратных оболочек катиона (а) и шпона (б)
При концентрации ионов в водном растворе более 1 моль/л гидратные оболочки ионов взаимно перекрываются, и в таких растворах «свободной» воды уже практически нет. При наличии в водных растворах электролитов молекул полиэлектролитов: белков, нуклеиновых кислот или растворимых органических соединений «свободная» вода исчезает из них при значительно меньших концентрациях веществ в растворе.
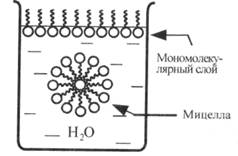
Рассмотрим различия в структуре гидратных оболочек катионов и анионов.
К катиону молекулы воды сориентированы неподеленной электронной парой атома кислорода, а атомы водорода направлены наружу (рис. 6.4). Аналогичным образом ориентированы и соседние молекулы воды гидратной оболочки катионов. В отличие от катиона, к аниону молекулы воды гидратной оболочки ориентированы одним атомом водорода, несущим частичный положительный заряд, обеспечивающий возникновение различных видов межмолекулярного взаимодействия. Другой атом водорода и неподеленные электронные пары направлены в толщу гидратной оболочки, что способствует связыванию ближайших молекул воды не только электростатически, но и за счет водородных связей (рис. 6.4).
 |
При растворении в воде веществ, молекулы которых полярны и содержат небольшие гидрофобные группы, например С2Н5ОН, NH(CH3)2, С6Н5СООН, вокруг их молекул, за счет водородных связей между полярными группами и молекулами воды, образуется гидратная оболочка, охватывающая всю молекулу в целом и содержащая плотный и рыхлый слои. При этом гидрофобные группы вещества, стремясь уменьшить свой контакт с молекулами воды за счет гидрофобного отталкивания, вызывают колебания гидратной оболочки, способствуя тем самым увеличению структурированности в ней молекул воды. Это приводит к формированию в гидратной оболочке стабилизированной (льдоподобной) структуры и увеличивает время «оседлой» жизни молекул воды в ней до 10 7 с, т. е. для молекул органических соединений характерна положительная гидратация. С увеличением концентрации раствора органического вещества толщина рыхлого слоя их гидратных оболочек вокруг молекул значительно уменьшается, что может ограничить растворимость этих веществ в воде.
При растворении в воде дифильных веществ, молекулы которых кроме полярной группы содержат большие гидрофобные группы, например стеарат натрия С17H35СОONa (мыло) или фосфолипиды, вокруг них не может образоваться единая гидратная оболочка и поэтому происходит такая взаимная ориентация их молекул, которая исключает контакт гидрофобного фрагмента с молекулами воды. В случае очень низких концентраций таких веществ в растворе это достигается прежде всего за счет сосредоточения и определенной ориентации дифильных молекул только в поверхностном слое раствора, где образуется из них мономолекулярный слой, в котором гидрофобные фрагменты выступают над поверхностью воды, а полярные группы находятся в воде (рис. 6.5).
В случае больших концентраций дифильных веществ в водном растворе из их молекул образуются ассоциаты, называемые мицеллами (рис. 6.5), в которых гидрофобные фрагменты спрятаны внутрь. Полярная оболочка мицелл эффективно гидратируется, что способствует стабилизации этих частиц в коллоидных растворах (разд. 27.3.1).
Гидратация молекул белков в растворе сопровождается структурированием белковой цепи, в результате чего гидрофобные фрагменты этой цепи, взаимодействуя друг с другом, образуют гидрофобное ядро внутри молекулярного ассоциата, из которого выталкивается вода, а на поверхности этого ядра в основном располагаются фрагменты, содержащие гидрофильные группы. Эти группы, взаимодействуя с молекулами воды за счет водородных связей, способствуют созданию вокруг молекулы белка гидратной оболочки, содержащей плотный и рыхлый слои. Плотный водный слой под действием отдельных гидрофобных групп структурируется с образованием льдоподобной структуры. При этом биологические и физиологические функции белка и его растворимость (разд. 11.3; 21.4; 27.3; 27.4) зависят не только от его собственной структуры, но и от структуры его гидратной оболочки. Аналогично обстоит дело с нуклеиновыми кислотами и полисахаридами в живой клетке. Таким образом, вода является не только основой внутриклеточной среды, где распределены молекулы белков, нуклеиновых кислот, полисахаридов, но и непосредственно участвует в формировании пространственной структуры этих молекул, обеспечивая их биологические и физиологические функции. Каждый грамм ДНК прочно удерживает 0,6 мл воды, гликогена — 1,5 мл воды, а белка — 3 мл воды. Поэтому, как справедливо указывал А. Сент-Дьёрдьи: «нельзя говорить о белках, нуклеиновых кислотах, нуклеопротеидах и о воде так, как если бы это были две различные системы. Они образуют единую систему, которую нельзя разделить на компоненты без разрушения ее сущности» (1940). Эти слова полностью созвучны с теорией растворов Д. И. Менделеева (1887), согласно которой раствор — это новая химическая система, возникающая в результате взаимодействия растворителя с растворенным веществом.
Интересное взаимодействие воды наблюдается при растворении в ней веществ, молекулы которых неполярны. Растворение этих веществ происходит из-за ажурности структуры воды и наличия внутренних пустот в ее ассоциатах. В воде незначительно растворяются газы (N2, 02, С12, СН4 С02), молекулы которых неполярны. Они растворяются путем внедрения их молекул в структурные полости внутри водных ассоциатов, причем размеры этих полостей должны соответствовать размерам молекул газа. При этом молекулы этих веществ удерживаются ближайшими молекулами воды за счет индукционных и дисперсионных взаимодействий. В то же время, вследствие неполярности этих молекул, они вступают в гидрофобное взаимодействие с молекулами воды окружающих их ассоциатов, структурируя их, образуя вокруг них гидратные оболочки с льдоподобной структурой. Гидратная оболочка вокруг неполярных веществ рыхлого слоя не имеет, а характер их гидратации — положительный (тср> 10 -9 с). Во многих случаях из таких растворов можно получить твердые гидраты этих газов, состав которых не стехиометричен, например СН4 *5,75Н20; С12* 7,66Н20; С3Н8* 17Н20. Подобные гидраты образуют вещества, используемые в медицинской практике в качестве анестезирующих веществ: закись азота N20, хлороформ СНС13, диэтиловый эфир (С2Н5)20, фторотан CF3CHBrCl (разд. 11.4).
Таким образом, при растворении любых веществ не только происходит гидратация образующихся частиц, но и изменяются структурно-информационные свойства самой воды.
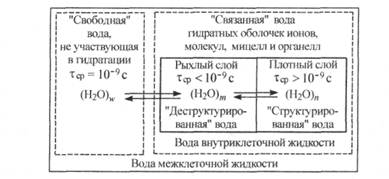 |
Суммируя все сказанное о свойствах чистой воды и водных растворов различных веществ, следует еще раз подчеркнуть, что вода — чрезвычайно разнообразная, динамичная и сложная система. В водной системе живого организма прежде всего следует различать «свободную» и «связанную» воду. Еще в 30-е годы XX столетия известный русский физиолог Д. Н. Насонов предполагал, что в отличие от межклеточной жидкости, внутриклеточная иода не содержит «свободной» воды, а представляет собой «связанную» воду гидратных оболочек компонентов клетки (ионов, молекул, мицелл и органелл). Поэтому состояние воды в организме можно выразить схемой, представленной на рис. 6.6.
Рис. 6.6. Схема состояния воды в организме
Биологические и физиологические функции биосубстратов сильно зависят от соотношения «структурированная» вода/»деструктурированная» вода, отражающего степень упорядоченности водных систем во внутри- и межклеточных жидкостях. К сожалению, эту величину пока нельзя экспериментально определить в водных системах. Растворимость тех или иных веществ во внутриклеточной жидкости зависит от их проницаемости через мембраны и от содержания «деструктурированной» воды в клетке, которое, в свою очередь, определяется состоянием клетки. Содержание «свободной» воды в межклеточных жидкостях -небольшое, и она используется как резерв для гидратации вновь поступающих веществ в организм, для удаления метаболитов и в качестве первичного компонента для термостатирования организма.
Главная особенность состояния воды в клетке заключается в том, что скорость указанных превращений и время оседлой жизни молекул воды в каждом конкретном состоянии (внутри клетки, между клетками или внутри сосудов) варьируют в чрезвычайно широких пределах. Кроме того, эти показатели зависят: от состояния рассматриваемой системы, от воздействия температуры, давления, вибрации и действия разных полей -акустического, магнитного, электрического. В этом и заключаются сложность и загадочность водных систем вообще, а в живых организмах — в особенности.

Источник