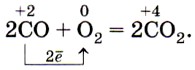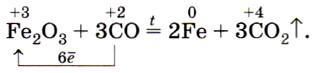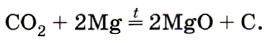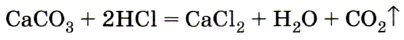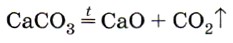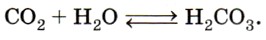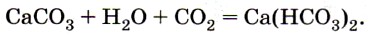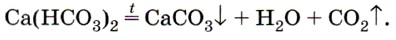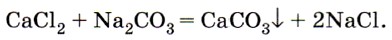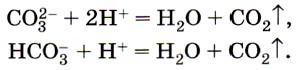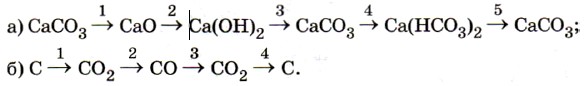Вода кислород оксид углерода iv угольная кислота
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C +2 O + O2 t ˚ C → 2C +4 O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы — 
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Способы собирания: вытеснением воздуха
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
1) С водой даёт непрочную угольную кислоту:
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 + Me = MexOy + C
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
III. Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
В природе встречаются:
CaCO3
Мел Мрамор Известняк
NaHCO3 – питьевая сода
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Специфические свойства:
1) Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты:
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 + C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
Источник
§ 34. Кислородные соединения углерода
Углерод образует два оксида — оксид углерода (II) СО и оксид углерода (IV) CO2.
Оксид углерода (II) СО — бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, он быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин (объясните происхождение этого термина), тем самым лишая гемоглобин возможности переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива (напишите уравнение соответствующей химической реакции), вот почему так опасно преждевременное закрывание дымоходов печей (рис. 152).
Оксид углерода (II) относят, как вы уже знаете, к несолеобразующим оксидам. Будучи оксидом неметалла, он должен реагировать с щелочами и основными оксидами с образованием соли и воды, однако этого не наблюдается.
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металлы из их оксидов:
Именно это свойство оксида углерода (II) используют в металлургии при выплавке чугуна.
Оксид углерода (IV) СO2 — бесцветный, не имеющий запаха газ, широко известный под названием углекислый газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в одном объёме воды растворяется один объём углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твёрдую снегообразную массу, которую в промышленности прессуют, — это известный вам «сухой лёд», который применяют для хранения пищевых продуктов. Вы уже знаете, что твёрдый углекислый газ имеет молекулярную решётку и способен к возгонке (что это такое?).
Углекислый газ СO2 как типичный кислотный оксид взаимодействует с щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой. Он не горит и не поддерживает горения (рис. 153) и потому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии соляной кислоты на мел или мрамор (рис. 154):
В промышленности углекислый газ получают обжигом известняка:
Углекислый газ используют также для изготовления шипучих напитков и получения соды.
Применение углекислого газа показано на рисунке 155.
При растворении оксида углерода (IV) в воде образуется очень нестойкая угольная кислота Н2СO3, которая легко разлагается на исходные компоненты — углекислый газ и воду:
Будучи двухосновной, угольная кислота образует два ряда солей: средние — карбонаты, например СаСO3, и кислые — гидрокарбонаты, например Са(НСO3)2. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
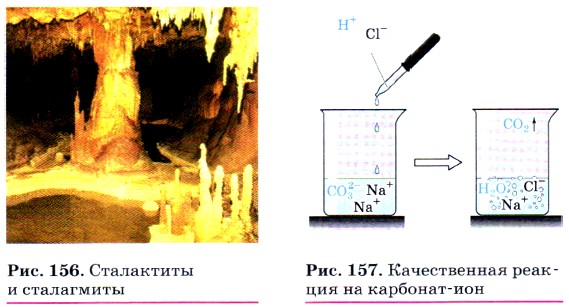
Именно наличием гидрокарбонатов кальция и магния в природной воде и объясняется её временная жёсткость. Почему временная? Потому что при нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников. В природе в результате этой реакции в пещерах формируются свисающие вниз причудливые сталактиты, навстречу которым снизу вырастают сталагмиты (рис. 156).
Другие соли кальция и магния, в частности хлориды и сульфаты, придают воде постоянную жёсткость, которую невозможно устранить кипячением. Для удаления солей, вызывающих постоянную жёсткость, приходится использовать другой карбонат — соду Na2CO3, которая переводит ионы Са 2+ в осадок, например:
Соду можно использовать и для устранения временной жёсткости воды.
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющихся пузырьков углекислого газа (рис. 157):
Эта реакция является качественной на соли угольной кислоты.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Рассмотрите реакцию восстановления оксида железа (III) оксидом углерода (II) как окислительно-восстановительный процесс.
2. Какие несолеобразующие оксиды вам ещё известны, кроме оксида углерода (II)? Верно ли с химической точки зрения другое синонимическое название их — безразличные, или индифферентные, оксиды?
3. Напишите уравнения реакций, характеризующие свойства оксида углерода (IV). Рассмотрите взаимодействие оксида углерода (IV) с магнием как окислительно-восстановительный процесс.
4. Почему раствор углекислого газа окрашивает лакмус в красный цвет? Почему при длительном хранении этого раствора лакмус снова приобретает фиолетовую окраску?
5. Напишите формулы следующих солей: карбоната меди (II), гидрокарбоната меди (II), гидроксокарбоната меди (II). К какой группе солей относится каждая соль? Как ещё называют последнюю соль?
6. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Рассмотрите процессы окисления-восстановления.
7. В 1060 г 2%-го раствора карбоната натрия растворили 14,3 г кристаллической соды (Na2CO3 • 10Н2O). Вычислите массовую долю соли в полученном растворе. Вычислите объём углекислого газа (н. у.), который образуется при взаимодействии полученного раствора с избытком соляной кислоты.
- Кислородные соединения углерода. Ответы
Источник