- Молекулярная физика. Размеры, масса молекул.
- Размеры молекул.
- Масса молекул.
- Молярная масса воды
- Молярная масса воды
- Примеры решения задач
- Сколько весит молекула?
- Видео по теме:
- Молекулярная масса
- п.1. Относительная атомная и молекулярная масса
- п.2. Количество вещества. Постоянная Авогадро
- п.3. Молярная масса
- п.4. Молярный объем
- п.5. Задачи
- Физика. 10 класс
- § 2. Масса и размеры молекул. Количество вещества
Молекулярная физика. Размеры, масса молекул.
Размеры молекул.
Для определения размеров молекул проводились различные опыты. Вот один из них.
В сосуд с водой помещают каплю масла, объем которой определяется заранее. (Объем капли V определяют с помощью мензурки, в которую при помощи пипетки капают несколько десятков капель масла, и измеряют их общий объем. Этот объем делят на количество капель). Масло начинает растекаться по поверхности воды, образуя тонкую пленку. После прекращения растекания пленки определяют ее площадь S. Если предположить, что образовалась пленка толщиной в одну молекулу (из-за чего и прекратилось растекание масла), то толщина пленки h будет равна диаметру молекулы. Толщина пленки равна отношению ее объема к площади:

Полученное в этом опыте численное значение толщины составляло 0,00000016 см, или 1,6 · 10 -7 см. Этим числом выражается примерный размер молекул (размеры атомов составляют около 10 -8 см).
Поскольку молекулы очень малы, в каждом физическом теле их содержится огромное количество. Так, в 1 см 3 воздуха содержится около 27 · 10 18 молекул. Чтобы понять, насколько велико это число, представим себе, что через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдет через отверстие за 840 000 лет.
Масса молекул.
Масса молекул (за исключением молекул органических веществ, например, белков) очень мала. Так, масса молекулы воды составляет около 2,7 · 10 -23 г. Работать с такими малыми цифрами неудобно, поэтому в физике и химии принято выражать массы атомов и молекул в относительных единицах.
Источник
Молярная масса воды
Молярная масса воды
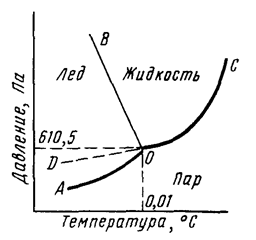
Вода – это наиболее распространенное вещество в природе. Она представляет собой термодинамически устойчивое соединение, способное находиться сразу в трех агрегатных состояниях: жидком, твердом (лед) и газообразном (водяной пар), каждое из которых определяется температурой и давлением (рис. 1).
Рис. 1. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Брутто-формула воды – H2O. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(H2O) = 2×1 + 16 = 2 + 16 = 18.
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что молярная масса воды равна 18 г/моль.
Примеры решения задач
| Задание | Рассчитайте массовую долю элементов в следующих молекулах: а) воды (H2O); б) серной кислоты (H2SO4). |
| Ответ | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Рассчитаем массовые доли каждого из элементов, входящих в состав указанных соединений.
а) Найдем молекулярную массу воды:
Mr (H2O) = 2×1,00794 + 15,9994 = 2,01588 + 15,9994 = 18,0159.
Известно, что M = Mr, значит M(H2O) = 32,2529 г/моль. Тогда массовые доли кислорода и водорода будут равны:
ω (H) = 2 × Ar (H) / M (H2O) × 100%;
ω (H) = 2 × 1,00794 / 18,0159 × 100%;
ω (H) = 2,01588 / 18,0159× 100% = 11,19%.
ω (O) = Ar (O) / M (H2O) × 100%;
ω (O) = 15,9994 / 18,0159× 100% = 88,81%.
б) Найдем молекулярную серной кислоты:
Mr (H2SO4) = 2×1,00794 + 32,066 + 4×15,9994 = 2,01588 + + 32,066 + 63,9976;
Известно, что M = Mr, значит M(H2SO4) = 98,079 г/моль. Тогда массовые доли кислорода, серы и водорода будут равны:
ω (H) = 2 × 1,00794 / 98,079 × 100%;
ω (H) = 2,01588 / 98,079× 100% = 2,06%.
ω (S) = 32,066 / 98,079× 100% = 32,69%.
ω (O) = 4×15,9994 / 98,079× 100% = 63,9976/ 98,079× 100% = 65,25%
| Задание | Вычислите, где каком из соединений массовая доля (в %) элемента водорода больше: в метане (CH4) или сероводороде (H2S)? |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Рассчитаем массовую долю каждого элемента водорода в каждом из предложенных соединений (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева округлим до целых чисел).
Найдем молекулярную массу метана:
Mr (CH4) = 4×1+ 12 = 4 + 12 = 16.
Известно, что M = Mr, значит M(CH4) = 16 г/моль. Тогда массовая доля водорода в метане будет равна:
ω (H) = 4 × Ar (H) / M (CH4) × 100%;
ω (H) = 4 × 1 / 16 × 100%;
ω (H) = 4/ 16 × 100% = 25%.
Найдем молекулярную массу сероводорода:
Mr (H2S) = 2×1+ 32 = 2 + 32 = 34.
Известно, что M = Mr, значит M(H2S) = 34 г/моль. Тогда массовая доля водорода в сероводороде будет равна:
ω (H) = 2 × Ar (H) / M (H2S) × 100%;
ω (H) = 2 × 1 / 34 × 100%;
ω (H) =2/ 34 × 100% = 5,88%.
Таким образом, массовая доля водорода больше в метане, поскольку 25 > 5,88.
| Понравился сайт? Расскажи друзьям! |
| Формула | Физические величины, входящие в формулу | Единицы физических величин |
| ν — количество вещества N — число частиц вещества NA — постоянная Авогадро | моль — моль –1 | |
| М — молярная масса | ||
| m — масса вещества m0 — масса молекулы вещества | кг кг | |
| NA = 6,022·10 23 моль –1 |
1. В каких единицах измеряют массы атомов и молекул?
2. Что такое количество вещества? Назовите единицу этой физической величины.
3. Что такое постоянная Авогадро?
4. Что называют молярной массой вещества?
5. Объясните, почему количество вещества ν, его масса m и молярная масса М связаны соотношением .
6. Докажите, что молярную массу М можно связать с относительной молекулярной (атомной) массой Мr вещества соотношением .
7. Докажите, что концентрацию частиц вещества можно определить по формуле , где m0 — масса одной молекулы, ρ — плотность вещества.
Источник