1. ОТБОР ПРОБЫ
Весы лабораторные общего назначения по ГОСТ 24104 II класса точности с наибольшим пределом взвешивания 200 г.
Бюретки для титрования по ГОСТ 20292 вместимостью 25 см 3 .
Пипетки измерительные по ГОСТ 20292 вместимостью 1, 2, 5, 10, 20, 25, 50 и 100 см 3 .
Колбы мерные по ГОСТ 1770 вместимостью 50, 250, 500 и 1000 см 3 .
Колбы конические по ГОСТ 25336 вместимостью 250 см 3 .
Воронки простые конусообразные по ГОСТ 25336.
Цилиндры по ГОСТ 1770 вместимостью 10, 25, 50 и 100 см 3 .
Натрия гидроокись по ГОСТ 4328.
Индикатор метиловый оранжевый по
Индикатор фенолфталеин по
Спирт этиловый ректификованный технический по ГОСТ 18300.
Вода дистиллированная по ГОСТ 6709.
3. ПРИГОТОВЛЕНИЕ РАБОЧИХ РАСТВОРОВ
3.1. Раствор натрия гидроокиси концентрации с (NaOH) = 0,1 моль/дм 3 готовят из фиксанала, если в нем не возникли хлопья, или из концентрированного раствора натрия гидроокиси по ГОСТ 4919.
3.2. Раствор натрия гидроокиси концентрации с (NaOH) = 0,01 моль/дм 3 готовят разбавлением точно в 10 раз раствора натрия гидроокиси концентрации с (NaOH) = 0,1 моль/дм 3 . Раствор устойчив. Хранят хорошо защищенным от доступа углекислоты.
3.3. Раствор индикатора метилового оранжевого с массовой долей 0,1 % готовят, растворяя 0,1 г индикатора в мерной колбе вместимостью 100 см 3 в 80 см 3 горячей дистиллированной воды. После охлаждения доливают объем до метки дистиллированной водой и перемешивают. Раствор устойчив, хранят его в склянке с закрывающейся пробкой. Для повседневного расхода часть раствора индикатора отливают в капельницу.
3.4. Раствор индикатора фенолфталеина с массовой долей 1 % готовят растворением 1 г индикатора в 80 см 3 этилового спирта, объем до 100 см 3 доливают дистиллированной водой. Раствор устойчив, его хранят в склянке с закрывающейся пробкой. Для повседневного расхода часть раствора индикатора отливают в капельницу.
4. ПРОВЕДЕНИЕ АНАЛИЗА
В коническую колбу вместимостью 250 см 3 отбирают 100 см 3 пробы анализируемой воды, приливают к ней 5 капель индикатора метилового оранжевого и окрашенную в красный цвет жидкость титруют раствором натрия гидроокиси концентрации с ( NaOH ) = 0,1 моль/дм 3 , при кислотности воды меньше 0,5 мг-экв/дм 3 титрование выполняют раствором натрия гидроокиси концентрации с (NaOH) = 0,01 моль/дм 3 до изменения окраски раствора в оранжево-желтый. Отметив расход титранта ан.ор ( см 3 ), прибавляют 5 капель индикатора фенолфталеина и продолжают титрование до появления устойчивого розового окрашивания жидкости. Этот расход обозначают аф.ф (см 3 ). Для получения более надежных результатов, рекомендуется проводить титрование двух параллельных проб анализируемой воды. Расхождения между параллельными определениями не должны превышать 0,1 см 3 титрованного раствора натрия гидроокиси. Если необходимо определять кислотность, включающую и угольную кислоту, то в коническую колбу вместимостью 250 см 3 отмеривают точное количество (ащ) раствора натрия гидроокиси концентрации с (NaOH) = 0,1 моль/дм 3 и сразу же вливают в эту колбу 100 см 3 анализируемой воды, прибавляют 5 капель индикатора фенолфталеина, перемешивают и титруют раствором кислоты концентрации с (НСl) = 0,1 моль/дм 3 до перехода окраски жидкости от розового или малинового до бесцветного и отмечают расход этой кислоты (ак).
5. ОБРАБОТКА РЕЗУЛЬТАТОВ
Величину кислотности (М) в миллиграмм-эквивалентах на кубический дециметр вычисляют по формулам
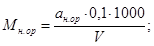
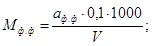
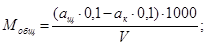
где V — объем пробы, взятый для анализа, см 3 ;
0,1 — раствор щелочи или кислоты концентрации с ( NaOH ) = 0,1 моль/дм 3 или с (НСl) = 0,1 моль/дм 3 .
Если титрование проводят раствором натрия гидроокиси концентрации с (NaOH) = 0,01 моль/дм 3 , то в формулы вместо 0,1 подставляют 0,01.
Суммарные погрешности результатов определения кислотности с доверительной вероятностью Р = 0,95 указаны в таблице.
При титровании раствором натрия гидроокиси концентрации c (NaOH) = 0,1 моль/дм 3
При титровании раствором натрия гидроокиси концентрации c (NaOH) = 0,01 моль/дм 3
Источник
Определение кислотности воды
Сущность метода. Кислотность определяется титрованием воды гидроксидом натрия в присутствии индикаторов. Кислотность определяется, если рН воды меньше 8,3, в противном случае ее кислотность равна нулю.
Реактивы и оборудование
Индикаторы: фенолфталеин, метилоранж или заменяющие их
Гидроксид натрия, раствор с концентрацией 0,1 моль-экв./дм 3
Ход определения
Предварительно ориентировочно устанавливают рН воды. Кислотность определяют, если рН меньше 8,3. Если вода мутная, ее фильтруют, а если окрашенная – разбавляют дистиллированной водой. Разбавление проводят в мерных колбах вместимостью 100 – 200 см 3 . Сначала наливают в мерную колбу 20 – 30 см 3 дистиллированной воды, потом точно отмеренный объем анализируемой воды, раствор перемешивают, доливают дистиллированную воду до метки и снова перемешивают. Взятый объем анализируемой воды учитывают при вычислении результата анализа. При определении кислотности титрование с разными индикаторами лучше проводить в отдельных порциях анализируемой воды.
Определение общей кислотности.К 50 –100 см 3 анализируемой воды прибавляют 10 капель раствора фенолфталеина и титруют раствором едкого натра на белом фоне до появления неисчезающего малинового (при использовании фенолфталеина) окрашивания.
Определение свободной кислотности. К другой пробе анализируемой воды (50 – 100 см 3 ) прибавляют 5 – 6 капель метилоранжа (или одного из заменяющих его индикаторов). При наличии в воде сильных кислот появляется розовая окраска. В этом случае пробу титруют раствором гидроксида натрия до изменения окраски индикатора по сравнению с раствором сравнения. Для приготовления раствора сравнения отбирают такой же объем воды и добавляют столько же капель индикатора.
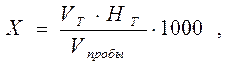 |
Расчет.Содержание кислот (Х) в ммоль-экв./дм 3 вычисляют по формуле:
где V Т – объем титранта, см 3 ;
НТ – концентрация титранта, моль-экв./дм 3 ;
V пробы – объем пробы, см 3 ;
1000 – коэффициент для перехода от моль-экв. к ммоль-экв.
Щелочность
Щелочностью воды называют содержание в ней веществ, вступающих в реакцию с сильными кислотами. К этим веществам относят:
1) сильные основания (гидроксид натрия, гидроксид калия и т.п.);
2) слабые основания (аммиак, анилин, пиридин и т.п.);
3) анионы слабых кислот (НСО3 — , СО3 2- , Н2РО4 — , НРО4 2- , НSO3 — , SO3 2- , анионы гуминовых кислот, HS — , S 2- и т.д.), которые гидролизуются с образованием гидроксид-анионов, например:
При титровании сильной кислотой реакции протекающие между нею и различными веществами, обуславливающими щелочность воды заканчиваются при различных значениях рН раствора. При оттитровывании сильных оснований кислотой реакция среды будет нейтральной. При титровании веществ второй группы соляной кислотой в конце титрования раствор должен содержать соответствующие этим основаниям положительно заряженные ионы, например:
которые, гидролизуясь, придают раствору слабокислую реакцию:
Слабокислая реакция создается в растворе и в конце титрования анионов, входящих в третью группу, так как при таком титровании образуются соответствующие слабые кислоты, частично диссоциирующие с образованием ионов водорода, например:
Общая щелочность поверхностных вод обычно связана с присутствием в ней гидрокарбонатов щелочноземельных металлов, в меньшей степени – щелочных. В этом случае значение рН воды не превышает 8,3. Растворимые карбонаты и гидроксиды (в случае сточных вод) повышают значение рН. Ионы ОН — и СО3 2 – титруют соляной кислотой в присутствии индикатора фенолфталеина или потенциометрическим методом до рН = 8,3. Количественное содержание этих ионов называется свободной щелочностью, или щелочностью воды по фенолфталеину. При этом протекают следующие реакции:
Ионы НСО3 – титруются соляной кислотой в присутствии индикатора метилового оранжевого или потенциометрическим методом до рН = 4,5. Протекающую при этом реакцию можно выразить уравнением:
Количество кислоты, необходимое для достижения рН 4,5, эквивалентно общей щелочности.
Определение щелочности полезно при дозировании химических веществ, необходимых для обработки вод в целях водоснабжения, а также при реагентной очистке некоторых сточных вод. Определение щелочности важно при установлении пригодности воды для ирригации.
Если щелочность по фенолфталеину равна нулю, то общая щелочность определяется присутствием в воде только гидрокарбонат-ионов. Поскольку для подавляющего большинства природных вод гидрокарбонат-ионы связаны только с катионами кальция и магния, то в случае щелочности по фенолфталеину, равной нулю, можно считать, что общая щелочность воды равна ее карбонатной жесткости.
Лабораторная работа № 8
Определение щелочности
Сущность метода.Щелочность определяют при рН воды больше 4,5. Щелочность устанавливают титрованием воды раствором сильной кислоты в присутствии подходящих индикаторов.
Реактивы и оборудование
Соляная или серная кислота, 0,1 моль-экв./дм 3
Бюретки, конические колбы для титрования
Ход определения
Предварительно ориентировочно определяют рН воды. Если рН воды меньше 4,5, щелочность равна нулю. Если вода мутная, ее фильтруют, а если окрашенная – разбавляют дистиллированной водой.
Определение свободной щелочности.В коническую колбу помещают 100 анализируемой воды, взятой непосредственно или предварительно разбавленной, как описано выше; приливают 5 капель фенолфталеина. Если появляется малиновая или розовая окраска, то содержимое колбы титруют на белом фоне соляной или серной кислотой до исчезновения окраски. Израсходованное на титрование количество кислоты соответствует щелочности воды по фенолфталеину,
Определение общей щелочности.В коническую колбу помещают 100 см 3 анализируемой воды, приливают 5 – 6 капель раствора метилоранжа или заменяющего его индикатора (метилового желтого, бромфенолового синего или смешанного индикатора). В другую коническую колбу наливают такой же объем анализируемой воды и столько же индикатора, сколько было введено в первый раствор. Ставят обе колбы на белую бумагу и титруют жидкость в первой колбе кислотой до тех пор, пока цвет ее не станет отличаться от цвета жидкости во второй колбе.
Расчет. Содержание оснований (Х) в ммоль-экв./дм 3 вычисляют по формуле:
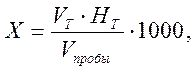 |
где V Т – объем титранта, см 3 ;
НТ – концентрация титранта, моль-экв./дм 3 ;
V пробы – объем пробы, см 3 ;
1000 – коэффициент для перевода от моль-экв. к ммоль-экв.
5.3. Определение растворенного кислорода
Количество кислорода, растворенного в воде, имеет большое значение для оценки состояния водоема. На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
· процесс абсорбции кислорода из атмосферы;
· выделение кислорода водной растительностью в процессе фотосинтеза;
· поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта, ее скорость повышается с понижением температуры, с повышением давления и понижением минерализации.
Фотосинтетическое выделение кислорода прикрепленными, плавающими растениями и фитопланктоном происходит тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше питательных веществ в воде.
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции окисления органических веществ – дыхание организмов, биохимическое окисление и химическое окисление (окисление Fe 2+ , Mn 2+ , NO3 – , NH4 + ,CH4, H2S).
Содержание растворенного кислорода подвержено сезонным и суточным колебаниям. Его снижение указывает на резкое изменение биологических процессов в водоемах, а также на загрязнение водоемов.
Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Кислородный режим оказывает огромное влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитее рыб, составляет около 5 мг/дм 3 , понижение до 2 мг/дм 3 вызывает массовую гибель (замор) рыбы.
Концентрация растворенного кислорода в воде водоемов питьевого и культурно-бытового пользования в пробе, отобранной до 12 часов дня, должна быть не менее 4 мг/дм 3 в любой период года; для водоемов рыбохозяйственного назначения – не должна быть ниже 4 мг/дм 3 в зимний период (при ледоставе) и 6 мг/дм 3 — в летний.
Источник
Вода метод определения кислотности
Методы определения щелочности и массовой концентрации карбонатов и гидрокарбонатов
Water. Methods for determination of alkalinity and mass concentration of carbonates and hydrocarbonates
Дата введения 2014-01-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Протектор» совместно с Закрытым акционерным обществом «Роса» на основе собственного перевода на русский язык англоязычной версии стандартов, указанных в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 3 декабря 2012 г. N 54)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Код страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Госстандарт Республики Казахстан
4 Приказом Федерального агентства по техническому регулированию и метрологии от 12 декабря 2012 г. межгосударственный стандарт ГОСТ 31957-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2014 г.
5 Настоящий стандарт является модифицированным по отношению к международным стандартам: ISO 9963-1:1994* «Качество воды. Определение щелочности. Часть 1. Определение общей и составной щелочности» («Water quality — Determination of alkalinity — Part 1: Determination of total and composite alkalinity», MOD), ISO 9963-2:1994 «Качество воды. Определение щелочности. Часть 2. Определение карбонатной щелочности» («Water quality — Determination of alkalinity — Part 2: Determination of carbonate alkalinity», MOD) путем:
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. — Примечание изготовителя базы данных.
— исключения отдельных пунктов указанных международных стандартов, тексты которых с обоснованиями исключения приведены в приложении ДД;
— внесения дополнительных положений, фраз и слов, что обусловлено учетом потребностей национальной экономики и особенностей межгосударственной стандартизации, выделенных в тексте настоящего стандарта курсивом.
Наименование настоящего стандарта изменено относительно наименования указанных международных стандартов для приведения в соответствие с ГОСТ 1.5-2001 (подраздел 3.6).
Сведения о соответствии ссылочных межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененных международных стандартах, приведены в дополнительном приложении ДГ.
Сопоставление структуры настоящего стандарта со структурой примененных в нем международных стандартов приведено в дополнительном приложении ДД
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Ноябрь 2019 г.
8 Настоящий стандарт подготовлен на основе применения ГОСТ Р 52963-2008 (ИСО 9963-1:1994, ИСО 9963-2:1994)
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
1 Область применения
Настоящий стандарт распространяется на питьевую и природную (поверхностную и подземную) воду, в том числе воду источников питьевого водоснабжения, а также на сточную воду, и устанавливает следующие титриметрические методы определения щелочности, карбонатов и гидрокарбонатов с визуальным или потенциометрическим фиксированием конечной точки титрования:
— метод А — определение свободной и общей щелочности питьевой воды, в том числе расфасованной в емкости (кроме газированной), воды источников питьевого водоснабжения, природной и сточной воды титрованием до значений рН 8,3 и 4,5, с использованием полученных значений щелочности для расчетов массовых концентраций карбонатов и гидрокарбонатов;
— метод Б — определение карбонатной щелочности питьевой и природной воды, а также воды, контролируемой на стадиях технологических процессов водоподготовки, и воды, используемой для технических целей, титрованием пробы до значения рН 5,4.
Методы позволяют определять молярные концентрации щелочности от 0,1 до 100 ммоль/дм . Метод А позволяет определять массовые концентрации карбонатов от 6 до 6000 мг/дм и гидрокарбонатов в диапазоне от 6,1 до 6100 мг/дм .
Пробы воды со значениями щелочности более 10 ммоль/дм перед анализом разбавляют.
При визуальном титровании определению щелочности мешают:
— интенсивная окраска воды, которую перед титрованием устраняют путем добавления гидроксида алюминия (или активированного угля) с последующим фильтрованием через бумажный фильтр «синяя лента» или стеклянный фильтр;
— наличие суспензированных карбонатов, которые перед титрованием устраняют фильтрованием через бумажный фильтр «синяя лента» или стеклянный фильтр;
— свободный хлор в концентрациях свыше 0,5 мг/дм , затрудняющий фиксирование перехода окраски индикатора. Свободный хлор перед титрованием устраняют путем добавления раствора тиосульфата натрия молярной концентрации 0,1 моль/дм из расчета 0,1 см на 200 см пробы воды, что позволяет удалить до 1,8 мг/дм хлора в указанном объеме пробы воды.
В случае если окраску или мутность пробы нельзя устранить вышеуказанными способами, пробу воды рекомендуется анализировать потенциометрическим титрованием.
На потенциометрическое титрование не оказывают влияние окислители, хотя определению конечной точки титрования могут мешать присутствующие в пробе воды органические соединения. Поверхностно-активные вещества, жиры и т.п. могут покрывать пленкой поверхность электродов и замедлять проведение измерений. Поэтому необходимо дополнительное время между добавлением титранта, чтобы привести электроды в равновесие. Электроды следует регулярно очищать растворителями, указанными в инструкции по эксплуатации электродов или, в случае отсутствия указаний, этиловым спиртом.
При определении щелочности рекомендуется избегать контакта пробы воды с атмосферой.
Коэффициенты пересчета значений щелочности, выраженных в других единицах, приведены в таблице А.1 (приложение А).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 8.135 Государственная система обеспечения единства измерений. Стандарт-титры для приготовления буферных растворов — рабочих эталонов рН 2-го и 3-го разрядов. Технические и метрологические характеристики. Методы их определения
ГОСТ 17.1.5.05 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 83 Реактивы. Натрий углекислый. Технические условия
ГОСТ 1770 (ИСO 1042-83, ИСO 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118 Реактивы. Кислота соляная. Технические условия
ГОСТ 4199 Реактивы. Натрий тетраборнокислый 10-водный. Технические условия
ГОСТ 4328 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4919.2 Реактивы и особо чистые вещества. Методы приготовления буферных растворов
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 6755 Поглотитель химический известковый ХП-И. Технические условия
ГОСТ 14919 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ ISO/IEC 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 17792 Электрод сравнения хлорсеребряный насыщенный образцовый 2-го разряда
ГОСТ 18300 Спирт этиловый ректификованный технический. Технические условия
В Российской Федерации действует ГОСТ Р 55878-2013 «Спирт этиловый технический гидролизный ректификованный. Технические условия».
ГОСТ 24104 Весы лабораторные. Общие технические требования
В Российской Федерации действует ГОСТ Р 53228-2008 «Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания».
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 27068 Реактивы. Натрий серноватисто-кислый (натрия тиосульфат) 5-водный. Технические условия
ГОСТ 29169 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251 (ИСО 385-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 30813 Вода и водоподготовка. Термины и определения
ГОСТ 31861 Вода. Общие требования к отбору проб
ГОСТ 31862 Вода питьевая. Отбор проб
В Российской Федерации действует ГОСТ Р 56237-2014 (ИСО 5667-5:2006) «Вода питьевая. Отбор проб на станциях водоподготовки и в трубопроводах».
Источник



