- Вода молекулярного строение или немолекулярного строения
- Готовимся к сдаче ЕГЭ по химии
- Вещества молекулярного и немолекулярного строения
- Молекулярные вещества
- Немолекулярные вещества
- Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
- Содержание:
- Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки
- Молекулярное и немолекулярное строение веществ
- Кристаллические решетки: типы и примеры
- Атомная
- Молекулярная
- Ионная
- Металлическая
- Урок №8. Вещества молекулярного и немолекулярного строения. Кристаллические решетки
- Вещества немолекулярного строения
- Что такое строение вещества
- Немолекулярные вещества
- Атомные кристаллические решетки
- Металлические кристаллические решетки
- Ионные кристаллические решетки
- Что мы узнали?
Вода молекулярного строение или немолекулярного строения
Добро пожаловать, Гость!
Готовимся к сдаче ЕГЭ по химии
Вещества молекулярного и немолекулярного строения
Молекулярные и немолекулярные вещества — один из признаков химических веществ относительно их строения.
Молекулярные вещества
— это вещества, мельчайшими структурными частицами которых являются молекулы
— наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Например: Вода H2O — жидкость, tпл= 0°С; tкип= 100°С; Кислород O2 — газ, tпл= -219°С; tкип= -183°С; Оксид азота (V) N2O5 — твердое вещество, tпл= 30,3°С; tкип= 45°С;
К молекулярным веществам относятся:
соединения неметаллов друг с другом (бинарные и многоэлементные): NH3, CO2, H2SO4.
Немолекулярные вещества
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Ион — это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Например: Na + , Cl — .
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например: натрий хлорид NaCl — твердое вещество, tпл= 801°С; tкип= 1465°С; медь Cu — твердое вещество, tпл= 1083°С; tкип= 2573°С; кремний Si — твердое вещество, tпл= 1420°С; tкип= 3250°С;
К немолекулярным веществам относятся:
простые вещества (металлы): Na, Cu, Fe, …;
сплавы и соединения металлов с неметаллами: NaH, Na2SO4, CuCl2, Fe2O3;
неметаллы: бор, кремний, углерод (алмаз), фосфор (чёрный и красный);
некоторые бинарные соединения неметаллов: SiC, SiO2.
Источник
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Содержание:
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки
Неорганические и органические соединения отличаются по строению. Меньше веществ, образованных молекулами. Гораздо чаще встречается немолекулярные соединения. Частицы веществ могут быть упорядочены расположены в пространстве, образуют кристаллическую решетку. Тип структуры влияет на свойства различных химических соединений.
Молекулярное и немолекулярное строение веществ
Представления о существовании атомов возникли в древности. Греческое название переводится как «неделимые». Долгое время термины «атом», «корпускула», «молекула» были почти синонимами. Ясность внесли химики всего мира в 1860 году. Ученые приняли решение называть атомами мельчайшие частицы вещества. Они могут входить в состав молекул и немолекулярных структур.
Строение — это характеристика структурных единиц вещества, их расположение в пространстве (кристаллическая решетка).
Типы веществ по строению
Типы
Общие признаки
Тип кристаллической решетки
Вещества молекулярного строения.
Мельчайшие структурные единицы (частицы) — молекулы.
Вещества немолекулярного строения.
Мельчайшие структурные частицы — атомы или ионы.
Атомная, ионная или металлическая.
Неметаллы, их соединения — вещества преимущественно молекулярного строения. Водород, кислород, азот, хлор, моно- и диоксид углерода, аммиак состоят из молекул сравнительно небольшого размера. Состав отражают формулы Н2, О2, N2, Cl2, СО, СО2, NH3. Наиболее распространенное вещество молекулярного строения — вода (Н2О) (Рис. 1).
Агрегатное состояние при разных температурах отличается. В обычных условиях эти вещества являются газами. Вода при комнатной температуре — жидкость, при 0°С — превращается в лед, имеющий кристаллическое строение. При 100°С образуется газ (пар).
Сахар и другие твердые органические вещества тоже состоят из молекул. Состав глюкозы отражает формула С6Н12О6. На рис. 2 показано пространственное расположение атомов в молекуле.
Немолекулярных соединений в природе гораздо больше. К этой группе относятся инертные газы, алмаз, графит (аллотропные видоизменения, модификации углерода), минерал кварц, различные соли, металлы. Это преимущественно твердые вещества (при комнатной температуре). Исключение — ртуть, жидкий металл, затвердевающий лишь при –30°С. Среди веществ немолекулярного строения встречаются наиболее твердые и тугоплавкие, обладающие высокой тепло- и электропроводностью.
Кристаллические решетки: типы и примеры
Структурные частицы природных и искусственно полученных веществ находятся в определенных точках пространства, на расстоянии друг от друга. Упорядоченное расположение называют кристаллической решеткой. В ее узлах находятся атомы, ионы или молекулы. На рисунках они обычно изображены кружочками. Черточками между ними условно обозначают химические связи.
Шаро-стержневые объемные модели тоже помогают лучше представить расположение структурных единиц в пространстве. Шарики символизируют частицы вещества, стержни между ними — химическую связь, как на рис. 3.
Вещества кристаллического строения широко распространены, имеют большое практическое значение. Они встречаются в природе, находят применение в промышленности, медицине, сельском хозяйстве, быту. (Рис. 4).
Рассмотрим особенности четырех основных типов кристаллической решетки.
Атомная
Такие кристаллические структуры распространены среди простых веществ. В узлах находятся атомы. Примеры веществ: графит и алмаз (аллотропные видоизменения, модификации углерода), кремний.
Прочную атомную кристаллическую решетку также имеют горный хрусталь и кварц (минералы состоят из диоксида кремния). Отличие от простых веществ существенное — в узлах находятся атомы кремния и кислорода, т. е. разных элементов.
Вещества атомного строения обычно твердые (за исключением графита), нерастворимые в воде, тугоплавкие, являются изоляторами или полупроводниками.
Молекулярная
В узлах кристаллической решетки — молекулы. Простые вещества с этим типом пространственного строения: S8 — кристаллическая сера, Р4 — белый фосфор, Br2 — бром, I2 — кристаллический йод. Н2О в виде льда, СО2 («сухой лед») — сложные вещества с молекулярной кристаллической решеткой.
Силы притяжения между структурными единицами относительно слабые, поэтому связи легко разрушаются. Например, йод возгоняется — переходит из твердого состояния в газообразное при комнатной температуре. (Рис. 5, 6).
Твердые органические соединения тоже имеют преимущественно молекулярную решетку. Это непрочные структуры, которые разрушаются при повышении температуры, растворении в воде.
Ионная
В узлах расположены ионы — заряженные частицы. Классический пример вещества с этим типом кристаллической решеткой — поваренная соль или хлорид натрия. (Рис. 7).
Катионы — положительно заряженные частицы. В электрическом поле они перемещаются к отрицательному полюсу источника тока (катоду). Отрицательные ионы движутся к аноду, имеющему заряд «+».
Ионная решетка характерна для солей, оксидов и гидроксидов металлов I–III групп периодической системы, большой группы соединений металлических элемент из других групп. Такие вещества обычно твердые и тугоплавкие.
Ионы высвобождаются при расплавлении и растворении. Расплавы и растворы являются электролитами, проводниками электрического тока, более слабыми, по сравнению с металлами.
Металлическая
Есть значительные отличия от трех предыдущих типов кристаллического строения. В узлах расположены нейтральные атомы и катионы. Между ними беспорядочно движутся электроны, образующие так называемый «электронный газ». (Рис. 8).
Металлы, их сплавы — твердые вещества, имеющие металлический блеск. Они тугоплавкие, обладают высокой тепло- и электропроводностью.
Все известные соединения состоят из атомов, молекул либо ионов. Упорядоченное расположение структурных единиц в пространстве — кристаллическая решетка. Физические свойства веществ во многом определяются типом соединения частиц.
Труднее разрушается атомная, легче — молекулярная кристаллическая решетка. Чтобы «освободить» частицы в составе ионного кристалла, достаточно растворить или расплавить вещество. Особенностью металлической решетки является наличие «электронного газа», высокая электропроводность веществ.
Источник
Урок №8. Вещества молекулярного и немолекулярного строения. Кристаллические решетки
Молекулярные вещества
Молекулярные вещества — это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы — наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Вода – самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3 / 4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода – молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название. Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая плотность воды наблюдается при 4 o С, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o – температура замерзания, 100 o – температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь позже.
Немолекулярные вещества
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы .
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например, Поваренная соль — твердое вещество, t пл =801°С; t кип =1465°С; Железо
Железо – серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом – никелем – оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) – один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения.
Источник
Вещества немолекулярного строения

Средняя оценка: 4.6
Всего получено оценок: 207.
Средняя оценка: 4.6
Всего получено оценок: 207.
Все вещества состоят из атомов, которые формируют структуру (форму, размеры и т.п.) с помощью устойчивых связей. При этом структурная решетка физического тела может состоять либо из отдельных атомов, либо из отдельных однотипных групп атомов — молекул. По виду строения вещества принято разделять на два различных класса: на вещества молекулярного и немолекулярного строения.
Что такое строение вещества
Перечислим основные научные факты, исходя из которых все вещества имеют то или иное строение и агрегатное состояние (твердое, жидкое или газообразное):
- Все физические объекты состоят из очень мелких частиц — молекул;
- Молекулы, в свою очередь, состоят из еще меньших частиц — атомов;
- Атомы состоят из положительно заряженного ядра, включающего в себя протоны и отрицательно заряженные электроны. Согласно планетарной модели Резерфорда электроны вращаются вокруг ядра по определенным орбитам;
- Частицы вещества находятся в непрерывном, хаотическом движении;
- Взаимодействие частиц обусловлено электромагнитным взаимодействием: при удалении друг от друга происходит притяжение, а при плотном сближении — отталкивание. В равновесном состоянии силы отталкивания и притяжения равны друг другу.
Немолекулярные вещества
Вещества, состоящие из одинаковых молекул, каждая из которых имеет в своем составе один и тот же набор атомов, называются молекулярными веществами. К веществам немолекулярного строения относятся вещества, состоящие либо из одиночных атомов, либо из ионных соединений. Приведем некоторые примеры веществ немолекулярного строения:
- Атомные:
- Алмаз (C — углерод);
- Бинарные соединения неметаллов (SiO2 — окись кремния, SiC — карбид кремния );
- Рубин (Al2O3);
- Кремний (Si);
- Металлы: Na, Cu, Fe.
- Соли (NaCl — поваренная соль, сульфат калия — K2SO4,);
- Едкий натр, сода, флюорит;
- Гидриды (LiH);
- Оксиды (CaO, MgO, FeO);
- Основания (NaOH, KOH).
Немолекулярные вещества в обычных условиях находятся в твердом агрегатном состоянии. Их кристаллическая решетка представляет собой правильное, регулярное расположение частиц, из которых они состоят: атомов или ионов в узлах кристаллической решетки. Кристаллические решетки немолекулярных веществ бывают трех типов: атомные, ионные и металлические.
Атомные кристаллические решетки
Атомными называют решетки, в узлах которых расположены единичные атомы. В решетках этого типа атомы связаны между собой крепкими ковалентными связями. Ярким примером вещества с такой решеткой служит алмаз.
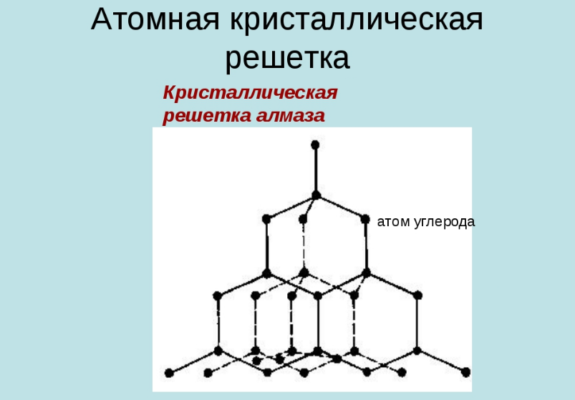
Это минерал (часть горнорудной породы), который является одной из модификаций углерода — С (химическая формула). Элементарная ячейка алмаза представляет собой куб. В вершинах находится по одному атому. Кроме этого, в каждой грани по одному атому и еще четыре — внутри куба. Атомы соединены очень прочными ковалентными связями. Такая структура и “упаковка” считается наиболее плотной. Благодаря этому достигаются высокие характеристики твердости.
Кроме высокой твердости вещества с атомной кристаллической решеткой характеризуются высокими температурами плавления (у алмаза Тплав = 3500 0 С) и низкой растворимостью.
После специальной обработки (огранки) алмазы превращают в самые популярные ювелирные украшения — бриллианты. В промышленности алмазы находят свое применение в качестве абразивов (материалы для обработки поверхности) и прочных покрытий для инструментов. Кстати, несмотря на высокую твердость алмаз довольно хрупок — его можно разрушить резким ударным воздействием.
Металлические кристаллические решетки
В узлах этих решеток расположены атомы и ионы (атомы превращаются в ионы, отдавая электроны со своих внешних орбит). Такое строение определяет основные физические свойства металлов: пластичность, ковкость, высокие показатели тепло- и электропроводности, непрозрачность и присущий металлам блеск.
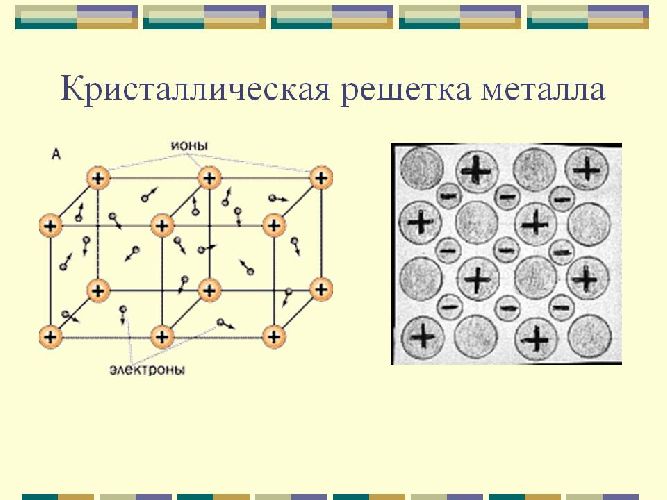
Металлическая и атомная кристаллические решетки очень похожи, но, тем не менее, их физические свойства существенно различаются. Например, в отличие от веществ с атомными (типа алмаза) все металлы обладают высокой электропроводностью и теплопроводностью. Тип связи в этих решетках называется металлическим. К этим веществам относятся все металлы (Fe, Hg, Cu, Na и т.д.) и металлические сплавы.
Ионные кристаллические решетки
В узлах ионных кристаллических решеток расположены отрицательно и положительно заряженные ионы, между которыми образуются отдельный тип связей — ионный. Ионы могут быть как простые (Na + , Cl − ), так и сложные (SiO4 2− , OH − ). Ионные кристаллические решетки характерны для оксидов и гидрооксидов металлов. Например, решетка употребляемой нами ежедневно поваренной соли представляет собой куб, с чередующимися в узлах положительными ионами Na + и отрицательными Cl − .
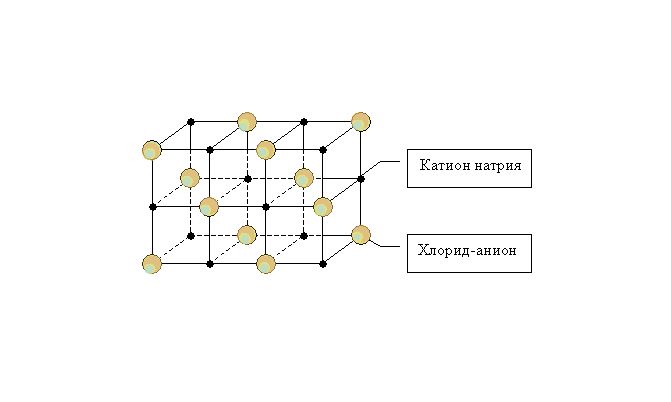
Металлические связи характеризуются высокой устойчивостью. В следствие этого вещества с этим типом решетки имеют высокие показатели твердости и прочности. Ионные соединения имеют высокие температуры кипения и плавления. Однако, многие ионные вещества хорошо растворяются в воде.
Примеры ионных веществ: Хлорид натрия (NaCl), селитра (NH4NO3), сернокислый алюминий (Al2(SO4)3), исландский шпат (CaCO3).
Исландский шпат обладает большим набором полезных оптических свойств. Он используется более чем в двухстах типах оптических приборах: микроскопах, поляриметрах, калориметрах, спектрофотометрах, дальномерах, сахариметрах, лазерах и т.д.
Что мы узнали?
Итак, мы узнали, что к веществам с немолекулярным строением относятся твердые вещества, состоящие либо из одинаковых атомов, либо из ионов различных атомов, расположенных в узлах кристаллической решетки. Немолекулярные вещества в обычно находятся в твердом агрегатном состоянии. Кристаллические решетки немолекулярных веществ бывают трех типов: атомные, ионные и металлические.
Источник




