- Вода – растворитель
- Что такое раствор
- Образование пещер
- Почвенные растворы
- Нерастворимые вещества
- Что мы узнали?
- Вода как растворитель — свойства, значение и примеры
- Свойства воды как растворителя
- Какие вещества растворяются в воде
- Что не растворяется в воде
- Значение воды как растворителя
- Лекция. Химические и физические свойства природных вод
- Оглавление
- 1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
- 2. 2. ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ВОД
- 3. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
Вода – растворитель

Средняя оценка: 4.5
Всего получено оценок: 27.
Средняя оценка: 4.5
Всего получено оценок: 27.
Вода окружает человека, является составной частью животных и растений, без воды невозможна жизнь на Земле. Вода не имеет запаха, цвета, вкуса. Вода легко испаряется, течёт, на морозе превращается в лёд. В воздухе присутствуют пары воды, это даёт возможность дышать всем существам. Ещё одно свойство воды — способность растворять многие вещества.
Что такое раствор
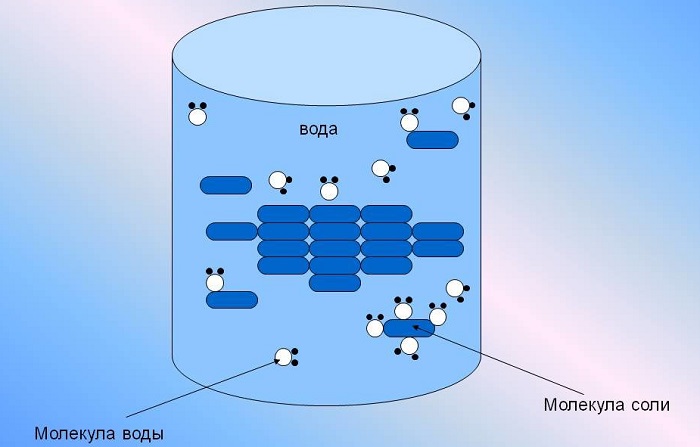
Раствором называют однородную смесь из нескольких веществ, где компоненты неотделимы друг от друга. Обычно растворы представляют собой жидкость.
На обеденном столе множество растворов. Это подсоленный суп, соус к макаронам, сладкий чай и кофе, минеральная вода. Основой большинства растворов является вода.
В природе также много растворов. Самый известный — солёные озёра, где вода растворяет ископаемую соль.
Одно из самых солёных озер — Мёртвое море, где в 1 литре воды содержится 310–350 грамм соли. В растворе присутствуют соли магния, кальция, натрия и калия.
Образование пещер
В горах, сложенных известняком, часто образуются пещеры. В известняке множество микротрещин, по которым с дневной поверхности просачивается вода. Вода — растворитель известняка, поэтому постепенно твёрдое вещество растворяется, на его месте образуется маленькая пустота. Пустота расширяется, формируется пещера.
При растворении известняка вода превращается в раствор, стекающий по стенкам пещеры и капающий с потолка. Из раствора откладывается известняк, очень медленно растут сталактиты, похожие на сосульки.

Почвенные растворы
Вода впитывается в почву, проникает в нижние горизонты. В воде растворяются минеральные вещества, органические соединения. Так образуются почвенные растворы, из которых корневая система растений усваивает питательные вещества. Если почвенные растворы содержат недостаточное количество питательных веществ, применяют различные удобрения.
Нерастворимые вещества
Некоторые вещества не растворяются в воде, их называют нерастворимыми. Это металлы, большинство горных пород, масла, нефть, бензин, воск и другие.
Вещества, более тяжёлые, чем вода, оседают на дно сосуда или водоёма. Дно реки или озера покрыто песком и окатанными камешками-галькой.
Нефть и нефтепродукты легче воды, поэтому при загрязнении реки растекаются по водной поверхности. При этом прекращается доступ воздуха в воду, что приводит к гибели водных организмов.
Что мы узнали?
Вода — природный растворитель. В докладе для урока по окружающем миру в 3 классе можно кратко описать описать это свойство воды на примере растворов природных (солёные озёра, почвенные растворы) и созданных человеком — жидкие блюда (супы, соусы) и напитки (чай, кофе).
Источник
Вода как растворитель — свойства, значение и примеры
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
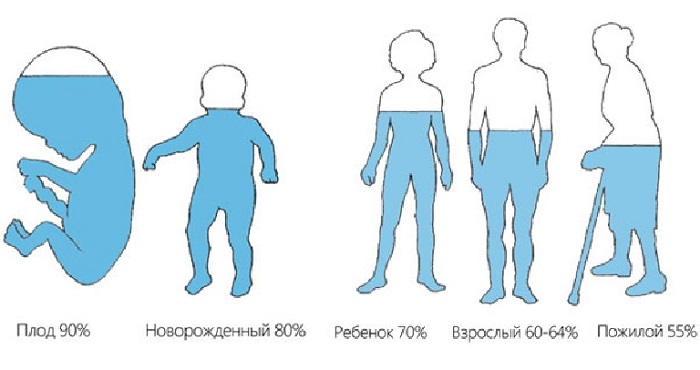
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Источник
Лекция. Химические и физические свойства природных вод
| Сайт: | Дистанционное образование Казанского федерального университета |
| Курс: | Гидрология |
| Книга: | Лекция. Химические и физические свойства природных вод |
| Напечатано:: | Гость |
| Дата: | Среда, 20 октября 2021, 21:15 |
Оглавление
1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
Вода — это простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом. По своей химической природе—это оксид (окись) водорода Н2О. В чистом виде вода — вещество бесцветное, не имеющее ни вкуса, ни запаха.
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине.
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд.
Оба атома водорода , лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды— величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т. е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде.
При повышении температуры наряду с упомянутым уплотнением «упаковки» молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения воды, при температуре выше 4°С — тепловое расширение , поэтому вода обладает «аномальным» свойством — наибольшей плотностью не при температуре плавления, а при 4°С.
Водород и кислород имеют несколько природных изотопов:
1 Н — «обычный» водород),
2 Н — «тяжелый» водород, или дейтерий),
3 Н — радиоактивный «сверхтяжелый» водород, или тритий).
16 О, 17 О, 18 О. Поэтому и сама вода имеет переменный изотопный состав.
Природная вода — это смесь вод разного изотопногосостава.
Наиболее распространена вода, состоящая из изотопов 1 Н и 16 О – «обычная» вода, доля других изотопных видов воды ничтожна — менее 0,27 %. Приведенные в дальнейшем сведения относятся только к «обычной» воде.
Одна из главных причин, приводящих к различию изотопного состава природных вод,— процесс испарения.
В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, а в результате конденсации — более легкими.
Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат «тяжелого» водорода ( 3 Н) и «тяжелого» кислорода ( 18 О) меньше, чем океанические воды.
Воду с изотопным составом ‘Н2 16 О называют «обычной» водой и обозначают просто Н2О, остальные виды воды (кроме 3 Н2О) называют «тяжелой» водой. Иногда «тяжелой» водой считают лишь дейтериевую воду 2 Н2О (или О2О). Вода с изотопным составом 3 Н2О (или Т2О) — так называемая «сверхтяжелая» вода. Ее на Земле находится всего 13—20 кг.
2. 2. ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ВОД
Вода — слабый электролит, диссоциирующий по уравнению:
Уравнение характеризует так называемое ионное равновесие воды. Состояние ионного равновесия природных вод отражает водородный показатель рН.
Благодаря особенностям молекулярного строения вода обладает свойством хорошо растворять различные химические вещества. Природная вода представляет собой слабый раствор.
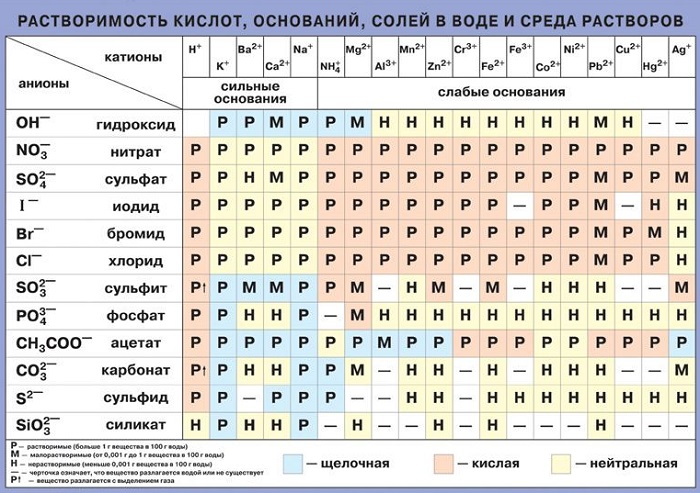
В воде хорошо растворяются: соли, газы, биогенные вещества, микроэлементы.
Суммарное содержание в воде растворенных неорганических веществ (концентрация солей) выражают в виде минерализации М(мг\л, г\л), либо в относительных единицах (%, ‰).
Содержание растворенных в воде веществ в г/кг или в промилле (%о) называется соленостью воды
По содержанию солей (минерализации или солености) природные воды подразделяют на четыре группы:
Минерализация природных вод разного типа может изменяться в довольно широких пределах: от 0,01 г/л в атмосферных осадках до 600 г/л в рассолах.
К числу главных ионов солей, находящихся в природных водах, относятся: 1. Отрицательно заряженные ионы (анионы):
2. Положительно заряженные ионы (катионы) :
кальция Са 2+ , магния Ме 2+ , натрия Ка + и калия К + .
Все природные воды делятся по преобладающему аниону на три класса: гидрокарбонатный, сульфатный и хлоридный;
по преобладающему катиону на три группы: кальциевую, магниевую, натриевую.
Природные воды различного происхождения обычно имеют и различный солевой состав и относятся соответственно к разным классам и группам.
Речные воды , как правило, относятся к гидрокарбонатному классу и кальциевой группе.
Подземные воды нередко относятся к сульфатному классу и магниевой группе.
Воды океанов и морей принадлежат к хлоридному классу и натриевой группе.
Сумма концентрации наиболее распространенных двухвалентных катионов Са 2+ и Мg 2+ называется общей жесткостью воды.
Повышенная жесткость обусловлена растворением в воде горных пород, содержащих карбонаты и сульфаты кальция и магния.
Наиболее распространенные газы, растворенные в природных водах,— это кислород О2, азот N3, диоксид углерода С02, сероводород Н2S.
Газы хорошо растворяются в воде, если способны вступать с ней в химические связи. К таким газам относятся: аммиак NН3, сероводород Н2S, сернистый газ SО2, диоксид (двуокись) углерода, или углекислый газ СО2, и др.).
Прочие газы мало растворимы в воде.
При понижении давления, повышении температуры и увеличении солености растворимость газов в воде уменьшается.
Источниками поступления газов в воду служат:
— жизнедеятельность растений (О2),
— разложение органического вещества (СО2, СН4э Н25).
На практике нередко пользуются относительной характеристикой содержания в воде растворенных газов — процентом насыщения (А) — отношение фактического содержания газа (Ф) к равновесной концентрации (Р) в воде при данной температуре.
где Ф — фактическое содержание газа,
Р — его равновесная концентрация в воде при данной температуре.
Если фактическое содержание газа в поверхностном слое воды больше равновесной концентрации и величина А >100 %, то происходит выделение газа в атмосферу.
Если вода не насыщена газом и А радиоактивные вещества естественного (калий 40 К, рубидий 87 Rb, уран 258 U), радий 226 Rа и др.) и антропогенного (стронций 90 Sr, цезий 137 Сsи др.) или смешанного происхождения.
Таким образом, содержащиеся в растворенном состоянии в воде ионы солей, газы, биогенные и органические вещества, микроэлементы различаются как по концентрации, так и по роли в физических, химических и биологических процессах в водной среде.
Особую категорию содержащихся в воде соединений составляют так называемые загрязняющие вещества (3В), оказывающие вредное воздействие на живую природу и жизнедеятельность человека.
Это прежде всего нефтепродукты, ядохимикаты (пестициды, гербициды), удобрения, моющие средства (детергенты), некоторые микроэлементы (очень токсичны тяжелые металлы — ртуть, свинеци кадмий), радиоактивные вещества.
Большая часть загрязняющих веществ имеет антропогенное происхождение, хотя существуют и естественные источники загрязнения природных вод.
Особенности химического (и биологического) состава природных вод вместе с некоторыми их физическими свойствами, о которых речь пойдет ниже, часто объединяются в понятие «качество воды», при этом обычно имеют в виду пригодность вод для какого-либо использования.
Поэтому качество воды — характеристика состава и свойств воды, определяющая пригодность ее для конкретного водопользования.
3. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
Агрегатные состояния воды и фазовые переходы
Вода может находиться в трех агрегатных состояниях, или фазах,—
жидком (собственно вода),
газообразном (водяной пар).
Очень важно, что при реально существующих на Земле диапазонах атмосферного давления и температуры вода может находиться одновременно в разных агрегатных состояниях. В этом отношении вода существенно отличается от других физических веществ, находящихся в естественных условиях преимущественно либо в твердом (минералы, металлы), либо в газообразном (О2, Н2, СО2 и т. д.) состоянии.
Изменения агрегатного состояния вещества называют фазовыми переходами. В этих случаях свойства вещества (например, плотность) скачкообразно изменяются. Фазовые переходы сопровождаются выделением или поглощением энергии, называемой теплотой фазового перехода («скрытой теплотой»).
При давлении 610 Па и температуре 0,01 °С вода одновременно находится во всех трех агрегатных состояниях.
При нормальном атмосферном давлении (1,013 10 5 Па= 1,013 бар = 1 атм = 760 мм рт. ст.)
t замерзания воды (плавления льда) = 0 0 С
tкипения (конденсации) = 100 °С.
Температура замерзания и температура кипения воды зависят от давления.
1 амт=670 мм – от 0 до 0,01 0 С
2200 атм — -22 0 С
Последнее означает, что лед в нижней части толщи ледника, находящийся под давлением, может таять даже при небольшой отрицательной температуре.
При дальнейшем увеличении давления — быстро возрастает.
На максимальных глубинах в океане (около11 км) давление превышает 10 8 Па (увеличение глубины на каждые 10 м увеличивает давление приблизительно на 10 Па). При таком давлении температура замерзания пресной воды была бы около -12 °С.
На снижение температуры замерзания воды оказывает влияние ее соленость Увеличение солености на каждые 10 ‰при атмосферном давлении снижаетприблизительно на 0,54°С.
Температура кипения с уменьшением давления снижается, поэтому на больших высотах в горах вода кипит при температуре ниже, чем 100 °С.
При росте давления tкип. возрастает до так называемой «критической точки»
при Р = 2.2 10 -7 Па tкип. = 374 0 С
вода одновременно имеет свойства и жидкости и газа
Плотность — главнейшая физическая характеристика любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу его объема:
Плотность воды, как и других веществ, зависит, прежде всего, от температуры и давления (а для природных вод — еще и от содержания растворенных и тонкодисперсных взвешенных веществ) и скачкообразно изменяется при фазовых переходах.
При повышении температуры плотность воды, как и любого другого вещества, в большей части диапазона изменения температуры уменьшается (т.к. увеличивается расстояния между молекулами при росте температуры). Эта закономерность нарушается лишь при плавлении льда и при нагревании воды в диапазоне от 0 до 4°С (точнее 3,98 °С). Здесь отмечаются еще две очень важные «аномалии» воды:
1) плотность воды в твердом состоянии (лед) меньше, чем в жидком (вода), чего нет у подавляющего большинства других веществ,
2) в диапазоне температуры воды от 0 до 4 °С плотность воды с повышением температуры не уменьшается, а увеличивается .
Эти две «аномалии» воды имеют огромное гидрологическое значение: лед легче воды и поэтому «плавает» на ее поверхности; водоемы обычно не промерзают до дна, так как охлажденная до температуры ниже 4 °С пресная вода становится менее плотной и поэтому остается в поверхностном слое.
Плотность воды изменяется также в зависимости от содержания в ней растворенных веществ (солености) и увеличивается с ростом солености.
Увеличение солености на каждые 10 ‰ снижает температуру наибольшей плотности приблизительно на 2 °С.
Соотношения между температурами наибольшей плотности и замерзания влияют на характер процесса охлаждения воды и вертикальной конвекции — перемешивания, обусловленного различиями в плотности. Охлаждение воды в результате теплообмена с воздухом приводит к увеличению плотности воды и, соответственно, к опусканию более плотной воды вниз. На ее место поднимаются более теплые и менее плотные воды. Происходит процесс вертикальной плотностной конвекции.
Таким образом, в пресных или солоноватых водах зимой в придонных горизонтах температура воды оказывается выше, чем на поверхности и всегда выше температуры замерзания.
Это обстоятельство имеет огромное значение для сохранения жизни в водоемах на глубинах. Если бы у воды температуры наибольшей плотности и замерзания совпадали бы, как у всех других жидкостей, то водоемы могли промерзать до дна, что привело бы к неизбежной гибели большинства организмов.
Аномальное изменение плотности воды при изменении температуры влечет за собой такое же «аномальное» изменение объема воды :
— с возрастанием температуры от 0 до 4 °С объем химически чистой воды уменьшается, и лишь при дальнейшем повышении температуры — увеличивается;
— объем льда всегда заметно больше объема той же массы воды (вспомним, как лопаются трубы при замерзании воды).
Некоторое влияние на плотность воды оказывает также давление. Сжимаемость воды очень мала, но она на больших глубинах в океане все же сказывается на плотности воды. На каждые 1000 м глубины плотность вследствие влияния давления столба воды возрастает на 4,5—4,9 кг/м 3 .
Если бы вода была совершенно несжимаемой, уровень Мирового океана стоял бы на 30 м выше, чем в действительности.
Тепловые свойства воды
К важным особенностям изменения агрегатного состояния воды или так называемых фазовых переходов относятся большая затрата теплоты на плавление, испарение, кипение, возгонкуи большое выделение теплоты при обратных переходах.
В сравнении с другими веществами удельная теплота плавления льда и удельная теплота парообразования аномально высоки. Они представляют две очередные «аномалии» воды.
Удельная теплота плавления пресного льда Lпл– количество теплоты, затрачиваемое при превращении единицы массы льда при температуре плавления и нормальном атмосферном давлении в воду = 333 000 Дж/кг.
Столько же теплоты выделяется при замерзании (кристаллизации)
химически чистой воды.
Удельная теплота парообразования (испарения) LИСП — количество теплоты, необходимое для превращения единицы массы воды в пар (в Дж/кг)) зависит от температуры:
При 0 и 100 °С 1ИСП равны соответственно 2,510 6 и 2,26х х 10 6 Дж/кг.
Столько же теплоты выделяется при конденсации водяного пара.
Удельная теплота испарения льда (возгонки) складывается из удельной теплоты плавления и удельной теплоты испарения:
Для нагревания воды вне точек фазовых переходов необходимо затратить большое количество теплоты.
Удельная теплоемкость воды — количество теплоты, необходимое для нагревания единицы массы воды на один градус.
Удельная теплоемкость также аномально высока по сравнению с теплоемкостью других жидкостей и твердых веществ.
Удельная теплоемкость воды при постоянном давлении, при 15 °С
С увеличением содержания в воде солей удельная теплоемкость воды слабо уменьшается. Поэтому теплоемкость морской воды немного меньше, чем пресной.
Отмечается также небольшое уменьшение удельной теплоемкости воды с увеличением давления, что также имеет некоторое значение для тепловых процессов в толще океана.
Таким образом, отмеченные аномальные особенности тепловых свойств воды способствуют теплорегуляции процессов на Земле. При меньших значениях tпл, tисп поверхность Земли нагревалась бы и охлаждалась гораздо быстрее, возрос бы и диапазон изменения температуры. В таких условиях вся вода на Земле то замерзала бы, то испарялась, гидросфера имела бы совсем иные свойства, а жизнь в таких условиях вряд ли была бы возможна.
Из других тепловых свойств воды важное значение имеет теплопроводность.
Молекулярная теплопроводность воды очень мала, меньшую молекулярную теплопроводность имеет лишь воздух.
Малая теплопроводность воды способствует ее медленному нагреванию и охлаждению.
Снег предохраняет почву, а лед — водоемы от промерзания.
Передача теплоты в воде рек, озер и морей происходит в основном благодаря турбулентной (при динамическом перемешивании), а не молекулярной теплопроводности.
Некоторые другие физические свойства воды
Молекулярная вязкость воды (внутреннее трение).
Источник