Химия, Биология, подготовка к ГИА и ЕГЭ
Размышления ( не учебный материал . ) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
свойства молекулы воды
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
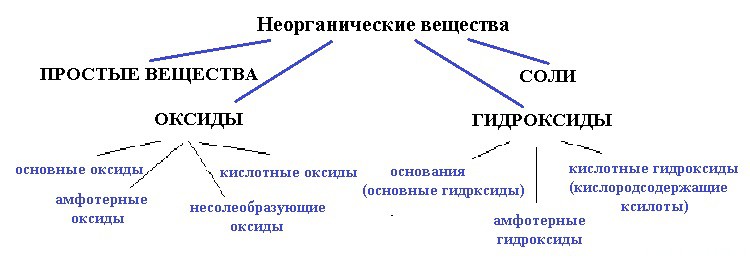
Ниже приведена схема:
вода — точно не простое вещество, так как образована атомами разных элементов;
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2H2 + O2 → 2H2O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
Взаимодействие с кислотами.
Взаимодействие с кислотными оксидами.
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
Взаимодействие со щелочами.
Взаимодействие основными оксидами.
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу : реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H + и анион OH — .
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: H2O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
Взаимодействие с амфотерными гидроксидами.
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
Реакции с металлами.
Реакции с основными и амфотерными оксидами.
Реакции с основаниями и амфотерными гидроксидам.
Реакции с солями.
Для сильных кислот так же реакции ионного обмена.
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H2↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H + и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H2↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Сформулируем основные положения теории «Вода — кислота»:
Молекула воды по свойствам — слабая (очень слабая) кислота.
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
Вода как кислота образует соли — гидроксаты.
К гидроксатам относятся амфотерные и основные гидроксиды.
Формула воды: HOH.
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Источник
Вода в нашей жизни
Продолжение. Начало см. в № 3, 4/2009
§ 2. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ

Форма занятия. Лекция с элементами беседы, демонстрационный эксперимент исследовательского характера, лабораторная работа, тест.
Оборудование и реактивы. Химические стаканы, пробирки, индикаторы; растворы хлорида и карбоната натрия, хлорида цинка, сульфата магния, оксиды кальция и фосфора(V).
В курсе химии за 8-й класс (учебно-методический комплект О.С.Габриеляна) представлены некоторые химические свойства этого соединения при изучении темы «Типы химических реакций на примере свойств воды». На данном уроке предстоит не только повторить, но и расширить представления учащихся о химических свойствах воды.
- Окислительно-восстановительные свойства.
- Кислотно-основные свойства.
- Реакции гидратации.
- Реакции гидролиза.
Учитель. В молекуле воды и водород, и кислород находятся в устойчивых степенях окисления, соответственно +1 и –2. Поэтому вода не обладает ярко выраженными окислительно-восстановительными свойствами. Они проявляются при взаимодействии воды только с очень активными восстановителями или окислителями.
В роли окислителя вода выступает с такими сильными восстановителями, как щелочные и щелочно-земельные металлы. Взаимодействие протекает при обычной температуре:
Учащиеся комментируют записанные схемы, указывая изменение степеней окисления, определяют окислители и восстановители, процессы окисления и восстановления.
Ученик. Реакция с натрием протекает бурно, поэтому не случайно во всех инструкциях по технике безопасности особо указывается, что при возникновении пожара на складе с натрием нельзя применять воду.
Ученики поясняют, что выделяющийся водород при определенных условиях загорается и реагирует с кислородом воздуха, что может привести к взрыву.
Учитель. Образование воды – экзотермическая реакция, при большой концентрации водорода в воздухе происходит взрыв. Ученые приложили немало усилий и направили разрушительную силу гремучей смеси (так называется соотношение объемов водорода и кислорода 2:1) на практические цели. Например, ни одна ракета не покинула бы территорию космодрома, если бы при этом не образовывалась… вода. В момент запуска космического аппарата энергия направленного взрыва водорода и кислорода является своеобразным «запалом», а дальнейшее движение осуществляется за счет горения сложной смеси ракетного топлива (гептила), которое содержит и некоторые токсические компоненты.
При нагревании протекает взаимодействие водяного пара и с менее активными металлами:
Последняя реакция (в присутствии атмосферного кислорода) является причиной коррозии металла, перед которой не устоять трубопроводам, мостам и другим металлическим конструкциям. Химики-технологи разработали достаточно эффективные способы замедления коррозии, но до полной победы над ней еще далеко. Вездесущая влага рано или поздно проникает через защитные покрытия и разрушает сплавы железа, принося многомиллионные убытки.
Кроме того, вода взаимодействует с гидридами щелочных и щелочно-земельных металлов, являющимися очень сильными восстановителями:
Данной реакцией очень удобно пользоваться в полевых условиях, если возникает необходимость в получении водорода, например при заправке гидрометеорологических шаров-зондов.
Вода выступает в роли восстановителя с сильными окислителями, например со фтором:
Эта реакция, проведенная в изолированных условиях, из-за ядовитости галогена, очень удивила ученых. В атмосфере фтора вода сгорала голубоватым пламенем.
Ничего нет вечного и в химии – при температуре выше 1000 °С водяной пар разлагается на водород и кислород, т.е. происходит внутримолекулярный окислительно-восстановительный процесс:
В природных условиях разложение воды по данной схеме ничтожно мало, столь высокие температуры создаются только при грозовых разрядах.
Многие научные коллективы пытаются найти практическое применение данной реакции и решить ряд энергетических и экологических проблем. Если в будущем появится удачное техническое решение, то автомобилисты вместо бензина начнут заливать в бак простую воду, она будет разлагаться на составляющие компоненты и соединяться вновь. Как известно, взаимодействие водорода и кислорода сопровождается выделением энергии, ее с лихвой хватит на движение автомобиля. В крупных городах население наконец-то получит возможность дышать свежим воздухом, ведь из выхлопной трубы будет выделяться только водяной пар. В нашем ХХI в. это уже не фантастика, опытные образцы подобных двигателей созданы, но они достаточно громоздки и пока намного дороже автомобилей с бензиновым двигателем.
Учитель. В самих названиях «кислота» и «основание» уже заложен намек на агрессивность соединений.
Не зря гласит пословица: «в тихом омуте черти водятся». Ей можно дать и химическое толкование – в обычной воде присутствуют одновременно и кислота, и основание. Это происходит в ходе своеобразной борьбы молекул воды друг с другом. Одна из шустрых молекул «умудряется» вырвать у соседки протон и присвоить его себе. При этом «хулиганка» превращается в ион гидроксония, т.е. кислоту, а «пострадавшая» молекула становится гидроксид-ионом, т.е. основанием. Такому явлению присвоено особое название – самоионизация. Данный процесс связан с тепловым движением частиц и взаимным притяжением диполей. Происходит ослабление и разрыв связей О–Н, в итоге протон присоединяется к атому кислорода соседней молекулы по донорно-акцепторному механизму:
В сущности, ион гидроксония является гидратированным ионом водорода Н + •Н2О. Упрощенно процесс ионизации воды обычно выражают следующим уравнением:
Таким образом, при ионизации одновременно образуются катионы водорода и гидроксид-
анионы, т.е. вода является слабым амфотерным электролитом. Легко заметить, что ионы образуются в равном соотношении и при диссоциации воды реакция среды нейтральна.
Степень ионизации воды незначительна. При комнатной температуре лишь одна из 10 8 молекул воды находится в диссоциированной форме, что подтверждается весьма низкой электропроводностью чистой воды. Вода – не просто слабый, а очень слабый электролит. Концентрации ионов Н + и ОН – в воде равны 10 –7 моль/л. Вода не проявляет явно выраженных кислотных или основных свойств. Однако этот «нейтралитет» достаточно условен. Если химическим методом связывать один из ионов, т.е. смещать равновесие реакции самоионизации, можно создавать в водных растворах кислую или шелочную среду. Далее мы узнаем, что такие процессы имеют немаловажное значение.
Вода оказывает сильное ионизирующее действие на растворяемые в ней электролиты. Под действием диполей воды полярные ковалентные связи в молекулах растворенных веществ превращаются в ионные. В частности, на этих свойствах воды основана работа многих аккумуляторов.
Учитель. Полярность и малые размеры молекулы воды определяют ее сильные гидратирующие свойства.
Гидратация – это присоединение воды к веществу.
Учащиеся записывают схемы реакций кислотных оксидов с водой:
CО2 + H2O 
Демонстрационный эксперимент «Взаимодействие оксидов с водой»
Учитель предлагает ученикам помочь лаборанту различить содержимое склянок, на которых испорчены этикетки. Предположительно, в них содержались оксиды кальция и фосфора.
Двое учащихся выполняют демонстрационный эксперимент, добавляя в стаканчики с небольшой порцией белых порошков (0,5 г) воду. Остается только проверить кислотность среды и записать на доске соответствующие уравнения:
Учитель. Многие виды гидратации имеют практическое значение. С их помощью в промышленности получают азотную, серную кислоты. В строительном деле, например, не обойтись без оксида кальция (негашеной извести). При добавлении воды образуется соответствующий гидроксид – гашеная известь, которая применяется в смесях для побелки, строительных растворах для кладки кирпичных стен.
Оксид фосфора(V) очень активно связывает воду и часто необходим для полной осушки некоторых органических растворителей. Данному процессу присвоен особый термин – абсолютирование. Для некоторых синтезов ученые используют абсолютно сухие вещества, нередко химики проводят реакции при полном отсутствии влаги в реакционной среде и даже вынуждены осушать воздух или какой-либо инертный газ оксидом фосфора(V) или концентрированной серной кислотой.
Учитель. Гидролизом называется процесс разложения веществ в результате обменного взаимодействия между молекулами вещества и молекулами воды.
По своей сути гидролиз – это «насильственное» связывание одного из ионов, образующихся при диссоциации воды, которое приводит к изменению кислотности растворов.
Различают несколько типов гидролиза.
1) Гидролиз по аниону характерен для соли, образованной сильным основанием и слабой кислотой:
Без этой полезной реакции сложно представить стирку белья в жесткой воде. Сходно гидролизуется и питьевая сода – гидрокарбонат натрия. Именно за счет щелочной среды «работают» содовые лечебные растворы. Они используются для полоскания полости рта в случае воспалительных процессов. В экстренных случаях раствор питьевой соды применяется при изжоге, вызванной повышенной кислотностью желудочного сока.
Труднорастворимые соли тоже подвергаются гидролизу, но он идет очень медленно. Так, при внесении в кислые почвы извести – карбоната кальция, постепенно идет гидролиз, выделяющиеся гидроксид-ионы участвуют в устранении кислотности почвы. В конечном счете, плодородие почвы восстанавливается. Это имеет большое значение для растениеводства, т.к. многие сельскохозяйственные культуры плохо развиваются на кислых почвах.
Нерациональное вмешательство в природу нередко приводит к трагическим последствиям. Так, в районах, прилегающих к озеру Баскунчак, очень велика кислотность почв. Вспашка таких целинных земель нередко сопровождается пыльными бурями, которые рассеивают по окрестностям много солей, подвергающихся гидролизу.
2) Гидролиз по катиону протекает с солями, образованными слабым основанием и сильной кислотой:
3) Гидролиз по катиону и аниону характерен для солей, образованных слабым основанием и слабой кислотой:
Карбонаты и ацетаты аммония используются в производстве кондитерских изделий как разрыхлители, их добавляют в тесто для придания воздушности выпечке. Под действием высокой температуры гидролиз усиливается, газообразные продукты (углекислый газ и аммиак) улетучиваются и придают дополнительную рыхлость кондитерскому изделию. Любителям домашней выпечки полезно читать информацию на пакетиках с разрыхлителями. Так, обозначение Е-503 свидетельствует о содержании в них карбоната аммония.
4) Необратимый (полный) гидролиз:
Al2S3 + 6HOН = 2Al(OH)3 

В этом случае ионы водорода связываются в летучую кислоту, а гидроксид-анионы – в малодиссоциирующее соединение, т.е. сульфид алюминия в растворах практически не существует. В таблице растворимости такие соли отмечены знаком «минус».
Для закрепления материала проводится эксперимент.
Лабораторная работа «Распознавание солей»
Учитель предлагает распознать вещества. В пробирки налиты растворы хлорида и карбоната натрия, хлорида цинка, сульфата магния. Последние растворы выдают себя характерной окраской при добавлении индикатора.
Учитель предлагает пояснить причину использования соды при стирке белья и записать в тетрадях схемы гидролиза карбоната натрия, сульфата магния, хлорида цинка.
Учитель. Реакции гидролиза сложных соединений лежат и в основе обмена веществ в организме человека и животных. Например, гидролиз белков представляет собой сложный многостадийный процесс, конечным продуктом которого являются аминокислоты – строительный материал всех тканей организма. Гидролиз сахарозы, которую мы добавляем в чай или кофе, проходит до глюкозы – ценного питательного и энергетического вещества. Аналогично, до глюкозы, протекает и многоступенчатый гидролиз крахмала, входящего в состав многих продуктов питания (изделий из муки, риса, картофеля). Реакции гидролиза в организме протекают под действием биологических катализаторов – ферментов. Без воды невозможно представить обменные процессы в живом организме. Не случайно в медицинских вузах очень большое внимание уделяется изучению химии – органической и биологической.
После завершения лекции ученикам предлагается домашняя работа по выполнению тестов, позволяющих проверить знания по химическим свойствам воды.
Вопросы для собеседованияпо теме «Химические свойства воды»
1. Напишите уравнения химических реакций, отражающие окислительные свойства воды.
2. Приведите примеры химических реакций, в которых вода проявляет восстановительные свойства.
3. Допишите уравнения химических реакций:
4. Почему вода является амфотерным соединением?
5. Приведите уравнения химических реакций гидролиза в молекулярной и ионной формах для солей, которые гидролизуются по: а) катиону; б) аниону; в) катиону и аниону.
6. Для каких веществ гидролиз протекает необратимо? Приведите примеры такого гидролиза для солей и других бинарных соединений.
7. Известные пословицы гласят: «Вода и камень точит», «Вода разбивает камень не силой, а частым падением». Можно ли пояснить их с позиций физических и химических процессов?
8. Какое из удобрений следует применить агроному для нейтрализации кислотности почв: а) кальциевую селитру – Са(NО3)2; б) известь – СаСО3; в) калийную селитру – KNО3? Ответ поясните.
Тест «Химические свойства воды»
1. При комнатной температуре с водой реагируют оба металла, указанные в паре:
а) барий и медь; б) кальций и литий;
в) алюминий и ртуть; г) серебро и натрий.
2. К реакции замещения относится взаимодействие воды:
а) с гидридом калия;
б) с оксидом серы(VI);
в) с натрием металлическим;
г) с оксидом кальция.
3. Обменное взаимодействие веществ с водой, приводящее к их разложению, называют:
а) гидрированием; б) гидрогенизацией;
в) гидролизом; г) гидратацией.
4. Вода не образуется в результате химической реакции между:
а) соляной кислотой и гидроксидом калия;
б) оксидом кальция и азотной кислотой;
в) гидроксидом натрия и оксидом углерода(IV);
г) нитратом серебра и соляной кислотой.
5. Какие два оксида при взаимодействии с водой образуют соответствующие им кислоты?
6. Укажите оксид, образующий при растворении в воде две кислоты:
7. При обычной температуре в химическую реакцию с водой не вступает:
а) оксид серы(IV); б) хлорид аммония;
в) оксид кальция; г) хлорид натрия.
8. Вода – это не только оксид водорода, но и оксид:
а) основный; б) амфотерный;
в) несолеобразующий; г) кислотный.
9. Масса воды (в г), которая образуется при нейтрализации 2 моль гидроксида натрия соляной кислотой, равна:
а) 18; б) 54; в) 9; г) 36.
10. С какой парой веществ взаимодействует вода:
Источник