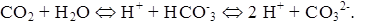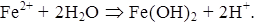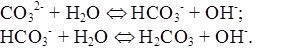- определение качества водопроводной воды оргонолиптическими методами
- Скачать:
- Подписи к слайдам:
- 1. Водоемы и показатели качества воды
- 1. Водоемы и показатели качества воды
- 1.2. Показатели экологического состояния водоемов и качества поверхностных вод
- 1.2.3. Гидрохимические показатели воды
- Cостав воды
- Химические свойства воды
- Окисляемость
- Показатель pH
- Жесткость воды
- Аммиак
- Нитриты
- Нитраты
- Хлориды
- Сульфаты
- Железо
- Щелочность
- Кальций
- Алюминий
- Магний
- Натрий
- Марганец
- Хлор остаточный
- Углеводороды (нефтепродукты)
- Полифосфаты
- Кремний
- Сульфиды и сероводород
- Стронций
определение качества водопроводной воды оргонолиптическими методами
исследовательская работа по экологии»Определение качества водопроводной воды оргонолиптическими методами «.
представлены самые доступные методы по определению качества водопроводной воды окрестностей города Райчихинска.
Скачать:
| Вложение | Размер |
|---|---|
| исследовательская работа по экологии | 214.5 КБ |
Предварительный просмотр:
Подписи к слайдам:
Тема: Качественный анализ водопроводной воды микрорайона Северный и поселка Восточный. г. Райчихинск 2012г.
Цель: Провести качественный анализ водопроводной воды микрорайона Северный и п. Восточный. Задачи: Определить свойства воды органолептическими методами (цвет и запах). Выявить содержание ионов различных металлов (железо, медь, марганец). Определить пригодность воды к использованию в быту.
Уникальные свойства воды 1- Растворимость 2- Теплопроводность. 3- Память .
Определение свойств воды органолептическими методами. Определение цвета: Наполним цилиндр водой до высоты 10-12 см и поставим его на белый экран. Определим цвет и интенсивность окрашивания воды, рассматривая ее сверху при достаточном боковом освещении. Отметем в таблице наиболее подходящий цвет значком.
Определение запаха: В колбу нальем 100 мл анализируемой воды ( t – 20оС). Накроем стеклом и встряхнем колбу вращательными движениями. Сдвинув в сторону стекло, определим характер и интенсивность запаха. Нагреем колбу с водой на водяной бане до температуры 60оС и повторно определим запах описанным выше способом.
Определение характера запаха воды: Характер запаха Искусственного происхождения неотчетливый (или отсутствует) нефтепродуктов (бензиновый) хлорный уксусный фенольный другой (укажите, какой) Естественного происхождения неотчетливый (или отсутствует) землистый гнилостный плесневый торфяной травянистый другой (укажите, какой)
Определение интенсивности запаха воды: Характер проявления запаха Запах не ощущается. Запах сразу не ощущается, но обнаруживается при нагревании воды. Запах обнаруживается, ели обратить на это внимание. Запах легко обнаруживается и вызывает неодобрительный отзыв о воде. Запах обращает на себя внимание и заставляет воздержаться от питья. Запах настолько сильный, что делает воду непригодной к употреблению. Интенсивность запаха Оценка интенсивности запаха нет очень слабая слабая заметная отчетливая очень сильная 0 1 2 3 4 5 Определение интенсивности запаха воды:
Определение содержания ионов различных металлов. Качественное определение ионов железа (общего): Отмеряем мерным цилиндром и наливаем в одну пробирку 10 мл дистиллированной воды, а во вторую пробирку – 10 мл водопроводной воды. В обе пробирки добавляем по 2-3 капли азотной кислоты, а затем по 0,5 мл 50%-го раствора роданида калия ( KSCN ). Розовая окраска появляется при концентрации железа, равной 0,1 мг/л, красная – при более высоком содержании.
Качественное определение ионов Fe 2+ : К 1 мл исследуемой воды добавляем 2 – 3 капли раствора серной кислоты и 2 – 3 капли раствора гексацианоферрата (Ш) калия К3[ Fe ( CN )6] в кислой среде (рН = 3). В присутствии ионов Fe 2+ появляется осадок турнбулевой сини темно-синего цвета.
Качественное определение ионов Fe 3+ : К 1 мл исследуемой воды добавляем 1 – 2 капли раствора соляной кислоты и 2 капли раствора гексацианоферрата (П) калия K 4[ Fe ( CN )6] в слабокислой среде. В присутствии ионов Fe 3+ образуется темно-синий осадок берлинской лазури.
Качественное определение ионов С u 2+ В фарфоровую чашку поместим 3 – 5 мл исследуемой воды, осторожно выпарем досуха и на периферийную часть пятна нанесем каплю концентрированного раствора аммиака. Появление интенсивно синей или фиолетовой окраски свидетельствует о присутствии ионов Cu 2+.
Качественное определение ионов Mn 2+ : Поместим в колбу 25 мл исследуемой воды, подкислим несколькими каплями 25%-го раствора азотной кислоты. Прибавим по каплям 2%-ый раствор нитрата серебра до появления помутнения. Добавим несколько кристалликов диоксида свинца и нагреем до кипения. В присутствии марганца при концентрации 0,1 мг/л и выше появляется бледно-розовая окраска.
Содержание ионов Fe в воде пробы №1 (п. Восточный). общее содержание ионов железа составляет более 0,1 мг/л присутствие ионов F е3+
Содержание ионов Fe в воде пробы №2 (мик-он Северный, р-он МОУ СОШ №22). общее содержание ионов железа равно 0,1 мг/л. присутствие ионов Fe 2+
Содержание ионов Fe в воде пробы №3 (мик-он Северный, ул. Литовченко). общее содержание ионов железа более 0,1 мг/л. присутствие ионов Fe 3+
ВЫВОДЫ: 1). Проведено определение свойств воды органолептическими методами: цвет и запах имеет вода взятая в колонке п. Восточный. 2).В процессе исследования определено присутствие ионов железа ( Fe 2+, Fe 3+). Наличие ионов меди и марганца не обнаружено. 3). Согласно шкале предельно допустимой концентрации веществ в воде, все взятые мною пробы водопроводной воды соответствуют хозяйственно-бытовым источникам. Вода пригодна для питья и бытовых нужд населения.
Источник
1. Водоемы и показатели качества воды
А.Н. Петин, М.Г. Лебедева, О.В. Крымская
Анализ и оценка качества поверхностных вод
Учебное пособие. – Белгород: Изд-во БелГУ, 2006. – 252 с.
1. Водоемы и показатели качества воды
1.2. Показатели экологического состояния водоемов и качества поверхностных вод
1.2.3. Гидрохимические показатели воды
Данная группа включает показатели, свойственные воде в ее естественном (природном) состоянии, характеризующие химический состав воды и определяемые, как правило, гидрохимическими методами. В число основных гидрохимических показателей качества воды входят: водородный показатель (рН), растворенный кислород, минерализация (анионы – карбонаты, гидрокарбонаты, сульфаты, хлориды; и катионы – кальций, магний, натрий и калий), сухой остаток, общая жесткость, биогенные элементы (нитраты, фосфаты, аммоний, нитриты), фториды, железо общее. Количественные данные по этим показателям занимают значительное место в совокупности данных о состоянии водного объекта и могут быть определены без серьезных трудностей полевыми и лабораторными методами, при соблюдении правил отбора и хранения проб.
Водородный показатель (рН). Содержание ионов водорода (гидроксония – H3O + ) в природных водах определяется в основном количественным соотношением концентраций угольной кислоты и ее ионов:
Для удобства выражения содержания водородных ионов была введена величина, представляющая собой логарифм их концентрации, взятый с обратным знаком:
Для поверхностных вод, содержащих небольшие количества диоксида углерода, характерна щелочная реакция. Изменения pH тесно связаны с процессами фотосинтеза (при потреблении CO2 водной растительностью высвобождаются ионы ОН – ). Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Гидролиз солей тяжелых металлов играет роль в тех случаях, когда в воду попадают значительные количества сульфатов железа, алюминия, меди и других металлов:
Значение pH в речных водах обычно варьирует в пределах 6,5–8,5, в атмосферных осадках 4,6–6,1, в болотах 5,5–6,0, в морских водах
7,9–8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина pH для большинства речных вод составляет 6,8–7,4, летом 7,4–8,2. Величина pH природных вод определяется в некоторой степени геологией водосборного бассейна.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения величина pH не должна выходить за пределы интервала значений 6,5–8,5.
Величина pH воды – один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины pH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В водоеме можно выделить несколько этапов процесса его закисления. На первом этапе рН практически не меняется (ионы бикарбоната успевают полностью нейтрализовать ионы Н + ). Так продолжается до тех пор, пока общая щелочность в водоеме не упадет примерно в 10 раз до величины менее 0,1 моль/дм 3 .
На втором этапе закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года. О таких водоемах говорят как об умеренно кислых. На этом этапе закисления происходят значительные изменения в видовом составе живых организмов.
На третьем этапе закисления водоема рН стабилизируется на значениях рН 8,5 (CO3 2- , S2 – , PO4 3- , SiO3 2- и др.);
2) слабые основания и анионы летучих и нелетучих слабых кислот (HCO3 – , H2PO4 – , CH3COO – , HS – , анионы гуминовых кислот и др.).
Щелочность обусловлена наличием в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов). Их сумма называется общей щелочностью. Ввиду незначительной концентрации трех последних ионов общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы, гидролизуясь, образуют гидроксид-ионы:
Щелочность определяется количеством сильной кислоты, необходимой для нейтрализации 1 дм 3 воды. Щелочность большинства природных вод определяется только гидрокарбонатами кальция и магния, pH этих вод не превышает 8,3.
Определение щелочности полезно при дозировании химических веществ, необходимых на обработку вод для водоснабжения, а также при реагентной очистке некоторых сточных вод. Определение щелочности при избыточных концентрациях щелочноземельных металлов важно для установлении пригодности воды для ирригации. Вместе со значениями рН щелочность воды служит для расчета содержания карбонатов и баланса угольной кислоты в воде.
Щелочность пробы воды измеряется в г-экв/л или мг-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 г-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочью. При нейтрализации до значений рН 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая таким образом величина называется общей щелочностью. При рН 4,5 проба воды имеет нулевую щелочность.
Источник
Cостав воды
Химические свойства воды
Окисляемость
Окисляемость показывает количество кислорода в миллиграммах, необходимого для окисления органических веществ, содержащихся в 1 дм³ воды.
Воды поверхностных и подземных источников имеют разную окисляемость — у подземных вод величина окисляемости незначительна, за исключением болотных вод и вод нефтяных месторождений. Окисляемость горных рек ниже, чем равнинных. Наибольшая величина окисляемости (до десятков мг/дм³) — у рек с питанием болотными водами.
Величина окисляемости закономерно изменяется в течение года. Окисляемость характеризуется несколькими величинами — перманганатной, бихроматной, йодатной окисляемостью (в зависимости от того, какой окислитель используется).
ПДК окисляемости воды имеют следующие значения: химическое потребление кислорода или бихроматная окисляемость (ХПК) водоемов питьевого назначения не должна превышать 15 мг О₂ /дм³. Для водоемов в зонах рекреации величина ХПК не должна превышать 30 мг О₂ /дм³.
Показатель pH
Водородный показатель (pH) природной воды показывает количественное содержание в ней угольной кислоты и ее ионов.
Санитарно-гигиенические нормативы для водоемов разного типа водопользования (питьевого, рыбохозяйственного, рекреационных зон) устанавливают ПДК pH в интервале 6,5-8,5.
Концентрация ионов водорода, выраженная величиной pH — один из важнейших показателей качества воды. Величина pH имеет решающее значение при протекании многочисленных химических и биологических процессов в природной воде. Именно от величины pH зависит, какие растения и организмы будут развиваться в данной воде, каким образом будет происходить миграция элементов, от этой величины также зависит степень коррозионной активности воды на металлические и бетонные конструкции.
От величины pH зависят пути превращения биогенных элементов и степени токсичности загрязняющих веществ.
Жесткость воды
Жесткость природной воды проявляется вследствие содержания в ней растворенных солей кальция и магния. Суммарное содержание ионов кальция и магния является общей жесткостью. Жесткость можно выражать несколькими единицами измерения, на практике чаще используют величину мг-экв/дм³.
Высокая жесткость ухудшает бытовые характеристики и вкусовые свойства воды, оказывает неблагоприятное воздействие на здоровье человека.
ПДК по жесткости питьевой воды нормируется величиной 10,0 мг-экв/дм³.
К технической воде отопительных систем предъявляют более строгие требования по жесткости их-за вероятности образования накипи в трубопроводах.
Аммиак
Присутствие аммиака в природной воде обусловлено разложением азотсодержащих органических веществ. Если аммиак в воде образуется при разложении органических остатков (фекальное загрязнение), то такая вода непригодна для питьевых нужд. Аммиак определяется в воде по содержанию ионов аммония NH₄⁺.
ПДК аммиака в воде составляет 2,0 мг/дм³.
Нитриты
Нитриты NO₂⁻ являются промежуточным продуктом биологического окисления аммиака до нитратов. Процессы нитрификации возможны только в аэробных условиях, в противном случае природные процессы идут по пути денитрификации — восстановления нитратов до азота и аммиака.
Нитриты в поверхностных водах находятся в виде нитрит-ионов, в кислых водах частично могут быть в форме недиссоциированной азотистой кислоты (HN0₂).
Содержание нитритов в поверхностных водах существенно ниже, чем в водах подземного происхождения. Подземные воды верхних водоносных горизонтов могут содержать нитритов до десятых долей миллиграмма на литр.
ПДК нитритов в воде составляет 3,3 мг/дм³ (по нитрит-иону), или 1 мг/дм³ в пересчете на азот аммонийный. Для водоемов рыбохозяйственного назначения нормы составляют 0,08 мг/дм³ по нитрит-иону или 0,02 мг/дм³ в пересчете на азот.
Нитраты
Нитраты по сравнению с другими азотными соединениями наименее токсичны, однако в значительных концентрациях вызывают вредные последствия для организмов. Основная опасность нитратов — в их способности накапливаться в организме и окисляться там до нитритов и нитрозаминов, которые значительно более токсичны и способны вызывать так называемое вторичное и третичное нитратное отравление.
Накопление больших количеств нитратов в организме способствует развитию метгемоглобинемии. Нитраты вступают в реакцию с гемоглобином крови и образуют метгемоглобин, которые не переносит кислород и, таким образом, вызывает кислородное голодание тканей и органов.
Подпороговая концентрация нитрата аммония, не оказывающая вредных последствий на санитарный режим водоема составляет 10мг/дм³.
Для водоемов рыбохозяйственного назначения повреждающие концентрации нитратов аммония для различных видов рыб начинаются с величин порядка сотен миллиграммов на литр.
ПДК нитратов для питьевой воды составляет 45 мг/дм³ , для рыбохозяйственных водоемов —40 мг/дм³ по нитратам или 9,1 мг/дм³ по азоту.
Хлориды
Хлориды в повышенной концентрации ухудшают вкусовые качества воды, а при высокой концентрации делают воду непригодной для питьевых целей. Для технических и хозяйственных целей содержание хлоридов также строго нормируется. Вода, в которой много хлоридов непригодна для орошения сельскохозяйственных насаждений.
ПДК хлоридов в питьевой воде не должно превышать 350 мг/дм³, в воде рыбохозяйственных водоемов — 300мг/дм³.
Сульфаты
Сульфаты в питьевой воде ухудшают ее органолептические показатели, при высоких концентрациях оказывают физиологическое воздействие на организм человека. Сульфаты в медицине используются как слабительное средство, поэтому их содержание в питьевой воде строго нормируется.
Содержание сульфатов в технической воде также подлежит контролю. В присутствии кальция сульфаты образуют накипь, что важно учитывать при подготовке вод, питающих паросиловые установки.
Содержание сульфатов в промышленной и питьевой воде может быть благоприятным или нежелательным фактором.
Сульфат магния определяется в воде на вкус при содержании от 400 до 600 мг/дм³, сульфат кальция — от 250 до 800 мг/дм³.
ПДК сульфатов для питьевой воды — 500 мг/дм³, для вод рыбохозяйственных водоемов —100 мг/дм³.
О влиянии сульфатов на процессы коррозии нет достоверных данных, но отмечается, что при содержании сульфатов в воде свыше 200 мг/дм³ из свинцовых труб вымывается свинец.
Железо
Соединения железа поступают в природную воду из природных и антропогенных источников. Значительные количества железа поступают в водоемы вместе со сточными водами металлургических, химических, текстильных и сельскохозяйственных предприятий.
При концентрации железа свыше 2 мг/дм³ ухудшаются органолептические показатели воды— в частности, появляется вяжущий привкус.
Высокое содержание железа делает воду непригодной для питьевых и технических целей.
ПДК железа в питьевой воде 0,3 мг/дм³,при лимитирующем показатели вредности – органолептическом. Для вод рыбохозяйственных водоемов — 0,1 мг/дм³, лимитирующий показатель вредности — токсикологический.
Высокие концентрации фтора наблюдаются в сточных водах стекольных, металлургических и химических производств (при производстве удобрений, стали, алюминия и др.), а также на горнорудных предприятиях.
Содержание фтора в питьевой воде нормируется. Повышенное содержание фтора в питьевой воде вызывает заболевание костной ткани — флюороз. Недостаток фтора тоже опасен. В местностях, где в питьевой воде содержание фторидов понижено – менее 0,01 мг/дм³, у людей чаще развивается кариес зубов.
ПДК по фтору в питьевой воде составляет 1,5 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
Щелочность
Щелочность — показатель, логически противоположный кислотности. Щелочность природных и технических вод – способность содержащихся в них ионов нейтрализовать эквивалентное количество сильных кислот.
Показатели щелочности воды необходимо учитывать при реагентной подготовке воды, в процессах водоснабжения, при дозировании химических реагентов.
Если концентрация щелочноземельных металлов повышена, знание щелочности воды необходимо при определении пригодности воды для систем орошения.
Щелочность воды и показатель pH используются в расчете баланса угольной кислоты и определении концентрации карбонат-ионов.
Кальций
Поступление кальция в природные воды идет из естественных и антропогенных источников. Большое количество кальция поступает в природные водоемы со стоками металлургических, химических, стекольных и силикатных производств, а также при стоке с поверхности сельхозугодий, где применялись минеральные удобрения.
ПДК кальция в воде рыбохозяйственных водоемов составляет 180 мг/дм³.
Ионы кальция относятся к ионам жесткости, которые образуют прочную накипь в присутствии сульфатов, карбонатов и некоторых других ионов. Поэтому содержание кальция в технических водах, питающих паросиловые установки, строго контролируется.
Количественное содержание в воде ионов кальция необходимо учитывать при исследовании карбонатно-кальциевого равновесия, а также при анализе происхождения и химсостава природных вод.
Алюминий
Алюминий известен как легкий серебристый металл. В природных водах он присутствует в остаточных количествах в виде ионов или нерастворимых солей. Источники попадания алюминия в природные воды — сточные воды металлургических производств, переработки бокситов. В процессах водоподготовки соединения алюминия применяют в качестве коагулянтов.
Растворенные соединения алюминия отличаются высокой токсичностью, способны накапливаться в организме и приводить к тяжелым поражениям нервной системы.
ПДК алюминия в питьевой воде не должна превышать 0,5 мг/дм³.
Магний
Магний — один из важнейших биогенных элементов, играющий большую роль в жизнедеятельности живых организмов.
Антропогенные источники поступления магния в природные воды— сточные воды металлургии, текстильной, силикатной промышленности.
ПДК магния в питьевой воде — 40 мг/дм³.
Натрий
Натрий — щелочной металл и биогенный элемент. В небольших количествах ионы натрия выполняют важные физиологические функции в живом организме, в высоких концентрациях натрий вызывает нарушение работы почек.
В сточных водах натрий поступает в природные воды преимущественно с орошаемых сельхозугодий.
ПДК натрия в питьевой воде составляет 200 мг/дм³.
Марганец
Элемент марганец содержится в природе в виде минеральных соединений, а для живых организмов является микроэлементом, то есть в малых количествах необходим для их жизнедеятельности.
Значительное поступление марганца в природные водоемы происходит со стоками металлургических и химических предприятий, горно-обогатительных фабрик и шахтных производств.
ПДК ионов марганца в питьевой воде —0,1 мг/дм³, при лимитирующем показателе вредности органолептическом.
Избыточное поступление марганца в организм человека нарушает метаболизм железа, при тяжелых отравлениях возможны серьезные психические расстройства. Марганец способен постепенно накапливаться в тканях организма, вызывая специфические заболевания.
Хлор остаточный
Используемый для обеззараживания воды гипохлорит натрия присутствует в воде в виде хлорноватистой кислоты или иона гипохлорита. Использование хлора для дезинфекции питьевых и сточных вод, несмотря на критику метода, до сих пор широко используется.
Хлорирование также применяется в процессах изготовления бумаги, ваты, для дезинсекции холодильных установок.
В природных водоемах активный хлор присутствовать не должен.
ПДК свободного хлора в питьевой воде 0.3 — 0.5 мг/дм³.
Углеводороды (нефтепродукты)
Нефтепродукты — одни из наиболее опасных загрязнителей природных водоемов. Нефтепродукты попадают в природные воды несколькими путями: в результате разливов нефти при авариях нефтеналивных судов; со сточными водами нефтегазовой промышленности; со сточными водами химических, металлургических и других тяжелых производств; с хозяйственно-бытовыми стоками.
Небольшие количества углеводородов образуются в результате биологического разложения живых организмов.
Для санитарно-гигиенического контроля определяются показатели содержания растворенной, эмульгированной и сорбированной нефти, поскольку каждый перечисленный вид по-разному влияет на живые организмы.
Растворенные и эмульгированные нефтепродукты оказывают многообразное неблагоприятное воздействие на растительный и животный мир водоемов, на здоровье человека, на общее физико-химическое состояние биогеоценоза.
ПДК нефтепродуктов для питьевой воды —0,3 мг/дм³, при лимитирующем показатели вредности органолептическом. Для водоемов рыбохозяйственного назначения ПДК нефтепродуктов 0,05 мг/дм³.
Полифосфаты
Полифосфатные соли используются в процессах водоподготовки для умягчения технической воды, в качестве компонента средств бытовой химии, как катализатор или ингибитор химических реакций, как пищевая добавка.
ПДК полифосфатов для воды хозяйственно-питьевого назначения — 3,5 мг/дм³, при лимитирующем показатели вредности органолептическом.
Кремний
Кремний – распространенный в земной коре элемент, входит в состав многих минералов. Для организма человека является микроэлементом.
Значительное содержание кремния наблюдается в сточных водах керамических, цементных, стекольных и силикатных производств, при производстве вяжущих материалов.
ПДК кремния в питьевой воде — 10 мг/дм³.
Сульфиды и сероводород
Сульфиды — серосодержащие соединения, соли сероводородной кислоты H₂S. В природных водах содержание сероводорода позволяет судить об органическом загрязнении, поскольку сероводород образуется при гниении белка.
Антропогенные источники сероводорода и сульфидов — хозяйственно-бытовые сточные воды, стоки металлургических, химических и целлюлозных производств.
Высокая концентрация сероводорода придает воде характерный неприятный запах (тухлых яиц) и токсичные свойства, вода становится непригодной для технических и хозяйственно-питьевых целей.
ПДК по сульфидам — в водоемах рыбохозяйственного назначения содержание сероводорода и сульфидов недопустимо.
Стронций
Химически активный металл, в естественной форме является микроэлементом растительных и животных организмов.
Повышенные поступления стронция в организм изменяют метаболизм кальция в организме. Возможно развитие стронциевого рахита или «уровской болезни», при которой наблюдается задержка роста и искривление суставов.
Радиоактивные изотопы стронция вызывают у человека канцерогенный эффект или лучевую болезнь.
ПДК природного стронция в питьевой воде составляет 7 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
Источник