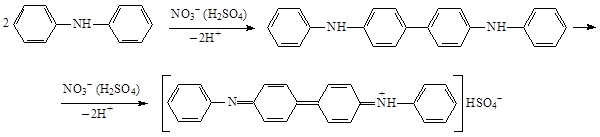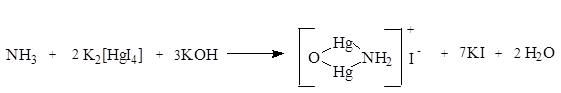- Вода очищенная Aqua purificata H2O
- Химические методы очистки воды
- Общая информация
- Какие реагенты подходят для фильтрации
- Химические методы
- Окисление
- Нейтрализация
- Восстановление
- Химия очистки воды, химические реакции и реагенты
- ТОВАРЫ
- 7 типов фильтров от железа — 7 преимуществ. Цена в СПб
- 1. Реакции окисления
- Хлор, Cl2
- Гипохлорит натрия, NaOCl
- Кислород воздуха, О2
- Озон, О3
- Перманганат калия (марганцовокислый калий, марганцовка), KMnO4
- 2. Реакции ионного обмена
- 3. Реакции нейтрализации
Вода очищенная Aqua purificata H2O
Воду очищенную получают дистилляцией, ионным обменом, обратным осмосом, комбинацией этих методов или другим способом.
Применяется вода очищенная в качестве растворителя для приготовления неинъекционных лекарственных средств.
Фармакопейный анализ воды очищенной заключается в определении соответствия описанию, рН, чистоты (примесей) и проведении микробиологического контроля в соответствии с требованиями ФС.
Описание. Бесцветная прозрачная жидкость без запаха и вкуса.
рН. Потенциометрический метод (от 5,0 до 7,0).
Для определения сухого остатка (представляет собой нелетучие примеси) выпаривают 100 мл воды на водяной бане, затем высушивают при 100-105 0 С до постоянной массы и взвешивают. Остаток не должен превышать 0,001%.
Восстанавливающие вещества (недопустимая примесь) обнаруживают реакцией с раствором калия перманганата и кислотой серной разведенной, которые прибавляют к воде, доведенной до кипения. При последующем кипячении в течение 10 минут розовая окраска должна сохраниться. Присутствие в воде восстанавливающих веществ приводит к восстановлению окрашенных перманганат-ионов до бесцветных ионов Mn 2+ .
Для обнаружения диоксида углерода (недопустимая примесь) взбалтывают равные объемы анализируемой воды и известковой воды (раствор кальция гидроксида) в заполненном доверху и хорошо закрытом сосуде. В течение часа не должно быть помутнения. В случае присутствия в воде диоксида углерода образуется малорастворимый кальция карбонат:
Нитраты и нитриты (недопустимая примесь) определяют реакцией со свежеприготовленным раствором дифениламина в кислоте серной концентрированной. Не должно появляться голубого окрашивания. В присутствии нитратов и нитритов дифениламин окисляется до окрашенного дифенилдифенохинондиимина гидросульфата:
Примесь аммиака в воде очищенной допускается в количестве не более 0,00002% . Для определения этой примеси проводят реакцию с реактивом Несслера, основанную на образовании комплексного соединения желтого цвета:
Через 5 мин после добавления реактива Несслера окраска исследуемой воды не должна превышать окраску эталона, состоящего из 1 мл эталонного раствора Б иона аммония, 9 мл воды (свободной от аммиака) и такого же количества реактива Несслера.
Хлориды (недопустимая примесь) обнаруживают реакцией с раствором серебра нитрата в присутствии кислоты азотной разведенной:
Не должно быть опалесценции.
Сульфаты (недопустимая примесь) обнаруживают реакцией с раствором бария хлорида в присутствии кислоты хлороводородной разведенной:
Не должно быть помутнения.
Примесь солей кальция (недопустимая примесь) обнаруживают реакцией с раствором аммония оксалата в присутствии растворов аммония хлорида и аммония гидроксида:
Не должно быть помутнения.
Для обнаружения солей тяжелых металлов (недопустимая примесь) проводят реакцию с раствором натрия сульфида в присутствии кислоты уксусной разведенной:
Pb 2+ + Na2S PbS↓ + 2Na +
Не должно быть бурого окрашивания. Наблюдение окраски проводят по оси пробирок диаметром около 1,5 см, помещенных на белую поверхность.
Определение недопустимых общих примесей (хлориды, сульфаты, соли кальция, соли тяжелых металлов) проводят следующим образом:
к 10 мл исследуемой воды прибавляют вспомогательные реактивы, перемешивают, затем содержимое пробирки делят на две равные части и к одной из них прибавляют основной реактив, открывающий примесь. При сравнении между пробирками не должно быть различий.
По микробиологической чистоте вода очищенная должна соответствовать требованиям на питьевую воду (не более 100 микроорганизмов в 1мл) при отсутствии бактерий сем. Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruqinosa. Испытания проводят в соответствии со статьей ГФ ХI «Испытание на микробиологическую чистоту».
Воду очищенную используют свежеприготовленной или хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих ее от инородных частиц и микробиологических загрязнений.
Дата добавления: 2016-03-20 ; просмотров: 11257 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Химические методы очистки воды
По статистике, примерно 1/3 часть воды из подводных источников и более 70% жидкости из наземных источников загрязнены различными примесями. Для получения чистой воды, применяются различные технологии. Начиная от простых фильтров на основе угля, заканчивая многоступенчатыми обратноосмотическими установками. Химические методы очистки воды – эффективные способы для чистки загрязненных жидкостей, чтобы их повторно применять в различных промышленных процессах.
Общая информация
Суть химических методов очистки воды основывается на том, что возникает химическая реакция между добавляемыми в жидкость реагентами и сторонними примесями, которые уже содержатся в ней. Это приводит к тому, что опасные и токсичные элементы переходят в безвредную форму, или же превращаются в нерастворимые соединения, которые постепенно выпадают в осадок. Химические методы пользуются большой популярностью за счет того, что реакции между веществами проходят одинаково эффективно в любом объеме жидкости.
Одновременно с этим нужно понимать, что жидкость, которая прошла чистку с помощью химических методов, пригодна для применения в различных технических нуждах. Употреблять такую воду опасно для организма.
Важно! Необходимо учитывать тот момент, что химические методы чистки жидкости являются достаточно опасными для человека, который работает с реагентами. Из-за этого все работы должны выполняться под контролем экспертов в данной сфере.
Какие реагенты подходят для фильтрации
Если рассматривать все возможные активные нейтрализующие химические вещества, можно выделить три самых эффективных категории реагентов:
- Щелочи – сюда относится гидроксид натрия, сода, известь.
- Окислители – марганец, хлор, озон.
- Кислоты – серная, соляная.
При этом важно заранее изучить требования по количеству используемых химических веществ, чтобы достичь требуемого качества очищенной жидкости.
Химические методы
Независимо от того, что жидкость может быть засорена различными сторонними примесями, которые вредны для человеческого организма, негативно влияют на работу бытовых приборов, химические методы очистки сточных вод, жидкости из скважин, колодцев, основываются на 3-ех эффективных реакциях:
Каждый из данных способов имеет свои особенности, их необходимо рассмотреть по отдельности.
Окисление
Данная технология считается лучшей, если сравнивать ее с другими химическими методами очистки воды от различных сторонних примесей. Ее суть заключается в том, что в воду добавляются сильные окислители (например, бихромат калия, перманганат калия, перекись водорода, хлор и различные соединения на его основе). За счет этого, форма вредных целевых веществ изменяется на безопасную, все токсичные соединения преобразуются в безвредную форму. Одновременно с этим, сильные окислители уничтожают любую патогенную микрофлору.
Если подробно рассматривать сами окислители, большой популярностью пользуется метод добавления хлора. Он доступный, дешевый, эффективный в плане уничтожения различных болезнетворных бактерий. Однако, нельзя забывать о том, что очищенная жидкость не может использоваться в качестве питься, имеет неприятный запах.
Нейтрализация
Главная цель реакции нейтрализации в плане очистки воды – стабилизация кислотно-щелочного баланса. Это возможно за счет того, что происходит реакция между щелочной и кислой средой, в процессе которой образуются соли. Чаще всего технология очистки на основе нейтрализации применяется для обработки отработанной жидкости на различных предприятиях. Если же говорить о воде из колодцев, скважин, в большинстве случаев она имеет оптимальный кислотно-щелочной баланс, корректировать который нет необходимости.
Когда жидкость проходит процесс нейтрализации, ее можно повторно применять в производственном процессе, что удешевляет работу предприятия, делает ее менее разрушительной для окружающей среды.
Чтобы применять технологию нейтрализации, необходимо использовать специализированное оборудование. На предприятии нужно установить накопитель, осветлитель, отстойник.
Восстановление
Методика восстановления применяется достаточно редко, так как является не такой эффективной как окисление. Однако, с помощью данной технологии можно перевести окисленные формы токсичных мышьяка, ртути, хрома, тяжелых и переходных металлов в молекулярное состояние. Это нужно для их дальнейшего удаления из воды, при ее перекачке через фильтры химической очистки.
При правильном применении химических реагентов, можно достичь требуемого качества во время очистки воды различного объема. За счет этого, подобные методы получили большую популярность среди крупных предприятий.
Источник
Химия очистки воды, химические реакции и реагенты
ТОВАРЫ
Ионообменные фильтры предназначены для удаления из воды ионов, концентрация которых превышает нормативы. Чаще всего это ионы кальция, магния, железа, марганца, органических и других примесей.
7 типов фильтров от железа — 7 преимуществ. Цена в СПб
- Сапфир-Br/м — ручное управление, низкая цена, энергонезависимость,
- Сапфир-Br/нс — ручное управление, энергонезависимость, нижний слив для консервации на зиму для дач, корпус — пищевая нержавейка
- Сапфир-Br/в — ручное управление, низкая цена, энергонезависимость, для водопровода
- Сапфир-Br-А/р — автоматическое управление, клапан Runxin, низкая стоимость,
- Сапфир-Br-А/л — автоматическое управление, клапан Logix обслуживаемый, срок службы 10-12 лет,
- Сапфир-Br-А/к — автоматическое управление, клапан Clack обслуживаемый, срок службы 10-12 лет, для водопровода
- Сапфир-Br-А/нс — автоматическое управление, клапан Logix обслуживаемый, корпус — нерж сталь, легко мыть поверхность, для чистых производств
Блок автоматического дозирования реагентов предназначен для химической обработки воды. Основные элементы установки — насос-дозатор Tekna, импульсный счетчик воды.
1. Реакции окисления
Такие примеси, как органические вещества, ионы металлов в низших степенях окисления, а также бактерии, легко удаляются (обезвреживаются) химическими методами очистки воды. Рассмотрим наиболее часто применяемые реагенты, их достоинства и недостатки, а также характерные химические реакции в процессах очистки воды.
Хлор, Cl2
Хлорирование является наиболее распространенным методом окисления и обеззараживания (дезинфекции) воды. В процессе хлорирования вода практически полностью освобождается от железа, под воздействием хлора легко разрушаются и гуматы, и лигно-гуминовые вещества, и другие органические соединения железа (Fe 2+ ), переводя последнее в легкогидролизуемые соли трехвалентного железа, которые быстро выпадают в осадок.
Хлор также легко окисляет марганец (Mn 2+ ), различного вида органические соединения, сероводород. Основной недостаток данного метода – сложность транспортирования и хранения больших объемов жидкого и высокотоксичного хлора. Поэтому в качестве альтернативы чистому хлору используют водные растворы гипохлоритов, и чаще всего для окисления и обеззараживания воды применяют гипохлорит натрия.
Гипохлорит натрия, NaOCl
Гипохлорит натрия позволяет осуществлять безопасное хлорирование очищаемой воды, поэтому гипохлорит натрия можно назвать «мягким» хлорирующим агентом. Обычно, гипохлорит натрия получают в виде концентрированного раствора пропусканием хлора через водный раствор гидроокиси натрия. Другим способом является электрохимический способ получения NaOCl . Как и чистый хлор, гипохлорит переводит железо (Fe 2+ ) в железо (Fe 3+ ):
2 Fe(HCO3)2 + NaOCl + H2O = 2 Fe(OH)3 (осадок) + 4 CO2 (газ) + NaCl
Гипохлорит натрия также окисляет марганец (Mn 2+ ), органику, сероводород и обеззараживает воду. Удобен в применении как в промышленных масштабах, так и для установок водоочистки индивидуального пользования.
Кислород воздуха, О2
Самый распространенный и доступный реагент для окисления, однако он имеет недостаточную химическую активность при нормальных условиях, поэтому ограниченно используется в водоочистке. Но есть примеси, удаление которых сравнительно легко окисляется кислородом – это железо (Fe 2+ ) и марганец (Mn 2+ ).
Взаимодействие этих примесей в низших степенях окисления с кислородом воздуха переводит их в окисленную форму, которая легко (особенно в присутствии каталитических систем) взаимодействует с водой (гидролизуется) и переходит в малорастворимые соединения, которые выпадают в осадок. Частички осадка укрупняются и накапливаются на поверхности частиц засыпного материала в фильтрах обезжелезивателях, а затем легко удаляются простой обратной промывкой фильтра.
Озон, О3
Озон близок к кислороду, но гораздо более химически активен и при этом не привносит в воду посторонние химические вещества. Использование озона позволяет наряду с обеззараживанием достигнуть обесцвечивания воды, окисления железа и марганца, устранить посторонние привкусы и запахи воды. Стоит отметить очень высокую скорость реакции, даже по сравнению с таким окислителем, как хлор, и возможность получение озона на месте использования.
Основной недостаток – большой удельный расход электроэнергии, потребляемый озонаторами, а также сложность и достаточно высокая стоимость оборудования.
Перманганат калия (марганцовокислый калий, марганцовка), KMnO4
Перманганат калия (всем известная аптечная марганцовка) широко используется в водоподготовке как окислитель железа и марганца. Дозируется либо путем введения в трубопровод, подводящий исходную воду в фильтр обезжелезиватель, либо подачей раствора перманганата на стадии регенерации загрузки в фильтрах -обезжелезивателях.
Однако, слив воды при регенерации фильтров в локальные станции биологической очистки сточных вод недопустим, так как может привести к гибели бактерий, перерабатывающих канализационные стоки.Марганцовокислый калий иногда применяется в сочетании с гипохлоритом натрия.
К недостаткам перманганата калия следует отнести то, что он является достаточно дорогим реагентом, а кроме того существует опасность его передозировки, поэтому не исключена возможность вторичного загрязнения воды опасными для здоровья человека соединениями марганца.
2. Реакции ионного обмена
Ионный обмен используется для замещения ионов вредных примесей воды на безвредные. Различают анионообменный и катионообменный способы очистки воды. Наиболее часто катионный обмен применяют для снижение жесткости воды, а анионный обмен — для улавливания анионов слабых органических кислот (органики — продуктов естественной трансформации в земной коре древесины и растительных остатков). Реагентами в процессах ионного обмена являются специальные материалы — ионообменные смолы.
После насыщения ионообменных смол ионами вредных примесей требуется проводить их регенерацию растворами реагентов. В процессах водоподготовки для регенерации ионообменных смол чаще всего используется раствор пищевой соли. При этом происходит обратный процесс ионного обмена: ионы вредных примесей замещаются ионами Na + — при катионном обмене и ионами Cl — — при анионном обмене. Фильтры ионного обмена легко масштабируются, поэтому производительность этого метода практически не ограничена.
Более подробно об ионитах читайте на страничке ионообменные смолы.
3. Реакции нейтрализации
Реакция нейтрализации с применением подщелачивающих либо подкисляющих веществ также используется для очистки воды. В качестве подщелачивающих веществ чаще всего используют разбавленный раствор каустической соды (едкого натра) NaOH или пищевой соды (бикарбоната натрия) Na2HCO3.
В качестве подкисляющих веществ обычно применяют растворы слабых органических кислот, например, лимонной кислоты или разбавленный раствор минеральной кислоты, например, серной. Как правило, этим методом корректируют кислотно-щелочной баланс, нарушения которого, например, возникают в процессе очистки воды от тяжелых металлов.
Источник