- Подтекание околоплодных вод
- Общие сведения
- Причины подтекания околоплодных вод
- Патогенез
- Классификация
- Симптомы подтекания околоплодных вод
- Осложнения
- Диагностика
- Лечение подтекания околоплодных вод
- Прогноз и профилактика
- Перинатальные исходы при преждевременном разрыве плодных оболочек
- Этиология
- Перинатальные и постнатальные исходы
- Синдром дыхательных расстройств
- Врожденная инфекция плода
- Постгипоксические поражения головного мозга
- Инфекционные осложнения беременных, рожениц и родильниц при недоношенной беременности, осложненной ПРПО
- Клинико-лабораторная диагностика и прогностические критерии хориоамнионита и системной воспалительной реакции
Подтекание околоплодных вод
Подтекание околоплодных вод — патологическое состояние, вызванное высоким разрывом плодных оболочек или образованием в них микротрещин. Проявляется постоянным выделением небольшого количества водянистой амниотической жидкости. Для диагностики применяется осмотр с зеркалами, амниотесты, амниоцентез с безопасным красителем, исследование влагалищного мазка под микроскопом, трансабдоминальное УЗИ. Акушерская тактика определяется сроком беременности, состоянием матери и плода, наличием осложнений. При выжидательном ведении назначают антибиотики, глюкокортикоиды, токолитики. Активная тактика предусматривает прерывание беременности или индукцию родовой деятельности.
Общие сведения
Повреждение плодного яйца с незначительным подтеканием вод наблюдается почти в половине случаев преждевременного разрыва амниона. По данным разных авторов, такое патологическое состояние возникает в 2-5% беременностей и является причиной почти 10% случаев перинатальной смертности. В связи с минимальными клиническими проявлениями подтекание зачастую не выявляют вовремя, что существенно повышает риск инфекционных и других осложнений. Именно разрыв оболочек провоцирует преждевременные роды, является основной причиной недоношенности, гипоплазии легких и сепсиса плода — трех ключевых факторов, повышающих риск смерти новорожденного. Использование современных методов диагностики и рациональное ведение беременных с поврежденными плодными оболочками позволяет существенно улучшить прогноз для матери и ребенка.
Причины подтекания околоплодных вод
Постоянное выделение незначительного количества амниотической жидкости наблюдается при нарушении целостности оболочек плода. В отличие от обильного преждевременного излития околоплодных вод в результате разрыва нижнего полюса плодного яйца, подтекание обычно возникает при так называемом высоком боковом надрыве или образовании микротрещин. Существует несколько групп причин, приводящих к повреждению амниотической оболочки:
- Инфекционные процессы. Самопроизвольный разрыв оболочек плода чаще наблюдается у беременных, страдающих эндометритом, кольпитом, цервицитом, аднекситом. Прочность амниона существенно снижается при хориоамнионите.
- Нарушения в маточно-плацентарной системе. Вероятность повреждения амниотического мешка увеличивается при наличии двурогой или удвоенной матки, ИЦН, плацентарной недостаточности, оболочечном креплении или преждевременной отслойке плаценты.
- Ятрогенные воздействия. Подтекание вод может стать результатом многократных бимануальных исследований, трансвагинальных УЗИ, амниоцентеза, биопсии хориона и укрепления шейки матки швами при ИЦН.
- Плодные факторы. Стенки амниотического пузыря испытывают повышенное давление при многоплодной беременности, гидроцефалии плода, аномалиях его положения и вставления предлежащей части.
- Патология оболочек. Чрезмерное растяжение амниона возникает при многоводии, вызванном первичной и вторичной гиперпродукцией околоплодных вод или нарушением их резорбции. Эластичность оболочек также уменьшается при их гиалиновом перерождении (преждевременной дегенерации).
- Травмы живота. Оболочки плода могут разрываться при резком ударе в живот, проникающих ранениях брюшной полости и матки.
Специалисты в сфере акушерства и гинекологии выделяют ряд предрасполагающих факторов, которые повышают риск самопроизвольного разрушения оболочек плода. Вероятность подтекания выше у женщин с преждевременным излитием околоплодных вод во время предыдущей беременности (рецидив наблюдается в 20-30% случаев), при наличии хронических воспалительных заболеваний половых органов и рубцовой деформации шейки матки. Патология чаще диагностируется у пациенток, длительно употребляющих глюкокортикоидные препараты, с системными заболеваниями соединительной ткани, анемией, никотиновой зависимостью. По мнению некоторых авторов, определенную провоцирующую роль играет низкий уровень благосостояния женщины, который приводит к несбалансированному питанию, значительным физическим и психоэмоциональным нагрузкам.
Патогенез
Ключевое значение в патогенезе подтекания околоплодных вод играют причины, приводящие к повреждению амниона. Стартовым звеном процесса обычно являются структурные изменения в оболочках плода, вызванные воспалением, дегенеративными изменениями или значительным растяжением. Пусковым моментом разрыва с последующим подтеканием становится чрезмерное повышение давления околоплодных вод либо резкое травматическое воздействие (удар, грубая пальпация, прокол), нарушающие целостность оболочек.
При высоком боковом расположении дефект амниотического мешка находится над внутренним маточным зевом, поэтому скорость вытекания околоплодных вод ограничена за счет примыкания поврежденного участка к стенке матки. Поскольку разрывы амниона не рубцуются, защитная функция плодного пузыря снижается, увеличивается риск инфицирования плода. Кроме того, ферменты, которые содержатся в амниотической жидкости, способны спровоцировать отслойку плаценты и, в зависимости от гестационного срока, самопроизвольный аборт или преждевременные роды.
Классификация
При выборе тактики ведения беременной определяющую роль играет время повреждения оболочек плода. На основании этого критерия выделяют следующие виды подтекания вод:
- При преждевременном дородовом разрыве — до 37 недели беременности (подтекание при недоношенной беременности);
- При дородовом разрыве — с 37 недели гестационного срока (подтекание при доношенной беременности);
- При раннем боковом разрыве — во время родов до раскрытия шейки на 4 см и более.
Симптомы подтекания околоплодных вод
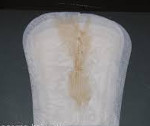
Если вытекание амниотической жидкости не сочетается с другой акушерской или гинекологической патологией – субъективные ощущения отсутствуют, состояние в ряде случаев может оставаться незамеченным. Объем живота, как правило, не уменьшается. Обычно беременная жалуется на постоянное выделение из влагалища водянистой жидкости без цвета и запаха, количество которой увеличивается при изменении позы, напряжении брюшного пресса во время кашля, чихания, физических нагрузок и в горизонтальном положении.
Если женщина подозревает подтекание вод, она может воспользоваться простым методом «чистой пеленки». Появление влажного пятна на ткани после лежания на спине в течение 30-60 минут является поводом для срочного обращения в женскую консультацию. При разрывах длительностью более суток возникают и нарастают признаки инфицирования матки, плода и/или его оболочек. Температура тела пациентки повышается до 38 и более градусов, возникает озноб, боли внизу живота, которые усиливаются при пальпации. В выделениях из влагалища может появиться примесь гноя и сукровица.
Осложнения
Длительное подтекание амниотических вод представляет собой значительную угрозу как для беременной, так и для плода. По данным ряда исследователей, при этой патологии в 8-13 раз возрастает риск мертворождения, перинатальная смертность повышается в 4 раза, а неонатальная заболеваемость — в 3. Основными осложнениями с высоким риском гибели плода и смерти новорожденного являются респираторный дистресс-синдром, хориоамнионит, некротизирующий энтероколит, внутрижелудочковые кровоизлияния. Вследствие нарушения маточно-плацентарного кровообращения возникает гипоксия плода. Возможна преждевременная отслойка детского места и врожденные аномалии (ретинопатия, открытый артериальный проток, деформация скелета, самоампутация конечностей и др.). У беременных с подтекающими околоплодными водами чаще наблюдается слабость родовой деятельности, послеродовые кровотечения и эндометрит.
Диагностика
Подтекание околоплодных вод — одно из наиболее сложных в плане диагностики патологических состояний при беременности. Скудная клиническая симптоматика и высокий риск последующих осложнений требуют особо тщательного обследования пациенток с подозрением на повреждение оболочек плода. Диагностические мероприятия направлены на подтверждение амниотического характера выделений и выявление возможных осложнений. План обследования обычно включает:
- Осмотр в зеркалах. В заднем своде определяется небольшое количество прозрачной жидкости, которая подтекает при покашливании беременной.
- Трансабдоминальное УЗИ. При подтекании этот метод менее информативен, однако позволяет вовремя диагностировать возможные осложнения — отслойку плаценты, признаки страдания плода и т. п.
- Микроскопия влагалищного мазка. О наличии амниотической жидкости свидетельствует кристаллизация в виде характерных листьев папоротника. Однако данный метод считается недостаточно чувствительным и специфичным.
- Амниотест. Изменения цвета тест-полосок выявляет ощелачивание кислой среды влагалища околоплодными водами, а обнаружение в выделениях плацентарного микроглобулина в 99,9% случаев свидетельствует о повреждении плодных оболочек.
- Амниоцентез с красителем. Метод является высокоинвазивным и предполагает введение в амниотический мешок безопасного красителя через прокол брюшной стенки. Если через 20-30 минут после введения тампон, установленный во влагалище, окрашивается, диагноз разрыва оболочек считается подтвержденным.
Дифференциальная диагностика проводится с воспалительными заболеваниями женских половых органов (вагинитом, цервицитом, эндометритом, сальпингоофоритом), амнионитом, преждевременной отслойкой плаценты. При выявлении осложнений к ведению пациентки привлекают анестезиолога-реаниматолога, неонатолога, терапевта.
Лечение подтекания околоплодных вод
При выборе схемы ведения беременной в первую очередь учитывается срок гестации. С учетом нежизнеспособности плода и высокого риска опасных осложнений беременность до 22 недели рекомендуется прервать. Пациенток на более поздних сроках госпитализируют в акушерские стационары 3-го уровня и обеспечивают максимальный физический покой. С 22 по 34 неделю включительно тактика является выжидательной. Пролонгация беременности противопоказана при хориоамнионите, грубых пороках развития, острой гипоксии или гибели плода, начале родовой деятельности, преэклампсии и эклампсии, отслойке плаценты и ряде других состояний. В остальных случаях рекомендованы:
- Превентивная антибактериальная терапия. Для снижения риска инфекционных осложнений антибиотики назначают курсом с первого дня госпитализации.
- Препараты для профилактики РДС. Чтобы ускорить синтез сурфактанта и созревание легочной ткани, применяют глюкокортикоиды.
- Токолитическая терапия. Использование селективных β2-адреномиметиков, сернокислой магнезии, ингибиторов циклооксигеназы, блокаторов медленных кальциевых каналов и окситоциновых рецепторов уменьшает сократительную активность миометрия.
- Амниотрансфузия. Применяется в исключительных случаях по требованию беременной на 22-24 неделе при больших объемах выделений и значительном снижении количества околоплодных вод.
Лечение проводится на фоне регулярного мониторинга состояния плода и беременной: термометрии, оценки показателей крови и гемодинамики, ежедневной кардиотокографии, еженедельного УЗИ, допплерометрии фетоплацентарного кровотока каждые 3 дня. При этом особое внимание уделяется профилактике внутрибольничной инфекции.
При выявлении подтекания вод у женщины с 34-36-недельной беременностью используют как выжидательную, так и активную тактику. Поскольку нет достоверных данных, что индукция родовой деятельности в этом сроке ухудшает неонатальный исход, второй вариант является предпочтительным. Выжидание зачастую провоцирует развитие хориоамнионита и компрессию пуповины. Длительность наблюдения обычно не превышает 1 суток. После начала родов с профилактической целью назначают антибиотики.
На 37 и более неделе гестации при выявлении в выделениях околоплодных вод и отсутствии родовой деятельности показана стимуляция родов. Антибактериальная терапия применяется при диагностике хориоамнионита. Превентивное назначение антибиотиков рекомендуется только в тех случаях, когда предполагаемая длительность подтекания вод превышает 18 часов.
Прогноз и профилактика
Прогноз при подтекании околоплодных вод зависит от срока беременности. Рациональное использование выжидательной тактики позволяет плоду максимально созреть и минимизирует риск инфекционных осложнений. Прекращение подтекания при 22-33-недельной беременности позволяет пролонгировать ее до доношенных сроков, если состояние женщины и плода является удовлетворительным, а количество амниотической жидкости сохраняется на нормальном уровне. При продолжении подтекания вод, отсутствии признаков воспаления, удовлетворительном состоянии беременной и плода пролонгация возможна не более чем на 1-3 недели. Риск перинатальной смертности существенно уменьшается при преждевременных родах с 31-33 недели беременности, а заболеваемость новорожденных — с 34 и более. Профилактика преждевременного подтекания вод предусматривает ограничение тяжелых физических нагрузок, отказ от курения, своевременную постановку на учет и регулярные посещения акушера-гинеколога, обоснованное назначение инвазивных диагностических процедур (особенно при обнаружении факторов риска).
Источник
Перинатальные исходы при преждевременном разрыве плодных оболочек
Рассмотрены этиология и перинатальные и постнатальные исходы при преждевременном разрыве плодных оболочек (ПРПО), акушерская тактика ведения недоношенной беременности, осложненной ПРПО, показания к досрочному прерыванию недоношенной беременности, осложнен
Etiology, and ante-natal and post-natal outcomes in premature breaking of waters (PBW) were considered, as well as obstetrical practice of managing incomplete pregnancy complicated with PBW, and indications for premature abortion of incomplete pregnancy complicated with PBW.
Преждевременным называется разрыв околоплодных оболочек до начала родовой деятельности независимо от срока беременности, клинически проявляющийся излитием околоплодных вод. Популяционная частота преждевременного разрыва плодных оболочек (ПРПО) составляет около 12% [1, 6], однако в структуре причин преждевременных родов эта патология достигает 35–60% [2].
Этиология
Данные эпидемиологических исследований свидетельствуют о многообразии этиологических факторов ПРПО. Выявлена взаимосвязь ПРПО с высоким паритетом, а также преждевременными родами, привычным невынашиванием и ПРПО в анамнезе [5]. Причиной разрыва оболочек могут быть приобретенные или врожденные формы дефицита коллагена (синдром Элерса–Данлоса), дисбаланс микроэлементов, в том числе дефицит меди, являющейся кофактором матриксных металлопротеиназ (ММП) и их ингибиторов, влияющих на свойства компонентов соединительнотканного матрикса плодных оболочек. Одним из факторов, способствующих повреждению плодных оболочек, является оксидантный стресс, связанный с продукцией реактивных кислородных радикалов нейтрофилами и макрофагами при их вовлечении в процесс микробной элиминации, которые вызывают локальную дегенерацию коллагена, истончение и разрыв оболочек путем активизации ММП, а хлорноватистая кислота непосредственно разрушает коллаген I типа, являющийся структурной основой плодных оболочек [11, 19].
Подтверждена роль отслойки плаценты как в индукции преждевременных родов, так и ПРПО, связанная с выбросом большого количества простагландинов, высокой утеротонической активностью тромбина [27] и наличием питательной среды для роста бактериальной микрофлоры.
На протяжении последних лет утвердилось обоснованное мнение о том, что ведущей причиной ПРПО является восходящее инфицирование околоплодных оболочек и микробная инвазия амниотической полости, частота которой в течение первых суток после ПРПО составляет от 37,9% до 58,5% [12]. Подтверждают восходящий путь передачи инфекции многочисленные исследования, указывающие на идентичность штаммов микроорганизмов, выделенных у плодов и в мочеполовых путях беременных [7, 12, 21]. Среди инфекционных агентов, которые служат непосредственной причиной восходящего воспалительного процесса, преобладают Еscherichia сoli, Staphilococcus aureus, Streptococcus faecalis, Streptococcus группы B, Bacteroides fragilis, Corinobacter, Campylobacter, Clebsiella pneumoniae [7]. Ряд авторов подчеркивают роль анаэробных бактерий в этиологии восходящего инфицирования, в частности Fusobacterium [22]. К часто встречающимся представителям микробных ассоциаций относятся Ureaplasma urealiticum, Mycoplasma hominis и Gardnerella vaginalis. Однако широкое распространение урогенитальных микоплазм, стертая клиническая картина и трудности диагностики затрудняют определение роли этих микроорганизмов в этиологии и патогенезе преждевременных родов и ПРПО [3]. Риск ПРПО значительно возрастает при наличии истмико-цервикальной недостаточности и пролапса плодного пузыря в связи с нарушением барьерной функции цервикального канала, а также укорочении шейки матки менее 2,5 см [14].
Степень повреждения околоплодных оболочек связана с видом патогена и его способностью активизировать ММП. Тесная взаимосвязь увеличения концентрации большинства ММП (ММП-1, 7, 8 и 9) и снижения тканевого специфического ингибитора металлопротеиназ (ТИММП-1) в околоплодных водах с внутриамниальной бактериальной инвазией и отслойкой плаценты не подвергается сомнению [11, 19]. Механизм бактериального действия на плодные оболочки опосредован, с одной стороны, стимулирующим влиянием микробных протеиназ и эндотоксинов на экспрессию ММП и выработку провоспалительных цитокинов (ИЛ-2, ИЛ-6, ИЛ-12, фактора некроза опухоли) с последующей локальной деградацией коллагена оболочек, а с другой стороны, повышением бактериальными фосфолипазами синтеза простагландинов с развитием гипертонуса миометрия и увеличения внутриматочного давления [19].
Таким образом, ведущую роль в этиологии и патогенезе ПРПО при недоношенной беременности играют факторы, стимулирующие апоптоз, разрушение фосфолипидов и деградацию коллагена соединительнотканного матрикса околоплодных оболочек, преимущественно связанные с действием инфекции.
Перинатальные и постнатальные исходы
Более 30% пери- и неонатальной заболеваемости и смертности при преждевременных родах связаны с беременностью, осложненной ПРПО [1, 3]. В структуре заболеваемости и смертности основное место занимают синдром дыхательных расстройств (СДР) (до 54%), внутриутробная инфекция и гипоксическое поражение головного мозга, в виде перивентрикулярной лейкомаляции (ПВЛ) головного мозга (до 30,2%) и внутрижелудочковых кровоизлияний (ВЖК) [1, 3, 31].
Синдром дыхательных расстройств
СДР новорожденных представляет совокупность патологических процессов, формирующихся в пренатальном и раннем неонатальном периодах и проявляющихся нарастанием симптомов дыхательной недостаточности на фоне угнетения жизненно важных функций организма. Основной причиной развития СДР является дефицит сурфактанта или его инактивация. К предрасполагающим факторам следует отнести внутриутробные инфекции (ВУИ) и перинатальную гипоксию. Степень тяжести и частота реализации СДР прогрессивно снижается с увеличением срока беременности и степени зрелости плода и составляет около 65% до 30 недель беременности, 35% — в 31–32 недели, 20% в 33–34 недели, 5% в 35–36 недель и менее 1% — в 37 недель и более [1, 15, 31].
Существует мнение, что интраамниальная инфекция, связанная с длительным безводным промежутком, способствует созреванию легких плода и снижает частоту респираторных нарушений [28]. В эксперименте на овцах показано, что интраамниальное введение эндотоксина E. coli достоверно в большей степени повышает концентрацию липидов и протеинов сурфактанта, при применении бетаметазона, и в 2–3 раза увеличивает воздушный объем легких [15]. Однако клинические исследования не подтвердили предположение о стимулирующем влиянии ПРПО на зрелость легочной ткани, и оно требует дальнейшего изучения [31].
Врожденная инфекция плода
Наиболее значимым фактором риска неблагоприятного пери- и постнатального исхода, усугубляющим течение пневмопатий и патологии центральной нервной системы, является ВУИ. Это понятие объединяет инфекционные процессы (пневмония, сепсис и др.), которые вызывают различные возбудители, проникшие к плоду от инфицированной матери. Для недоношенных детей, находящихся на длительном стационарном лечении, большую опасность представляют и нозокомиальные инфекции. Мертворождаемость и ранняя неонатальная смертность при ВУИ связана со степенью тяжести воспалительного процесса, зависящего от гестационного возраста плода, типа и вирулентности возбудителя, защитных факторов околоплодных вод и неспецифического иммунитета, и составляет по данным литературы 14,9–16,8% и 5,3–27,4% соотвественно [2, 33].
Преобладающей клинической формой неонатальной инфекции при ПРПО, составляющей от 42% до 80%, является пневмония, как правило, связанная с аспирацией инфицированными водами, часто сочетающаяся с признаками язвенно-некротического энтероколита. Прогрессирование очагов первичного воспаления в легких или кишечнике плода обусловливает возможность развития метастатического гнойного менингита, перитонита, а также внутриутробного сепсиса, частота которого при ПРПО до 32 недель колеблется от 3% до 28%. Основными факторами риска неонатального сепсиса являются гестационный срок и развитие хориоамнионита (ХА) [29, 33].
Влияние ВУИ на отдаленный исход не однозначно. Есть данные, указывающие на риск развития детского церебрального паралича, связанного с интраамниальной инфекцией и гестационным возрастом плода [10, 26]. В то же время ряд исследований не подтвердили достоверной связи между ВУИ и нарушением умственного и психомоторного развития детей [17, 22].
Постгипоксические поражения головного мозга
Основные гипоксические повреждения головного мозга недоношенных детей включают ПВЛ и ВЖК.
ПВЛ представляет собой коагуляционный некроз белого вещества, с последующей дегенерацией астроцитов с пролиферацией микроглии, вследствие гипоксемии и ишемии головного мозга. При экстремально низкой и очень низкой массе тела при рождении патологоанатомическая частота ПВЛ варьирует от 25% до 75%, а in vivo — от 5% до 15%. Осложения ПВЛ в виде деструкции афферентных волокон таламокортикальных и кортикокортикальных путей отрицательно влияют на формирование межнейрональных ассоциативных связей, процессы миелинизации белого вещества и могут стать причиной развития когнитивных нарушений [2, 26]. Прогностическим критерием развития ПВЛ и отдаленных неврологических нарушений является значительное повышение концентрации в околоплодных водах и пуповинной крови новорожденных провоспалительных цитокинов, в том числе ИЛ-6, что подтверждает гипотезу о цитокин-опосредованном повреждении мозга и косвенно свидетельствует о роли ВУИ в развитии ПВЛ [13, 26].
ВЖК составляют в структуре перинатальной смертности недоношенных новорожденных от 8,5% до 25% [2, 13]. К основным факторам риска их развития относят острую гипоксию плода и ХА [26]. Частота тяжелых степеней ВЖК снижается с увеличением гестационного возраста и при родоразрешении путем операции кесарева сечения. Некоторые исследования подтверждают роль глюкокортикоидной терапии в уменьшении риска развития ВЖК и ПВЛ [17, 20]. В то же время разработка достоверно эффективных методов профилактики ВЖК до настоящего времени остается в поле внимания научных исследований.
Инфекционные осложнения беременных, рожениц и родильниц при недоношенной беременности, осложненной ПРПО
Пролонгирование недоношенной беременности при ПРПО представляет значительный риск для матери, в первую очередь в связи с присоединением инфекционного процесса и развитием гнойно-септических осложнений (ГСО), в большинстве случаев ХА, послеродового эндомиометрита и, реже, — сепсиса. К факторам риска реализации ГСО следует отнести хирургические внутриматочные вмешательства, хроническую урогенитальную инфекцию, разрыв плодных оболочек на фоне пролабирования плодного пузыря, а также антенатальной гибели плода [1, 5].
Риск гнойно-септических инфекций (ГСИ) матери имеет достоверную связь с длительностью безводного промежутка и сроком гестации. Общая частота реализованного ХА при недоношенной беременности, осложненной ПРПО, составляет 13–74%, а при разрыве оболочек до 28 недель 28,8–33% [4, 7, 13]. Однако, по нашим данным, основанным на анализе течения 912 беременностей, осложненных ПРПО в сроке 22–34 недели, частота ХА до 31 недели беременности и продолжительности латентного периода более 2 суток — времени, необходимого для эффективной экспозиции глюкокортикоидов с целью профилактики СДР, — достоверно не меняется. В то же время при пролонгировании беременности после 31-й недели риск реализации ХА увеличивается. Таким образом, на наш взгляд, оптимальным подходом при ведении беременности, осложненной ПРПО, следует считать максимальное пролонгирование беременности до 31-й недели беременности, а при разрыве оболочек в более поздние сроки — только на период проведения глюкокортикоидной профилактики СДР. В то же время необходимо помнить, что вопрос о возможности длительного пролонгирования беременности при ПРПО должен решаться индивидуально с учетом возможностей акушерской и, в большей степени, неонатальной служб, а также факторов риска ГСИ у беременной.
К прогностическим критериям инфекционных осложнений и ХА относят маловодие и косвенные признаки воспаления плаценты [23]. По нашим данным, при нормальном объеме околоплодных вод с индексом амниотической жидкости более 8 см частота реализации ХА составляет 4,9%. В то же время при снижении индекса амниотической жидкости менее 5 см риск развития ХА возрастает в 2 раза.
Послеродовая заболеваемость родильниц проявляется эндометритом в 3,5–11,1% случаях [4]. Частота развития сепсиса по данным разных авторов достигает 1,7%, а материнская летальность, связанная с ведением недоношенной беременности, осложненной ПРПО, — 0,85% [4, 23].
Клинико-лабораторная диагностика и прогностические критерии хориоамнионита и системной воспалительной реакции
Раннее выявление признаков ХА представляет определенные трудности в связи с изменением реактивности организма во время беременности и склонности к формированию латентных форм воспалительных заболеваний. Типичными симптомами ХА являются лихорадка, тахикардия матери и плода, специфический запах околоплодных вод или патологические выделения из влагалища. К сожалению, гипертермия до 38 °С и выше часто является единственным индикатором развития ХА, а значения традиционных маркеров воспалительного процесса — количества лейкоцитов и сегментоядерных нейтрофилов — при беременности имеют широкую вариабельность, зависимы от медикаментов, в том числе стероидов и антибиотиков и, по данным некоторых исследований, имеют невысокое диагностическое значение [4, 30]. Из рутинных клинико-лабораторных критериев ХА высокую диагностическую ценность имеют гипертермия более 37,5 °С, лейкоцитоз более 17 × 10 9 /л и палочкоядерный сдвиг лейкоцитарной формулы до 10% и более. Развитие указанных симптомов необходимо использовать в качестве показаний для родоразрешения со стороны матери при пролонгировании недоношенной беременности, осложненной ПРПО [2, 4, 6].
Наибольшие трудности представляет ранняя диагностика септических состояний. За последние годы достигнут большой прогресс в изучении и использовании белков плазмы крови, принимающих участие в так называемом острофазном ответе — совокупности системных и местных реакций организма на тканевое повреждение, вызванное различными причинами (травма, инфекция, воспаление, злокачественное новообразование и пр.). В качестве прогностического критерия инфекции при ПРПО широко используется определение концентрации С-реактивного белка (СРБ), повышение которого в сыворотке крови более 800 нг/мл является индикатором интраамниальной инфекции и тесно коррелирует с фуниситом, гистологически и клинически выраженным ХА с чувствительностью 92% и специфичностью 96% [9]. Кроме того, концентрация СРБ в околоплодных водах может косвенно отражать состояние плода, так как он продуцируется гепатоцитами и не проникает через плаценту. В то же время ряд авторов считают СРБ малоспецифичным, а повышение его концентрации возможным при физиологическом течении беременности [30].
Среди биомаркеров сепсиса наиболее высокой диагностической точностью обладает прокальцитонин (ПКТ) — предшественник гормона кальцитонина, вырабатываемый несколькими типами клеток различных органов под влиянием бактериальных эндотоксинов и провоспалительных цитокинов. При системном инфекционном поражении его уровень возрастает в течение 6–12 часов и может служить ранним диагностическим критерием сепсиса и системной воспалительной реакции. Вирусные инфекции, местные инфекции, аллергические состояния, аутоиммунные заболевания и реакции отторжения трансплантата обычно не приводят к повышению концентрации ПКТ, а его высокие уровни свидетельствуют о бактериальной инфекции с системной воспалительной реакции [4, 25]. По нашим данным, средние уровни ПКТ при нормальном течении беременности и реализованном ХА составляют 0,29 и 0,72 нг/мл (p
В. Н. Кузьмин, доктор медицинских наук, професcор
ГБОУ ВО МГМСУ им. А. И. Евдокимова, Москва
Перинатальные исходы при преждевременном разрыве плодных оболочек/ В. Н. Кузьмин
Для цитирования: Лечащий врач № 3/2018; Номера страниц в выпуске: 34-38
Теги: недоношенная беременность, осложнения, акушерская тактика
Источник