Что такое вода
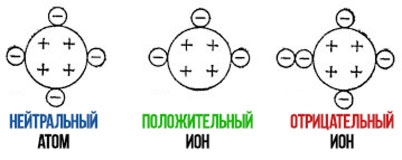
Все атомы и образованные из них молекулы устроены таким образом, что составляющие их частицы с противоположными электрическими зарядами (протоны и электроны) взаимно уравновешивают друг друга, благодаря чему атом или молекула являются электрически нейтральными частицами.
Однако, несмотря на нейтральность молекул, их структура в большинстве случаев такова, что образующие их положительные ядра атомов (протоны) и отрицательные электроны расположены внутри молекулы неравномерно, т. е. в какой-то ее части будут преобладать положительные заряды, а в другой соответственно — отрицательные заряды.
В простейшем (преобладающем) случае такая молекула, являющаяся в целом нейтральной, будет иметь два полюса с противоположными зарядами.
Такие молекулы называют диполями. К такого рода молекулам относятся молекулы воды, а также большинство молекул, построенных путем превращения в ионы составляющих их атомов.
Когда в результате процесса растворения молекула какого-либо вещества, например хлористого натрия, состоящая из двух взаимнопритянутых друг к другу ионов, положительного иона натрия Na + и отрицательного иона хлора С1 — (см. рис. 10,а), будет оторвана от кристалла соли и очутится в среде молекул воды, представляющих собой диполи, последние, в зависимости от их расположения, начнут вследствие взаимного притяжения противоположно заряженных полюсов молекул воды и молекул соли поворачиваться (ориентироваться) и притягиваться к диполю хлористого натрия, как это схематически показано на рис. 10,б.
Рис. 10. Механизм электролитической диссоциации: а — молекула растворенного в воде хлористого натрия; б — схема воздействия молекул воды на молекулу хлористого натрия; в — гидратированные ионы натрия и хлора.
В результате этого процесса около обоих ионов начнут собираться все в большем количестве молекулы воды, пока наконец силы, притягивающие ионы соли к молекулам воды, приведут к такому ослаблению связи этих ионов в молекуле соли, что последние под действием молекулярного движения начнут отделяться друг от друга.
При этом в растворе образуются положительные и отрицательные ионы диссоциированных (распавшихся) молекул шли, окруженные притянутыми к ним молекулами воды (рис. 10,в).
Такие окруженные молекулами воды ионы носят название гидратированных ионов, а сам процесс их окружения молекулами воды называют гидратацией ионов.
Что же будет происходить далее с образованными гидратированными ионами? Поскольку они имеют различные заряды (рис. 10,в), то возможно при встрече противоположно заряженных ионов их соединение в молекулы.
Таким образом, и здесь, так же как это отмечалось при рассмотрении процессов растворения, будет наступать момент динамического равновесия, когда оба эти процесса — электролитическая диссоциация и соединение ионов в молекулы (моляризация) — будут происходить с одинаковой скоростью, т. е. в единицу времени будет столько же молекул соли распадаться на ионы, сколько из этих ионов будет вновь образовываться тех же молекул соли.
Если мы будем каким-либо образом, например путем выпаривания, увеличивать концентрацию растворенной соли и образованных из нее гидратированных ионов, то при достижении концентрации насыщения данной соли начнется выделение из раствора ее кристаллов, в которых будут находиться гидратированные ионы.
При этом, если связь иона с окружавшими его молекулами была достаточна прочна, то этот ион войдет в состав кристалла вместе с некоторым количеством молекул воды, которую в этом случае называют кристаллизационной водой, а сами кристаллические образования, содержащие в своем составе воду, называют кристаллогидратами.
Состав кристаллогидратов обозначают, указывая при формуле вещества число молекул кристаллизационной воды, приходящихся на одну его молекулу.
Например, формула кристаллогидрата железного купороса будет: FeSО4 Х 7Н2О.
Количественная характеристика электролитической диссоциации какого-либо вещества определяется так называемой степенью диссоциации, т. е. отношением количества молекул соли, распавшихся на ионы, к общему количеству растворенных в воде молекул этой соли.
Обычно эту величину выражают в процентах, указывая, следовательно, какое количество из 100 растворенных молекул соли распадается на ионы.
Степень электролитической диссоциации зависит от концентрации раствора. При увеличении концентрации раствора создаются условия, благоприятствующие образованию молекул, так как вследствие большого количества ионов в единице объема раствора их взаимные встречи и столкновения будут происходить чаще, и, следовательно, в крепких растворах степень диссоциации будет уменьшаться.
Наоборот, при уменьшении концентрации раствора по тем же соображениям степень электролитической диссоциации возрастает, и в сильно разбавленных растворах значительное большинство растворенных молекул диссоциировано.
Ионы обозначаются теми же условными знаками, что и атомы и молекулы, но при этом указывается характер заряда иона (положительный или отрицательный) и его величина наверху справа от обозначения иона. Ионы с положительным зарядом называют катионами, а с отрицательным зарядом — анионами 1 .
1 Английский физик Фарадей, создавший основы электрохимии, для обозначения противоположности направлений, в которых движутся частицы, ввел для погруженных в электролит проводников названия: положительный электрод-анод, отрицательный электрод-катод, от греческих слов «ана» вверх, «ката» — вниз и «адос» — путь.
Ниже написаны для примера несколько электролитов из приведенных выше, в табл. 2, и ионы, на которые они распадаются в водном растворе:
Отсюда ионы с положительным зарядом, идущие к отрицательному электроду, получили название катионы, а ионы с отрицательным зарядом, идущие к положительному электроду — анионы.
Знак ↔ показывает обратимость процесса диссоциации. Величина заряда иона показывает число отданных или полученных им электронов, что, как мы уже знаем, определяет и валентность атома в данном соединении.
При этом понятие валентности в этих условиях может относиться не только к отдельным элементам, но и к их объединениям, образующим отрицательные ионы.
Так, в приведенных примерах мы видим, что ион ОН — является одновалентным, и поэтому для трехвалентного алюминия необходимо три таких иона, а ион SО4 2- — двухвалентен, и поэтому в сернокислом натрии ему противостоят два одновалентных иона натрия.
Источник
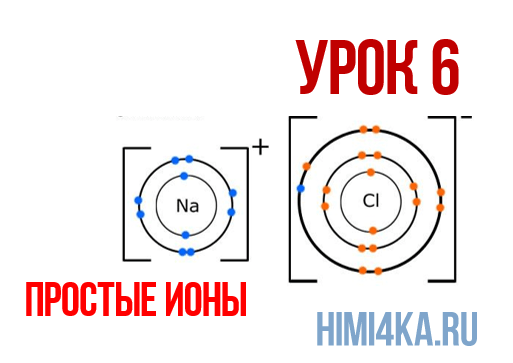
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
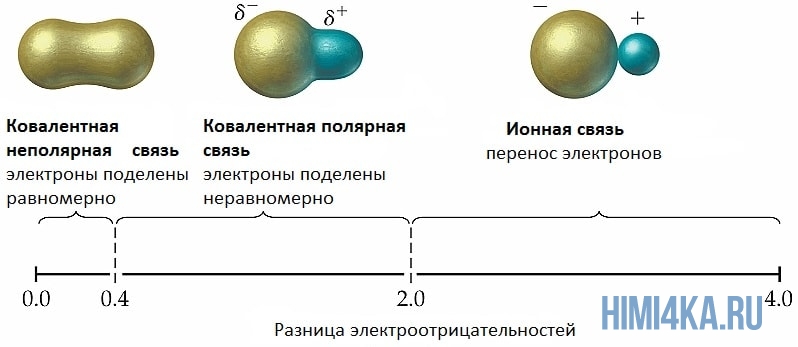
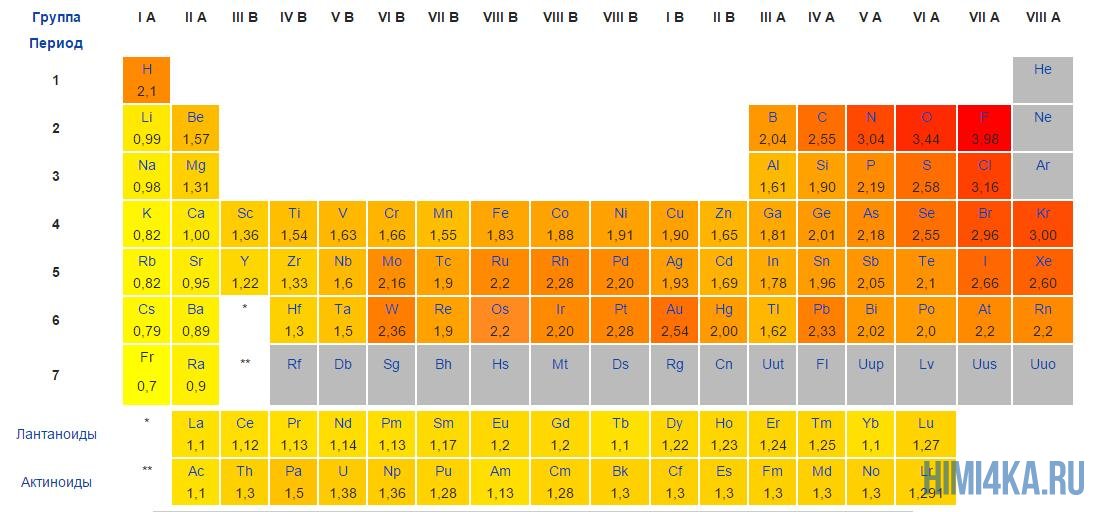
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
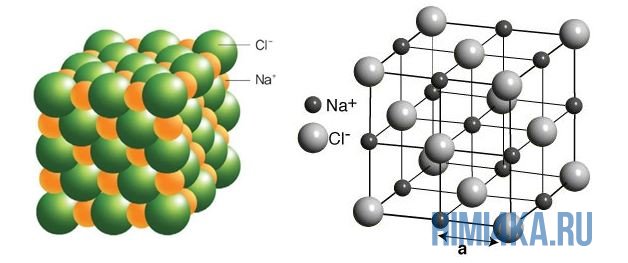
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e — ), образуя положительный ион натрия Na + , а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl — . Это записывается в виде двух реакций:
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl — окружен со всех сторон соседними положительными ионами натрия Na + ; ионы натрия Na + точно также окружены ближайшими хлорид-ионами Cl — . Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg 2+ или F 2- , называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg 2+ + 2e — → Mg
- Реакция окисления: F 2- → F + 2e —
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl — , имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl 3+ , имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H +1 , O -2 |
| CS2 | C(IV), S(II) | C +4 , S -2 |
| CH4 | C(IV), H(I) | C -4 , H +1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe 2+ железо(II) или ион двухвалентного железа
- Fe 3+ железо(III) или ион трехвалентного железа
- Сu + медь(I) или ион одновалентной меди
- Cu 2+ медь (II) или ион двухвалентной меди
- Sn 2+ олово(II) или двухвалентного олова
- Sn 4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe 3+ + e — → Fe 2+ . Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Урок 9. Ионы в водном растворе
В уроке 9 «Ионы в водном растворе» из курса «Химия для чайников» рассмотрим растворение соли в воде, а также электролиз растворов и расплавов солей; познакомимся с законами Фарадея для электролиза и научимся находить продукты электролиза. Базой знаний для данного урока послужит материал из урока 8 «строение солей».
Растворение соли в воде
Из прошлого урока нам известно, что соли трудно расплавить и еще сложнее довести ее до кипения, однако, полярные жидкости, такие как вода, способны растворять соли без особых усилий, поскольку неполные положительные и отрицательные заряды на атомах полярных молекул воды в какой-то мере заменяют собой положительные и отрицательные ионы в кристаллической решетке соли. Другими словами, молекулы воды помогают разрушить кристалл соли.
Из рисунка видно, что происходит с положительными и отрицательными ионами при растворении в воде кристалла поваренной соли NaCl. Каждый ион Na + окружается молекулами воды, которые обращены к нему отрицательно заряженными атомами кислорода. То же самое происходит с ионами Cl — , которые окружаются молекулами воды, обращенными к нему своими положительно заряженными атомами водорода. Ионы из кристалла соли оказываются гидратированными, а сам процесс присоединения молекул воды к ионам получил название — гидратация. Если в результате процесса гидратации устойчивость ионов, переходящих в раствор, становится больше их устойчивости в кристаллической решетке, то происходит растворение соли в воде. Хлорид натрия является отличным примером растворимой соли . И, наоборот, если энергия гидратации слишком мала, то кристалл является более устойчивой формой и не растворяется в воде. Примером таких нерастворимых солей является сульфат бария (BaSO4) и хлорид серебра (AgCl). Когда кристалл растворяется, он не просто распадается на ионы, а разъединяется на ионы молекулами жидкости, в которой происходит растворение. Неполярные жидкости (например, бензин С8H18) НЕ способны разъединять ионы в кристаллической решетке солей.
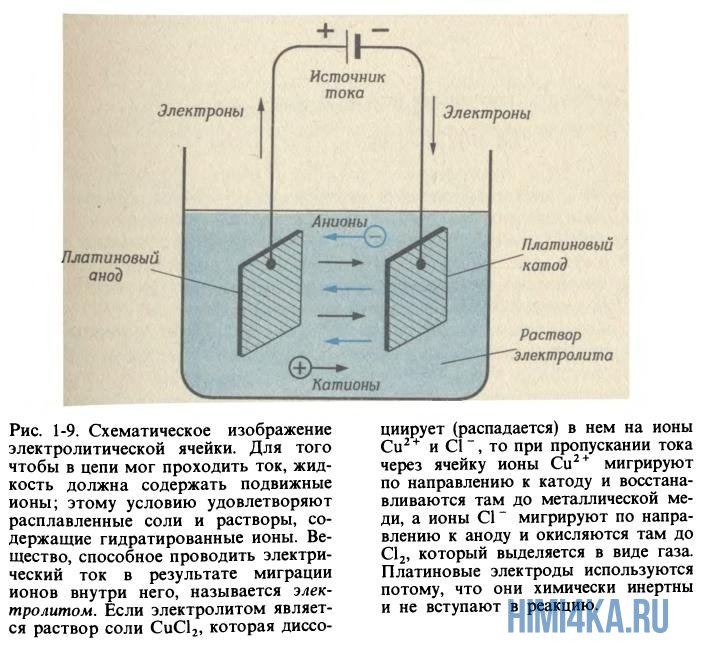
Электролиз растворов и расплавов солей
Металлы хорошо проводят ток — это знает каждый школьник. Электропроводность в металлах вызвана перемещением электронов в них, но ионы металла остаются неподвижными. Хотя кристаллы солей не проводят ток, зато растворы и расплавы солей это умеют и практикуют, так как анионы (отрицательные ионы) и катионы (положительные ионы) могут направленно перемещаться в противоположные направления, если приложить напряжение. Подвижность ионов соли оказывается еще большей, если она подверглась процессу гидратации.
Давным-давно английский ученый Майкл Фарадей расплавил соль (нагрев ее выше 801ºС), затем погрузил в расплав два электрода (катод и анод), а после взял и пропустил электрический ток через расплавленную соль. После этих манипуляций он обратил внимание что на электродах начали протекать химические реакции: ионы натрия начали мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия
Хлорид-ионы мигрируют в другом направлении-в сторону анода, отдают ему свои избыточные электроны и окисляются до газообразного хлора
Все это можно изобразить с помощью полной реакции, которая представляет собой разделение NaCl на составляющие его элементы:
Весь процесс получил название электролиз, что означает «разрыв на части при помощи электричества». Для электролиза не обязательно расплавлять соль, можно также использовать обычный водный раствор соли, ведь подвижность ионов оказывается еще большей, если соль подверглась процессу гидратации. Но тогда полная реакция будет выглядеть иначе, и на катоде будет выделяться не металлический натрий, а газообразный водород:
Надеюсь, что вам стало интересно, почему продуктом электролиза водного раствора является не Na (как это было в расплавленной соли), а ½H2. Объясняется просто: часть молекул H2O диссоциируют на ионы H + и OH — . Поскольку ион H + обладает большим сродством к электрону (то есть сильнее его притягивает), нежели ион Na + , то ионы H + первыми достигают катода, где незамедлительно восстанавливают недостающий электрон и превращаются из иона в полноценный газ H2, а ионы Na + так и остаются в растворе.
Вот вам плюшка с продуктами электролиза водного раствора солей, может пригодится — может нет, но лучше законспектируйте:
А Фарадей тем временем не сидел без дела, а наблюдал, проводил опыты, использовал другие электролиты, увеличивал-уменьшал заряд и опять наблюдал. В конце концов он заметил взаимосвязь между количеством подаваемого электричества и количеством получаемых веществ. Установленные им закономерности называются законы Фарадея для электролиза. Сформулируем их:
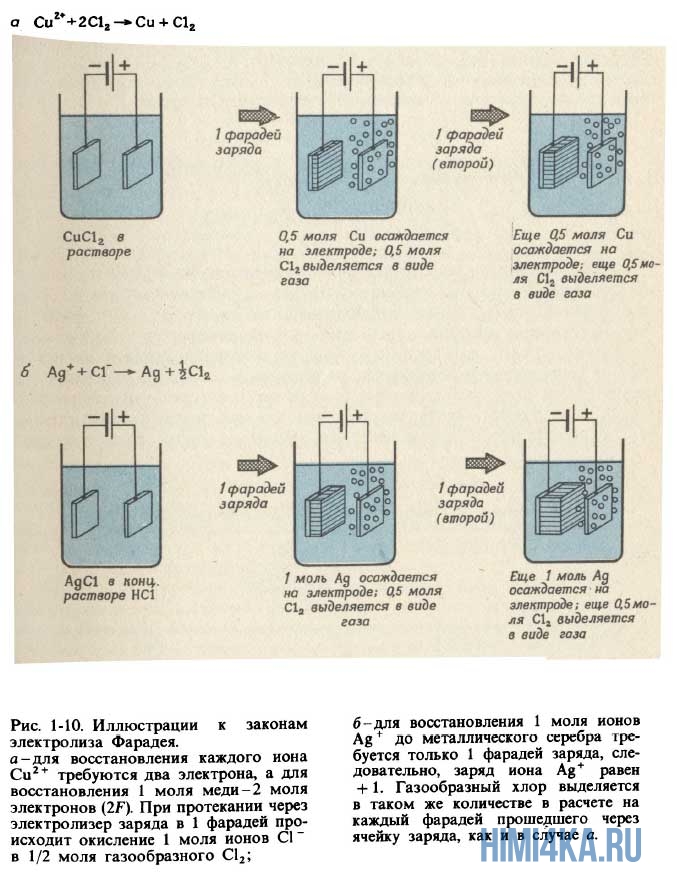
- Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса элемента, выделяемого на электроде, пропорциональна количеству заряда, пропущенному через электролитическую ячейку.
- Для выделения на электроде 1 моля вещества, которое в процессе электрохимической реакции приобретает или теряет 1 электрон, необходимо пропустить через ячейку 96485 кулонов (Кл) электричества. Если в реакции принимает участие N электронов, для выделения моля продукта необходимо N ·96485 Кл электричества.
Количество электричества, равное 96485 Кл, получило название 1 фарадей и обозначается символом F. Законы Фарадея становятся очевидными, если принять во внимание, что 1 F — это просто заряд 1 моля электронов, т.е. 6,022 1023 электронов. Множитель 6,022-1023, позволяющий переходить от индивидуальных молекул к молям вещества, одновременно позволяет перейти и от 1 электронного заряда к 1 F электрического заряда. Разумеется, в свое время Фарадей ничего не знал ни о числе Авогадро, ни о заряде электрона. Однако из проведенных экспериментов он смог сделать вывод, что заряды на ионах кратны некоторой элементарной единице заряда, так что 96485 Кл электричества соответствуют 1 молю таких единиц. Термин электрон впервые появился в 1881 г.; его ввел английский физик Дж.Стоней для обозначения элементарной единицы ионного заряда. Применять термин «электрон» к реальной отрицательно заряженной частице начали спустя еще 10 лет.
1 пример. Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль NaCl. Сколько граммов натрия и хлора выделится при пропускании 1 F электричества через электролитическую ячейку?
Решение: Уравнение реакции, протекающей на катоде: Na + + е — → Na, а уравнение 1 анодной реакции: Сl — → Cl2 + е — . Когда через расплавленную соль NaCl проходит 1 моль электронов (1 F), каждый электрон восстанавливает 1 ион натрия, в результате чего образуется 1 моль атомов натрия. Следовательно, на катоде выделяется 22,990 г Na. На аноде происходит удаление 1 моля электронов от 1 моля хлорид-ионов, после чего остается 1 моль атомов хлора, которые попарно соединяются, образуя 1/2 моля молекул Сl2. Следовательно, масса газообразного хлора, выделяющегося на аноде, должна быть равна 35,453 г (что равно атомной массе Сl, или половине молекулярной массы Сl).
Пример 2. Сколько граммов металлического магния и газообразного хлора выделяется при пропускании 1 F электричества через электролитическую ячейку с расплавленным хлоридом магния, MgCl2?
Решение: На катоде происходит реакция Mg 2+ + 2е — → Mg, а на аноде — реакция 2Сl — → Сl2 + 2е — . Поскольку для восстановления каждого иона Mg 2+ необходимо 2 электрона, 1 моля электронов хватит только для восстановления половины моля ионов магния, таким образом на катоде должно выделиться 12,153 г магния. (Атомная масса магния равна 24,305 г/моль.) Как и в примере 1, на аноде окислится 1 моль ионов Сl — и выделится половина моля, т.е. 35,453 г, газообразного Сl2.
Пример 3. Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы Аl 3 + . Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг металла.
Решение: 1 кг алюминия содержит 1000 г / 26,98 г·моль -1 = 37,06 моля атомов. Поскольку на выделение каждого атома алюминия необходимо 3 электрона, на 37,06 моля атомов потребуется 3·37,06 = 111,2 моля электронов. Это количество электричества эквивалентно 111,2F, или 10 730 000 Кл.
Надеюсь урок 9 «Ионы в водном растворе» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к уроку 10 «Ионы в газе».
Источник