Тема 1.4. Свойства и применение воды. Растворы
план-конспект урока
Опорный конспект по теме » Вода . Свойства воды . Водные растворы » для самостоятельного изучения и подготовки к уроку. . Водные растворы . Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды .
Скачать:
| Вложение | Размер |
|---|---|
| Вода. Свойства воды. Растворы | 34.06 КБ |
| Кроссворд Свойства воды | 15.37 КБ |
| Презентация .Вода | 1.02 МБ |
| Дополнительный материал к уроку | 901.91 КБ |
| Домашнее задание. Ответить на вопросы | 13.1 КБ |
Предварительный просмотр:
Тема урока: «Вода. Свойства воды. Водные растворы»
Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н 2 О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь : 
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н 2 O . С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н 2 O = 2LiOH + Н 2 ↑,
Са + 2Н 2 O = Са(ОН) 2 + Н 2 ↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н 2 O = ZnO + Н 2 ↑,
3Fe + 4Н 2 O = Fe 3 O 4 + 4Н 2 ↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи :
Na 2 O + Н 2 O = 2NaOH,
СаО + Н 2 O = Са(ОН) 2 .
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты :
СO 2 + Н 2 O = Н 2 СO 3 ,
SO 3 + Н 2 O = H 2 SO 4 .
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К 2 СO 3 + Н 2 O = КНСО 3 + КОН,
РСl 3 + ЗН 2 O = Н 3 РО 3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C 2 H 5 OH — реакция этилена С 2 Н 4 с водой:
С 2 Н 4 + Н 2 O = С 2 Н 5 ОН.
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са 2+ , Mg 2+ , Fe 2+ . Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО 3 ) 2 , магния Mg(HCO 3 ) 2 и железа Fe(HCO 3 ) 2 . При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO 3 ) 2 = СаСО 3 ↓ + СO 2 ↓ + Н 2 O,
Fe(HCO 3 ) 2 = FeCO 3 ↓ + CO 2 ↓ + Н 2 O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl 2 + Na 2 CO 3 = СаСO 3 ↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Источник
Конспект урока по теме «Вода. Растворы. Растворение»

Растворы играют важную роль в природе, науке и технике. Сложные физико-химические процессы, протекающие в организмах человека и животных, также протекают в растворах. Изучение свойств растворов занимает важное место в современной науке.
Просмотр содержимого документа
«Конспект урока по теме «Вода. Растворы. Растворение»»
Тема «Вода. Растворы. Растворение»
Цель урока: Создать условия для высокого уровня воспроизведения системы знаний и умений студентов потеме «Вода. Растворы. Растворение».
Образовательные: ввести понятия растворов, гидратов, разобрать типы растворов, классификацию растворов, факторы, влияющие на растворение веществ; основные положения физической, химической и современной теории растворов.
Развивающие: развивать умения и навыки мыслительной деятельности (умения обобщать, сравнивать, анализировать), общеучебные умения и навыки (формирование самостоятельной и познавательной деятельности учащихся);
Воспитательные:воспитывать положительное отношение к учению, способствовать осознанию роли знаний в развитии личности, воспитании характера, преодолении трудностей.
Тип урока: учебное занятие по изучению нового материала.
Методы: частично-поисковые, практические, наглядные.
Форма проведения урока: коммуникативно-диалоговая.
Формы организации деятельности учащихся: индивидуальная, групповая, обще групповая.
Ход урока: урок начинается с демонстрации стакана с водой и показа лабораторного опыта- растворение поваренной соли в воде.
ТБ. Опыт 1: хлорид натрия, вода
Далее звучит вопрос группе: Как вы думаете, о чем сегодня пойдет речь на уроке?
(«Вода. Растворы. Растворение веществ в воде»). Слайд 2
Запись темы в тетради и демонстрация на слайдетемы «Вода. Растворы. Растворение».
Актуализация опорных ЗУН.
Вопрос группе: Какие сведения о воде и растворах были известны вам до сегодняшнего урока? (Слайд 3)
Знакомство студентов с задачами урока ( слайд 4)
На столах лежит раздаточный материал со словами Антуана де Сент-Экзюпери: (слайд 5)
Вода, у тебя нет ни вкуса, ни цвета, ни запаха,
Тебя невозможно описать, тобой наслаждаются не ведая, что ты такое.
Нельзя сказать, что ты необходима для жизни:
Вопрос группе: что означают эти слова?
«Значение воды для жизни человека» (сообщение студента)
Растворы играют важную роль в природе, науке и технике. Сложные физико-химические процессы, протекающие в организмах человека и животных, также протекают в растворах. Изучение свойств растворов занимает важное место в современной науке.
Давайте представим себя в роли сторонников этих теорий.
Работа по группам ( работа с текстом).
1 вариант – представители физической теории,
2 вариант – представители химической теории
Через 3 минутывы должны объяснить основную идею своей теории и назвать имена учёных, сторонников теории.
Обсуждение теорий сопровождается разбором схемы.(слайд 5)
Физическая теория: Химическая теория:
(Вант-Гофф, Оствальд, Аррениус). (Менделеев, Каблуков,
Растворение — это процесс диффузии, Растворение – это процесс
а растворы – это однородные смеси. химического взаимодействия
растворяемого вещества сводой-
процесс гидратации, а
растворы – это соединения –
Теперь вопрос- Как вы думаете, какая из этих теорий близка к современной теории о растворах?
Растворение – это физико – химический процесс, а растворы – это однородная (гомогенная) система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия – гидратов.
Гидраты – непрочные соединения веществ с водой, существующие в растворе. (слайд6 )
Студенты записывают определения в тетрадь со слайда
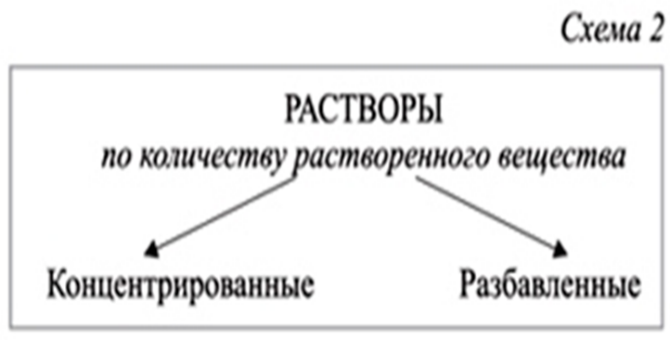
Растворимость веществ. Типы растворов.
От чего зависит растворение веществ?(слайд 8)
Вспоминаем со студентами инструктаж по ТБ. Далее идет демонстрация опытов: Опыт 2 -растворение разных веществ в воде.
1) от природы веществ. — хорошо растворимые;
-практически нерастворимые (слайд9 )
Рассмотрите таблицу растворимости кислот, оснований и солей в воде, приведите примерырастворимых, малорастворимых и нерастворимых веществ (работа с таблицей растворимости).
Опыт 3: нагревание пробирки с раствором гидроксида кальция
2) от температуры
После демонстрации опытов студенты должны самостоятельно ответить на вопрос, поставленный ранее.
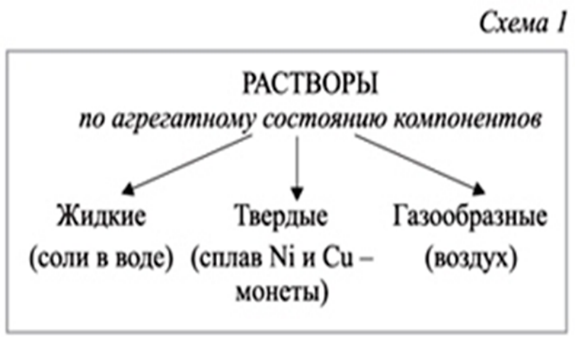
На слайде показаны схемы классификации растворов. На примере опытов студентам ставится задача найти отличия между растворами.
Опыт 4: сульфат меди, химический стакан с водой.
Концентрированный раствор — раствор с высоким содержанием растворённого вещества.
Разбавленный раствор- раствор, содержащий малое количество растворённого вещества. (слайд 11). Работа с определениями.
Студентам предлагается по изображению на презентации определить типы растворов.(слайд 12-13)
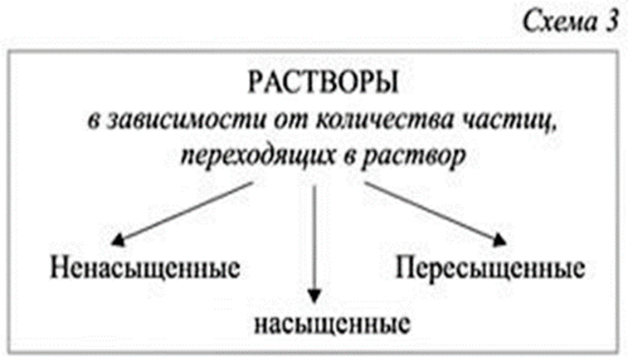
Демонстрация опыта 5 – растворение поваренной соли в воде, получение разных растворов по количеству частиц, переходящих в раствор. Студенты сами дают определения видам растворов.
Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется.
Ненасыщенным называют такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
Пересыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. (слайд14)
Сегодняшний урок был посвящен теме «Вода.Растворы. Растворение», я предлагаю вам ответить на вопрос «Что нового вы узнали сегодня о воде, растворах?» (слайд 15)
(Закрепление изученного материала.)
Студентам предлагается ответить на вопросы:
1)Если вы были внимательны и уверены в себе, что все изученные вопросы усвоили, поставьте себе «5».
2) Если вы были внимательны, усвоили материал в целом, но на вопросы ответить можете, поставьте «4».
3) Кто сомневается, поставьте себе «3». (слайд 16)
Далее студенты выполняют упражнение «Данетка» по вариантам, затем студенты обмениваются листочками и оценивают своего соседа с помощью ответов продемонстрированных на слайде презентации.(слайд 17-18)
Рефлексия: (слайд 19)
Что вы считаете для себя главным на уроке?
Сегодня урок химии: легкий – трудный; интересный – скучный; полезный – ненужный?
Я ученик: старательный – ленивый; внимательный – невнимательный; урок усвоил – не усвоил.
Выводы по изученному материалу делают студенты в устной форме.
Домашнее задание п. 17 учебника, конспект по тетради. (слайд 20)
Источник
Конспект урока по химии на тему: «Вода. Растворы. Растворение».
на тему: «Вода. Растворы. Растворение»
Цель урока: Создать условия для высокого уровня воспроизведения системы знаний и умений студентов по теме «Вода. Растворы. Растворение».
Образовательная: повторить понятия растворов, растворение, растворимое вещество; разобрать типы растворов, классификацию растворов, факторы, влияющие на растворение веществ;
Развивающая: развивать умения и навыки мыслительной деятельности (умения обобщать, сравнивать, анализировать), общеучебные умения и навыки (формирование самостоятельной и познавательной деятельности обучающихся);
Воспитательная: воспитывать положительное отношение к учению, способствовать осознанию роли знаний в развитии личности, воспитании характера, преодолении трудностей;
Методическая: использование интеграции (межпредметных связей) для развития познавательных интересов и коммуникативных качеств, обучающихся на уроке изучения нового материала.
Средства: презентация, таблица растворимости веществ, раздаточный материал, химическое оборудование (химические стаканы с водой, стеклянная палочка, мерный цилиндр, технические весы, разновесы, хлорид натрия, сахароза, сода).
Тип урока : повторительно-обобщающий по изученной теме с элементами внешней интеграции (химия, биология, основы калькуляции, МДК.02.02).
Методы: частично-поисковые, практические, наглядные.
Форма проведения урока : коммуникативно-диалоговая.
Формы организации деятельности обучающихся : индивидуальная, групповая, фронтальная.
Источник