- Вода растворы растворение видеоурок
- Растворение как физико-химический процесс. Растворимость. Типы растворов
- Урок 33. Химия 8 класс
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Растворение как физико-химический процесс. Растворимость. Типы растворов»
- Вода.Растворы.Растворение.
- Содержимое разработки
Вода растворы растворение видеоурок
Письмо с инструкцией по восстановлению пароля
будет отправлено на вашу почту
- Главная
- 8-Класс
- Химия
- Видеоурок «Растворы. Растворимость веществ»
В повседневной жизни мы каждый день встречаемся с различными растворами. Как это понятие определяется в науке?
Для приготовления растворов необходимо иметь растворитель (вода, бензин, ацетон и другие) и растворяемое в нем вещество (поваренная соль, лак и другие).
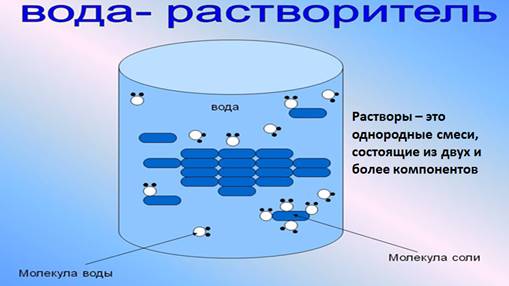
Раствором называется однородная система, состоящая из двух или более компонентов (растворителя, растворенных веществ и продуктов их взаимодействия), относительные количества которых могут изменяться в широких пределах.
Между молекулами растворителя и частицами растворенного вещества происходят физические и химические взаимодействия с образованием некоторых продуктов.
Растворителем считают тот компонент раствора, который в чистом виде существует в том же агрегатном состоянии, что и раствор. Например, если раствор водный, то растворитель – вода. Если оба компонента находятся в одном агрегатном состоянии, то растворителем считается тот, которого больше.
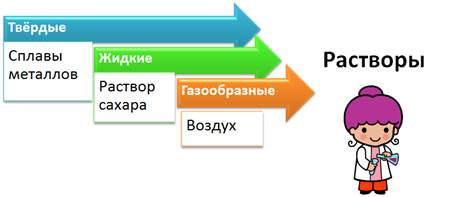
Растворы могут быть газообразными, как воздух – раствор кислорода в азоте, жидкими, как морская вода – раствор солей в воде, твердыми, как сталь – раствор углерода в железе.
Растворы занимают промежуточное положение между индивидуальными химическими соединениями и гетерогенными смесями. С веществами их объединяет однородность, а с гетерогенными смесями – легко меняющийся состав и сохранение многих свойств исходных компонентов.
В растворе между растворителем и растворяемым веществом происходит как физическое, так и химическое взаимодействие. Физическое взаимодействие компонентов раствора – это переход многих свойств растворенного вещества в раствор. Например, при растворении сахара весь раствор становится сладким. При растворении многих окрашенных веществ раствор приобретает их окраску.
При растворении можно наблюдать и признаки химического взаимодействия. Это выделение и поглощение теплоты при растворении различных веществ. Например, при растворении в воде концентрированной серной кислоты выделяется большое количество теплоты. Кроме того, некоторые вещества при растворении изменяют окраску. Например, безводный сульфат меди белый, а в водном растворе он голубого цвета.
Способность веществ растворяться в каком-либо растворителе называется растворимостью. Вода – наиболее универсальный растворитель.
Из жизненного опыта нам известно, что растворимость веществ не безгранична. По степени растворимости вещества можно разделить на практически нерастворимые (содержащие не более 0,001 г в 100 г раствора, например, хлорид серебра), малорастворимые (в 100 г раствора может быть не более 1 г вещества, например, гипс) и хорошо растворимые (в 100 г раствора может содержаться более 1 г, например, сахар).
В соответствии с количеством растворённого вещества растворы могут быть ненасыщенными, насыщенными и пересыщенными.
Раствор, в котором данное вещество при данной температуре и постоянном давлении больше не растворяется, называется насыщенным, а раствор, в котором ещё может раствориться добавочное количество данного вещества, ненасыщенным. Например, насыщенный раствор поваренной соли при комнатной температуре образуется при растворении в 100 г воды 36 г соли. Если мы добавим ещё некоторое количество соли, то она выпадет в осадок. Однако при нагревании смеси соли с водой до 100° С в 100 г воды может раствориться 39,8 г соли. При охлаждении такого раствора избыток соли не всегда выпадает в осадок. Такие растворы называются пересыщенными. Они очень неустойчивы.
Количественно растворимость характеризуется коэффициентом растворимости.
Коэффициент растворимости – это отношение массы вещества, образующего насыщенный при данной температуре раствор, к объёму растворителя.
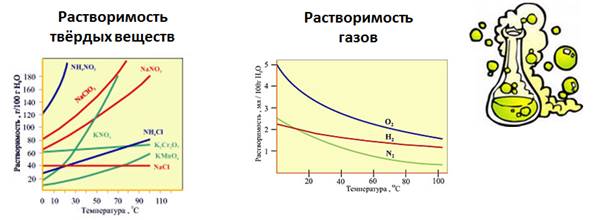
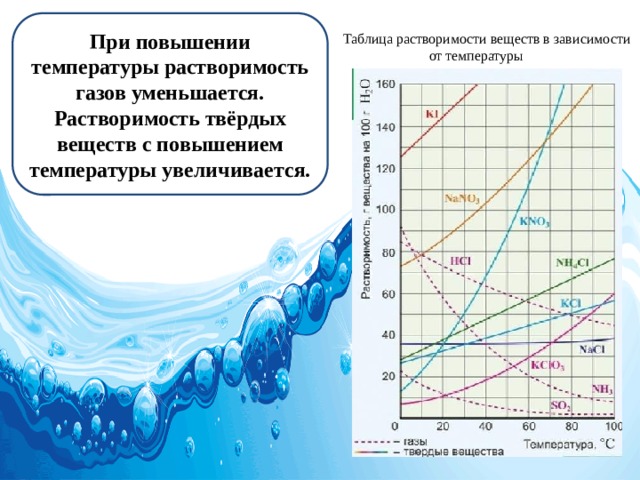
Например, коэффициент растворимости поваренной соли при 20° С равен 0,36. Это значит, что 36 г вещества растворяются в 100 мл (100 г) воды, образуя насыщенный раствор при 20° С. Растворимость большинства твёрдых веществ, за исключением немногих, например, гипса, извести, с повышением температуры возрастает.
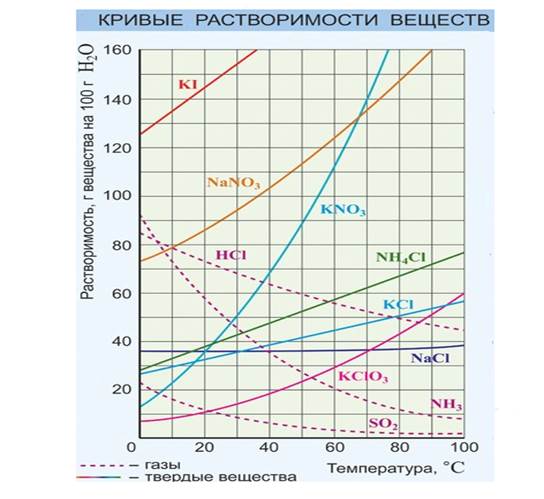
Графически зависимость растворимости от температуры выражается так называемыми кривыми растворимости.
По кривым растворимости можно определить растворимость вещества при различной температуре, выбрав соответствующую точку. Например, растворимость калийной селитры KNO3 при 70° С – 160 г в 100 мл воды. Давление практически не оказывает влияния на растворимость твердых веществ.
Растворимость газов бывает различна. Некоторые газы, такие как водород, инертные газы, малорастворимы в воде. Другие газы, например, аммиак, хлороводород, хорошо растворимы. Растворимость газов возрастает при понижении температуры и повышении давления.
Источник
Растворение как физико-химический процесс. Растворимость. Типы растворов
Урок 33. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Растворение как физико-химический процесс. Растворимость. Типы растворов»
Растворы играют огромную роль в природе, науке и технике. Природная вода также являются раствором, ведь в ней содержатся растворенные вещества. В пресной воде солей мало, а в морской их содержится около 3,5 %. В первичном океане, из которого зародилась жизнь на Земле, содержание солей составляло около 1%. Как писал американский химик Лайнус Полинг: «Именно в этом растворе впервые развились живые организмы, и из этого раствора они получили ионы и молекулы, необходимые для их роста и жизни… С течением времени живые организмы изменялись и развивались, что позволило им покинуть водную среду и перейти на сушу и затем подняться в воздух. Они приобрели эту способность, сохранив в своих организмах водный раствор в виде жидкостей, содержащий необходимый запас ионов и молекул».
В каждой нашей клеточке напоминание о зарождении жизни. По нашим сосудам: артериям, венам и капиллярам тоже течет раствор, где содержание солей около 0,9%. Плазма крови, желудочный сок тоже являются растворами. Все физико-химические процессы, происходящие в живых организмах, протекают тоже в растворах. Природные водные растворы участвуют в почвообразовании и снабжают растения питательными веществами. Многие технологические процессы также протекают в растворах (получение бумаги, красок, металлов, удобрений, продуктов питания).
Растворы в организме человека
Растворы в промышленности
Растворы – это однородные смеси, состоящие из двух и более компонентов.
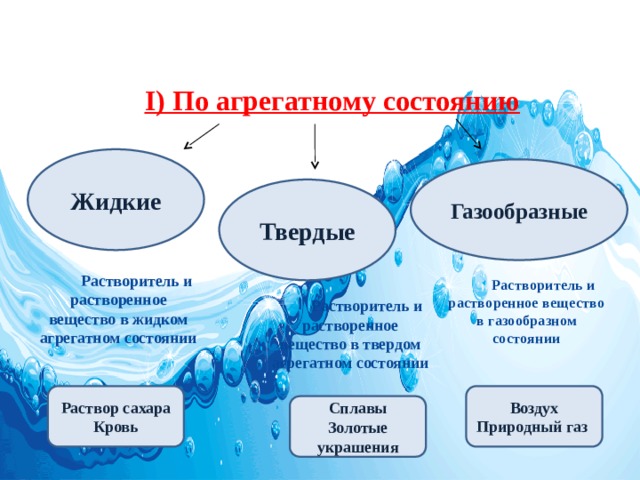
По агрегатному состоянию растворы делят на: твердые (например, сплавы металлов), жидкие (раствор сахара), газообразные (смесь газов – воздух). Наиболее распространены жидкие растворы.
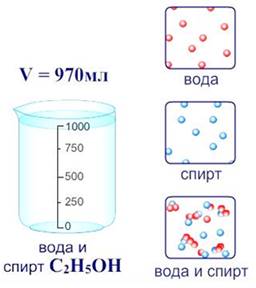
Растворы состоят из растворителя и растворенного вещества (твердого, жидкого или газообразного). Растворителем может быть вода, тогда раствор является водным, а также бензин, эфир, спирт.
Как происходит растворение веществ?
Сторонники физической теории растворов, как Вант-Гофф, Аррениус, Оствальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения молекул растворенного вещества между молекулами воды.
Сторонники химической теории растворов, одним из которых был Д. И. Менделеев, считали, что растворение является химическим взаимодействием растворенного вещества и воды.
В настоящее время принята физико-химическая теория растворов, которую ещё в 1906 г. предсказывал Д. И. Менделеев. Поэтому растворение является физико-химическим процессом.
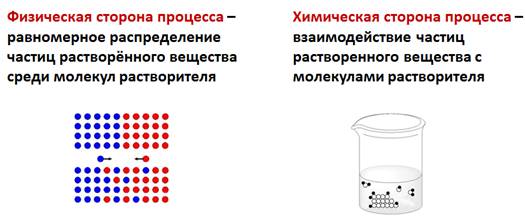
Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя. Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
В результате взаимодействия растворенного вещества и воды образуются гидраты. Растворение сопровождается тепловыми эффектами: при растворении серной кислоты воду добавляют к кислоте, из-за сильного разогревания раствора, т.е. теплота выделяется, а при растворении нитрата аммония, хлорида натрия, теплота, наоборот, поглощается.
Кроме гидратов есть еще кристаллогидраты, т.е. это кристаллические вещества, содержащие молекулы воды. Вода, входящая в их состав – кристаллизационная. Примером кристаллогидратов служит медный купорос – CuSO4 · 5H2O. Медный купорос является веществом голубого цвета, а безводный сульфат меди (II) – белый, при растворении в воде, раствор становится голубого цвета.
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
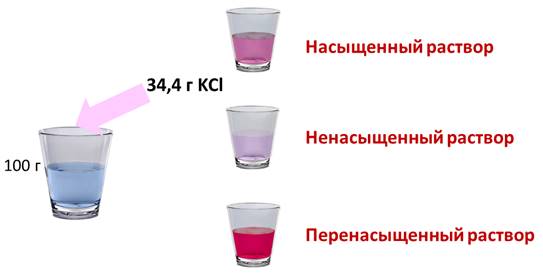
Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный. Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным. Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным. Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется перенасыщенный раствор. Перенасыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.
По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет. Даже атомы серебра чуть-чуть переходят в раствор из изделий, помещенных в воду.
Источник
Вода.Растворы.Растворение.
Содержимое разработки
Педагогический конкурс «Лучшая презентация к занятию»
Краевое государственное бюджетное профессиональное образовательное учреждение «Ребрихинский лицей профессионального образования»
Вода. Растворы. Растворение.
Вовк Оксана Васильевна
- Познакомиться с понятиями «раствор», «растворение», «растворимость», «растворитель», «растворенное вещество»;
- Узнать виды классификаций растворов;
- Научиться определять растворимость различных веществ экспериментально и теоретически, влияние различных условий на процесс растворения;
- Осознать необходимость бережного отношения к воде.
- Состав воды.
- Нахождение воды в природе.
- Физические свойства воды.
- Растворение. Растворы.
- Значение воды и растворов.
«Воде была дана волшебная власть стать соком жизни
Леонардо да Винчи
Жизнь человека во все времена самым тесным образом была связана с водой, от нее зависело не только благополучие, но и нередко само существование целых народов…
Не случайно большинство крупных поселений – начиная со стоянок древнего человека и заканчивая современными многомиллионными городами – возникли по берегам крупных водоемов: рек, озер, морей.
- Вода – одно из начал всего существующего на Земле,- говорили в древности.
- Вода – простое вещество, единое и неделимое, — считали в средние века.
- Нет, — сказал великий А. Лавуазье, — вода состоит из водорода и кислорода, её можно получить с помощью химической реакции.
- Свойства воды во многом определяют свойства растворов, — утверждал Д.И. Менделеев
- Даже этого слишком мало, — говорят в наши дни, — чтобы объяснить аномальные свойства воды и многое другое в её поведении.
Что такое вода? — Минерал не имеющий цвета, Не имеющий запаха, формы, но ты оглянись – Это главное таинство, главное чудо Планеты, Это главный исток, из которого вылилась Жизнь. Без воды на Планете не мыслимо что-то живое И вода вездесуща – и в недрах, и по над землей, И планету Земля, во Вселенной зерно голубое, Было б много точнее назвать не Землёй, а Водой. Океаны и реки, озёра и вечные льдины, Сок деревьев и трав, кровь живущих зверей и людей – Это только вода, это Жизни самой сердцевина, Это плазма Планеты, а может Галактики всей. Мы не ценим её, мы, как дети с игрушкой играем, С этим главным сокровищем, таинством Жизни, водой, Загрязняем её, отравляем её, убиваем… Ну, а если когда-то игра обернётся бедой?
вода водород кислород
2молекулы 2 молекулы 1 молекула
Молекула воды состоит из:
двух атомов водорода и
одного атома кислорода.
Молярная масса 18,01528 г/моль.
2. Нахождение воды в природе
Вода- самое распространенное вещество на Земле.
Где она находится?
Запасы воды на земле
Суша ¼ поверхности. Вода ¾ поверхности
- Более 70 % поверхности Земли покрыто водой. Объем её равен примерно 1,4 миллиардов кубических километров. Наша планета – планета океанов. Три четверти поверхности её заняты морями и океанами.Вода на поверхности планеты бывает двух видов: соленая и пресная.97 % всех водных ресурсов – запасы Мирового океана, не пригодные для питья.Запасы пресной воды в мире – около 3 % от общего количества воды, из них 2 % воды сосредоточено в полярных льдах и ледниках.Таким образом, только 1% воды на планете пригоден для питья.
3. Физические свойства воды
твердое(лед) жидкое газообразное
- Вкус —без вкуса;
- Цвет —без цвета;
- Запах —без запаха;
- Температура кипения –99,9740С;
- Температура плавления —00С;
- Плотность воды при 40С –0,9982г/см3;
- Плотность льда при температуре меньше 00С —0,92г/см3;
- Теплопроводность и электропроводность –плохая;
- Теплоемкость —исключительно большая (вода медленно нагревается и медленно остывает);
- Способность растворять вещества –хорошая.
4.Вода- растворитель. Растворение. Растворы.
В воде растворяются и твердые вещества, и жидкости и газы.
Газированная вода – раствор углекислого газа в воде;
Столовый уксус – раствор уксусной кислоты в воде;
Любая природная вода – раствор.
Вода океанов содержит 35 г/л растворенных веществ, главным образом солей (NaCl,…);
Ежегодно с водами Волги в Каспийское море приносится более 60 млн.т растворенных солей
Питьевая вода из разных источников имеет разный химический состав, а значит и разный вкус.
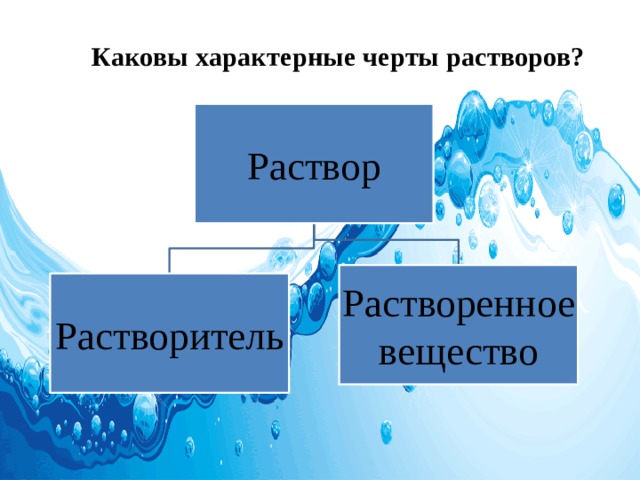
Каковы характерные черты растворов?
- Раствор – гомогенная система, состоящая из 2-х и более независимых компонентов, а также продуктов их взаимодействия .
- Растворитель — вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, не изменяя их химически.
- Растворенное вещество —компонент жидкого или твердого раствора,
который присутствует в меньшем или
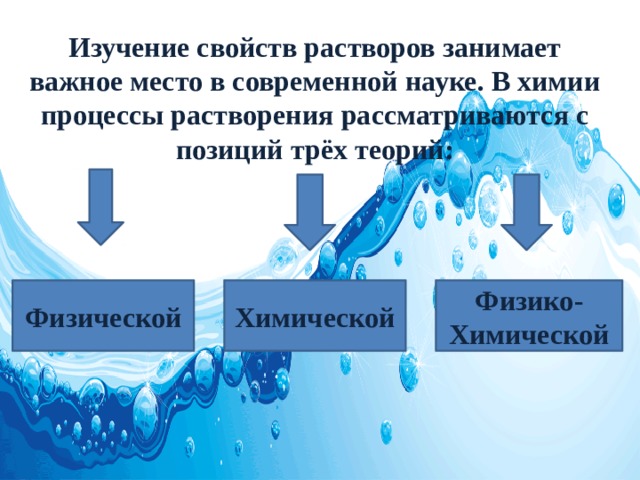
Изучение свойств растворов занимает важное место в современной науке. В химии процессы растворения рассматриваются с позиций трёх теорий:
Якоб Хендрик Вант-Гофф
Сванте Август Аррениус
Вильгельм Фридрих Оствальд
Процесс растворения является процессом диффузии, т.е проникновение растворенного вещества в промежутки между молекулами воды
Раствор – однородная смесь, состоящая из двух или более однородных частей.
Дмитрий Иванович Менделеев
Процесс растворения – это результат взаимодействия вещества с молекулами воды.
Раствор — это однородная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
При взаимодействии растворённого вещества с водой образуются гидраты .
Гидраты — это непрочные соединения веществ с водой, существующие в растворе.
Растворитель – компонент раствора, количественно преобладающий и находящийся в том же агрегатном состоянии.
Косвенным доказательством гидратации является существование твердых кристаллогидратов
self made by FischX
Кристаллогидраты – соли и другие твердые вещества, в состав которых входит вода.
В настоящее время принята теория, которая объединяет обе точки зрения,- физико-химическая теория растворов. Её предсказал Д.И. Менделеев в своём учебнике “Основы химии», в 1906 году.
Растворение – это физико-химический процесс.
- Прифизическомявлении разрушается кристаллическая решетка и происходит диффузия молекул растворенного вещества.
- Прихимическомявлении в процессе растворения молекулы растворенного вещества реагируют с молекулами растворителя.
Теории, изучающие процессы растворения
Сторонники теории (авторы)
Вант-Гофф, Аррениус и Оствальд
Результат диффузии, т е. проникновения растворенного вещества в промежутки между молекулами воды
Д.И. Менделеев, В.И. Каблуков
Результатом химического взаимодействия растворенного вещества с молекулами воды
Результат диффузии и химического взаимодействия (учебник «Основы химии»)
I) По агрегатному состоянию
Растворитель и растворенное вещество в жидком агрегатном состоянии
Растворитель и растворенное вещество в газообразном состоянии
Растворитель и растворенное вещество в твердом агрегатном состоянии
II) По количеству растворенного вещества
Концентрированный раствор — раствор с высоким содержанием растворённого вещества.
Разбавленный раствор- раствор, содержащий малое количество растворённого вещества .
III) В зависимости от количества растворённого в растворителе вещества
- Насыщеннымназывают такой раствор, в котором при данной температуре вещество больше не растворяется.
- Ненасыщеннымназывают такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
- Пeренасыщеннымназывают такой раствор, в котором при данной температуре находится в растворённом состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Что такое растворимость?
Растворимость – это способность вещества разрушаться до молекул или ионов.
Растворимость -это способность веществ растворяться в каком-либо растворителе.
Растворимость — максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре.
От чего зависит растворимость веществ?
2. От природы растворителя
3. От природы вещества
При повышении температуры растворимость газов уменьшается. Растворимость твёрдых веществ с повышением температуры увеличивается.
Таблица растворимости веществ в зависимости от температуры
Зависимость растворимости от природы растворителя
Растворение медного купороса
В зависимости от способности вещества растворяться в воде, оно может быть:
если при комнатной температуре в 100 граммах воды растворяется менее 1 грамма этого вещества .
нерастворимо , растворимость меньше 0,01 грамма в 100 граммах воды.
если при комнатной температуре в 100 граммах воды растворяется более 1 грамма этого вещества.
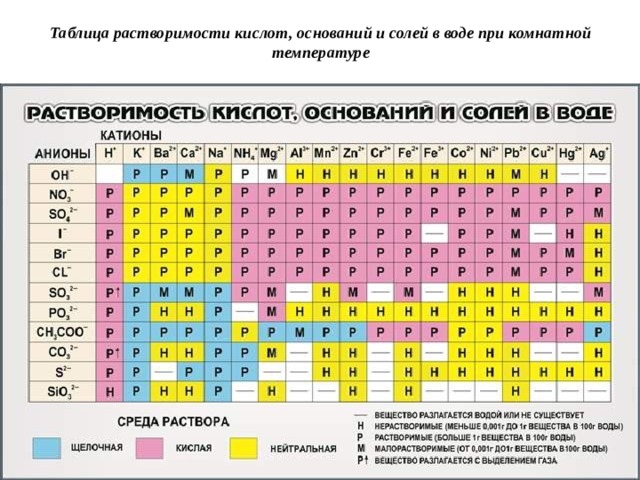
Таблица растворимости кислот, оснований и солей в воде при комнатной температуре
- По растворимости в воде различают вещества: растворимые, малорастворимые, практически не растворимые.
- Растворение – физико-химический процесс.
- Нагревание и измельчение веществ ускоряет процесс растворения.
- Раствор – однородная смесь,
многокомпонентная система, состоящая из: растворимого вещества, растворителя.
5. Значение воды и растворов
Роль воды и растворов трудно переоценить.
- Все химические превращения на Земле происходят или с непосредственным участием воды, или в водных растворах, или в её присутствии.
Вода – жизненно важное вещество…
Она содержится во всех живых организмах.
В состав человеческого тела входит около 65 % воды. Во взрослом человеке, который весит 70 кг, примерно 46 кг приходится на воду
В норме организм за сутки выделяет 2,5 л воды: через почки – около 50 %, через легкие – 13 %, через кишечник – 5 %, остальная часть воды (примерно 32 %) выделяется через кожу.
При утрате влаги в размере 6-8 % от веса чела человек впадает в полуобморочное состояние. Потеря 10 % влаги вызывает нарушение глотательного рефлекса, затем начинаются галлюцинации, в конце концов останавливается сердце.
При потере организмом
Вода является средой обитания для различных живых организмов.
От воды зависит климат планеты.
Вода обладает высокой
Нагреваясь она поглощает
а остывая – отдает его.
Большое количество воды расходуется на промышленные нужды .
- В металлургии;
- В химической промышленности;
- В земледелии, для орошения;
- В энергетике;
- В медицине;
- Для хозяйственных
Применение воды в технических целях
для охлаждения оборудования, сырья
для растворения реагентов, используемых в производствах, для получения пара
в качестве транспортной среды
в качестве поглотителя примесей
Сколько воды вы расходуете за день в повседневной жизни ?
15 литров в минуту
Стирка в стиральной машине
15 литров в минуту
Поэтому должны приниматься меры по охране и рациональному использованию водных ресурсов.
Для выражения состава раствора используют количественную характеристику раствора- массовую долю растворенного вещества :
( Ѡ р.в. ) — это безразмерная величина, равная отношению массы растворённого вещества (m р. в . ) к общей массе раствора (m р-ра ):
- mр-ра= mр.в.+ m(н2о)(2)
Массовую долю растворённого вещества
( процентную концентрацию) обычно выражают в долях единицы или в процентах.
Например , массовая доля растворённого вещества – CaCl 2 в воде равна 0,1 или 10 %:
Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 10 г и вода массой 90 г
Задача: 60% от массы тела человека приходится на воду. Вычислите сколько воды содержится в организме человека массой 70 кг.
А сколько воды содержится в Вашем организме?
Что же такое вода?
Вода – это обыкновенное чудо , обладающее необыкновенными свойствами.
Знаете ли Вы что?
- Выплавка 1 тонны стали требует расхода 25м3воды.
- Для очистки 1 тонны нефти надо затратить 18м3воды.
- В древности человек обходился 12-18л воды в день, в 19 веке — 40-60 л.
- В настоящее время городской житель в сутки тратит более 500л воды.
Знаете ли Вы что?
- Общие запасы воды на Земле составляют около 1386 млн. км3. На долю пресной воды приходится только 35 млн. км3. И лишь 2,5% из них можно использовать.
- Запасы пресной воды небезграничны.
- Важна проблема очистки воды и использование её в системах замкнутого цикла.
Вы слыхали о воде? Говорят, она везде!
В луже, в море, в океане и в водопроводном кране.
Как сосулька, замерзает, в лес туманом заползает…
Ледником в горах зовется, лентой серебристой вьется.
Средь высоких, стройных елей рушится потоком селей…
На плите у нас кипит, паром чайника шипит,
Растворяет сахар в чае. Мы её не замечаем,
Мы привыкли, что вода – наша спутница всегда!
Осуществите самооценку деятельности на уроке:
«5» -Если вы были внимательны на уроке, уверены в себе, и все изученные вопросы усвоили.
«4» — Если вы были внимательны, усвоили материал в целом, а на вопросы затруднялись ответить.
Мое состояние после урока
Мне хорошо я активно работал(а),все понял(а )
Я чувствовал(а) себя неуверенно, работал(а) мало
У меня возникло много вопросов, есть над чем поработать
1. А. Меркулов. Самая удивительная на свете жидкость. М., 1978.- 193 с.
2. В.В. Синюков. Вода известная и неизвестная. М., 1987.- 176 с.
3. Химия. Большой справочник для школьников и поступающих в вузы. М., 1999.- 780 с.
4. Зверев, И.Д. Анатомия, физиология и гигиена человека / И.Д. Зверев, О.В. Казакова, О.С. Яковлева. — Л.: Просвещение; Издание 3-е, 2014 . — 168 c.
5. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов. / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; под ред. Ю.А. Ершова -9-е изд., стер.- М: Издательство Юрайт, 2011 — 560 с
6. Попков В.А. Общая химия / В.А.Попков, С.А. Пузаков — М.: ГЭОТАР — Медиа, 2010. — 976 с.
7. Глинка Н.Л. Общая химия/ Н.Л. Глинка; под ред. В.А. Попкова, А.В. Бабкова — 19-е изд, перераб. и доп. — М.: Издательство Юрайт, 2013. — 900 с.
8. Химия. Просвещение МЕДИА. Электронная библиотека 2004г
Источник