- Основные показатели состава и качества воды
- Минерализация
- Взвешенные вещества (грубодисперсные примеси)
- Мутность (тонкодисперсные примеси)
- Запах и привкус
- Цветность
- Прозрачность
- Водородный показатель (рН)
- Растворенный кислород
- Жесткость
- Железо (Fе, суммарно)
- Активный хлор.
- Перманганатная окисляемость
- Аммоний (NH4 + , по азоту)
- Нитраты (NO3 — )
- Тяжелые металлы
- Натрий (Na + )
- Марганец (Мn, суммарно)
- Фториды (F — )
- Ртуть (Нg, суммарно)
- Сульфиды и сероводород
- Кремний
- Калий (К+)
- Кадмий (Cd, суммарно)
- Микроорганизмы и паразиты
Основные показатели состава и качества воды
Минерализация
Суммарное содержание всех найденных при химическом анализе воды минеральных веществ; обычно выражается в мг/дм 3 (до 1000 мг/дм 3 ) и ‰ (более 1000 мг/дм 3 ).
Минерализация природных вод, определяющая их удельную электропроводность, изменяется в широких пределах. Большинство рек имеет минерализацию от нескольких десятков миллиграммов в литре до нескольких сотен. Их удельная электропроводность варьирует от 30 мкСм/см до 1500 мкСм/см. Минерализация подземных вод и соленых озер изменяется в интервале от 40-50 мг/дм3 до 650 г/кг (плотность в этом случае уже значительно отличается от единицы). Удельная электропроводность атмосферных осадков (с минерализацией от 3 до 60 мг/дм3) составляет величины 20-120 мкСм/см.
Классификация природных вод по минерализации.
| Категория вод | Минерализация, г/дм 3 |
|---|---|
| Ультрапресные | 35 |
Очень часто параметр «общая минерализация» путают с «сухим остатком». Действительно, эти параметры очень близки между собой, но методика определения сухого остатка несколько иная. Это приводит к тому, что общая минерализация зачастую отличается от сухого остатка. Сухой остаток определяется термогравиметрическим методом (выпаривание пробы воды на водяной бане и высушивания чашки при 105 °С.) В процессе обработки из пробы удаляются летучие компоненты и вещества, разлагающиеся с образованием летучих компонентов.
В соответствии с гигиеническими требованиями к качеству питьевой воды суммарная минерализация не должна превышать величины 1000 мг/л. Вода, содержащая большое количество солей, отрицательно влияет на растения и человека, вызывает образование накипи на стенках котлов, коррозию, засоление почв. Регулярное употребление высокоминерализованной воды ведет к болезням пищеварения, обмена веществ, повышенной сухости кожи.
Взвешенные вещества (грубодисперсные примеси)
Взвешенные твердые вещества, присутствующие в природных водах, состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Концентрация взвешенных частиц связана с сезонными факторами и режимом стока, зависит от пород, слагающих русло, а также от антропогенных факторов, таких как сельское хозяйство, горные разработки и т.п.
Взвешенные частицы могут приводить к авариям в системе водоснабжения, прозрачность (или мутность) воды, на скорость осадкообразования и теплообмен в котельных установках. Повышенное содержание взвесей способно приводить к авариям в водопроводной системе. Вода, в которой много взвешенных частиц, не подходит для использования по эстетическим и хозяйственно-бытовым соображениям. Грубодисперсные примеси определяют гравиметрическим методом.
Мутность (тонкодисперсные примеси)
Мутность природных вод вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения. Взвешенные вещества попадают в воду в результате смыва твердых частичек (глины, песка, ила) верхнего покрова земли дождями или талыми водами во время сезонных паводков, а также в результате размыва русла рек. Наименьшая мутность водоемов наблюдается зимой, наибольшая — весной (в период паводков) и летом (в период дождей). Также повышение мутности воды может быть вызвано взвесями карбонатов, гидроксидов алюминия, высокомолекулярных органических примесей гумусового происхождения, появлением фито- и изопланктона, а также окислением соединений железа и марганца кислородом воздуха.
Взвешенные вещества имеют различный гранулометрический состав, который характеризуется гидравлической крупностью, выражаемой как скорость осаждения частиц при температуре 10 o С в неподвижной воде.
| Взвешенные вещества | Размер, мм | Скорость осаждения, мм/с | Время осаждения частиц на глубину 1 м |
|---|---|---|---|
| Коллоидные частицы | 2×10 -4 …1×10 -6 | 7×10 -6 | 4 года |
| Тонкая глина | 1×10 -3 …5×10 -4 | 7×10 -4 — 17×10 -5 | 0.5 — 2 месяца |
| Глина | 27×10 -4 | 5×10 -3 | 2 суток |
| Ил | 5×10 -2 — 27×10 -3 | 1.7 — 0.5 | 10 — 30 минут |
| Песок мелкий | 0.1 | 7 | 2.5 минуты |
| Песок средний | 0.5 | 50 | 20 с |
| Песок крупный | 1.0 | 100 | 10 с |
Качественное определение проводят описательно: слабая опалесценция, опалесценция, слабая, заметная и сильная муть.
Мутность воды определяют турбидиметрически по ослаблению проходящего через пробу света (РД 52.08.104-2002 Методические указания. Мутность воды. Методика выполнения измерений.) путем сравнения проб исследуемой воды со стандартными суспензиями. Результаты измерений выражают в мг/л (при использовании основной стандартной суспензии каолина) или в ЕМФ/л (единицы мутности на л при использовании основной стандартной суспензии формазина); 1,5 мг/л каолина соответствует 2,6 ЕМФ/л формазина. Турбидиметрическое определение предназначено для вод, имеющих переменчивый состав и форму тонкодисперсных примесей. Если пробу предварительно не профильтровать, то турбидиметрически будут определены не только коллоидные, но и более грубодисперсные частицы.
Мутность не только отрицательно влияет на внешний вид воды. Главным отрицательным следствием высокой мутности является то, что она защищает микроорганизмы при ультрафиолетовом обеззараживании и стимулирует рост бактерий. Поэтому во всех случаях, когда производится дезинфекция воды, мутность должна быть минимальной для обеспечения высокой эффективности этой процедуры. В соответствии с гигиеническими требованиями к качеству питьевой воды мутность не должна превышать 1,5 мг/л по каолину. (Каолин в основном состоит из каолинита, который представляет собой кристаллическое вещество состава Al2O3×2SiO2×2H2O. Глины или совсем не содержат этого соединения или содержат его как случайную примесь. Чистый каолин – белого цвета и отличается сравнительно малой пластичностью. Ввиду того, что он служит сырьём для изготовления фарфора, его называют фарфоровой землёй).
Запах и привкус
Запах – это свойство воды вызывать у человека и животных специфическое раздражение слизистой оболочки носовых ходов. Запах воды характеризуется интенсивностью, которую измеряют в баллах. Запах воды вызывают летучие пахнущие вещества, поступающие в воду в результате процессов жизнедеятельности водных организмов, при биохимическом разложении органических веществ, при химическом взаимодействии содержащихся в воде компонентов, а также с промышленными, сельскохозяйственными и хозяйственно-бытовыми сточными водами.
На запах воды оказывают влияние состав содержащихся в ней веществ, температура, значения рН, микроорганизмы, гидрологические условия и т.д. Концентрации различных веществ, при которых ощущается их запахи или привкус в воде, неодинаковы. Сероводород ощущается при концентрации его в воде более 0.2-0.3 мг/л, хлор — при концентрации более 0.3 мг/л, хлорфенол — при концентрации более 0.02 мг/л, продукты жизнедеятельности актиномицетов (придают воде землистый запах) ощущаются при концентрации более 10-8 мг/л.
Определение интенсивности запаха воды:
| Оценка интенсивности запаха, баллы | Интенсивность запаха | Характер проявления запаха |
|---|---|---|
| 0 | никакого запаха | отсутствие ощутимого запаха |
| 1 | очень слабый | запах, не замечаемый потребителем, но обнаруживаемый специалистом |
| 2 | слабый | запах, обнаруживаемый потребителем, если обратить на это внимание |
| 3 | заметный | запах, легко обнаруживаемый, может быть причиной того, что вода неприятна для питья |
| 4 | отчетливый | запах, обращающий на себя внимание, может заставить воздержаться от питья |
| 5 | запах, обращающий на себя внимание, может заставить воздержаться от питья | запах, настолько сильный, что делает воду непригодной для питья |
Химически чистая вода совершенно лишена вкуса. Однако в природе такая вода не встречается – она всегда содержит в своем составе растворенные вещества. По мере роста концентрации неорганических и органических веществ, вода начинает принимать тот или иной привкус. Вкус – это свойство веществ (в нашем случае воды) вызывать у человека и животных специфическое раздражение рецепторов слизистой оболочки языка. Следует также иметь в виду, что привкус может появиться в воде на нескольких этапах: в природной воде, в процессе водоподготовки, при транспортировке по трубопроводам. Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 ° С и оценивают по пятибалльной системе:
| Оценка интенсивности, балл | Интенсивность вкуса | Интенсивность вкуса |
|---|---|---|
| 0 | Нет | Вкус и привкус не ощущаются |
| 1 | Очень слабая | Вкус и привкус не ощущаются потребителем но обнаруживаются при лабораторном исследовании |
| 2 | Слабая | Вкус и привкус замечаются потребителем, если обратить на это его внимание |
| 3 | Заметная | Вкус и привкус легко замечаются и вызывают неодобрительный отзыв о воде |
| 4 | Отчетливая | Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья |
| 5 | Очень сильная | Вкус и привкус настолько сильные, что делают воду непригодной к употреблению |
Основными причинами возникновения привкуса и запаха в воде являются:
- 1. Гниющие растения. При недостаточной циркуляции водоема водоросли и водные растения в процессе гниения могут взывать рыбный, травяной, гнилостный запах воды.
- 2. Микробиологическое загрязнение. В почве, грунтовых водах и водоемах живет множество микроорганизмов. Микроорганизмы вызывают возникновение плесневого, землистого или затхлого запаха и привкуса. Тенденция к размножению этих микроорганизмов возникает в местах застоя воды и там, где вода приобретает комфортную для развития температуру (например, в системах горячего водоснабжения больших зданий с накопительными емкостями).
- 3. Железистые и сернистые бактерии. Оба типа бактерий выделяют продукты жизнедеятельности, которые при разложении создают неприятный запах и привкус.
- 4. Растворенные газы. Образуются в результате жизнедеятельности почвенных бактерий и биохимического окисления органических остатков (в основном это аммиак, сероводород и метан).
- 5. Повышенная минерализация воды.
- 6. Железо, марганец, медь, цинк. Продукты коррозии этих металлов придают воде характерный резкий привкус.
- 7. Поваренная соль. В небольших концентрациях придает воде определенный вкус, которые многие люди считают даже привычным. Однако с ростом концентрации приводит к возникновению солоноватого, а затем и резко соленого вкуса.
- 8. Промышленные отходы. Многие вещества, содержащиеся в сточных водах промышленного производства, могут вызвать сильный лекарственный или химический запах воды. Например, проблемой являются фенольные соединения.
Хлорирование воды. При правильном использовании активный хлор не вызывает возникновения сколько-нибудь заметного запаха или привкуса. Появление же такого запаха/привкуса свидетельствует о передозировке при хлорировании. В то же время, хлор способен вступать в химические реакции с различными растворенными в воде веществами, образуя при этом соединения, которые собственно и придают воде хорошо известный многим запах и привкус «хлорки».
Цветность
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений; выражается в градусах платиново-кобальтовой шкалы. Определяется путем сравнения окраски испытуемой воды с эталонами. Цветность природных вод колеблется от единиц до тысяч градусов. Предельно допустимая величина цветности в водах, используемых для питьевых целей, составляет 20 градусов. Цветность природных вод обусловлена главным образом присутствием гумусовых веществ и соединений железа. Количество этих веществ зависит от геологических условий, водоносных горизонтов, характера почв, наличия болот и торфяников в бассейне реки и т.п. Сточные воды некоторых предприятий также могут создавать довольно интенсивную окраску воды.
Различают «истинный цвет», обусловленный только растворенными веществами, и «кажущийся» цвет, вызванный присутствием в воде коллоидных (размером менее 1 мкм, 1 мкм = 0,001 мм) взвешенных частиц, соотношения между которыми в значительной мере определяются величиной pH.
Высокая цветность воды, как правило, связана с присутствием в ней ионов железа и/или органических примесей и оказывает отрицательное влияние на эстетические ощущения, здоровье человека и животных.
Прозрачность
Прозрачность (или светопропускание) природных вод обусловлена их цветом и мутностью, т.е. содержанием в них различных окрашенных и взвешенных органических и минеральных веществ. Воду в зависимости от степени прозрачности условно подразделяют на прозрачную, слабоопалесцирующую, опалесцирующую, слегка мутную, мутную, сильно мутную.
Мерой прозрачности служит высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (как правило, шрифт средней жирности высотой 3,5 мм). Результаты выражаются в сантиметрах с указанием способа измерения.
Водородный показатель (рН)
Водородный показатель характеризует концентрацию свободных ионов водорода в воде. Для удобства отображения был введен специальный показатель, названный рН и представляющий собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -log[H + ]. Например, если концентрация водородных ионов [Н + ] =10-5 г-ион/л, то рН = 5.
Величина рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода, по сравнению с ионами ОН-, то рН>7 и вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ вода будет иметь кислую реакцию и рН > 7. В чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В случаях равновесия ионов Н+ и ОН- вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН. Очень часто показатель рН путают с такими параметрами, как кислотность и щелочность воды. Важно понимать разницу между ними. Главное заключается в том, что рН – это показатель интенсивности, но не количества. То есть, рН отражает степень кислотности или щелочности среды, в то время как кислотность и щелочность характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответствующее количество щелочи или кислоты.
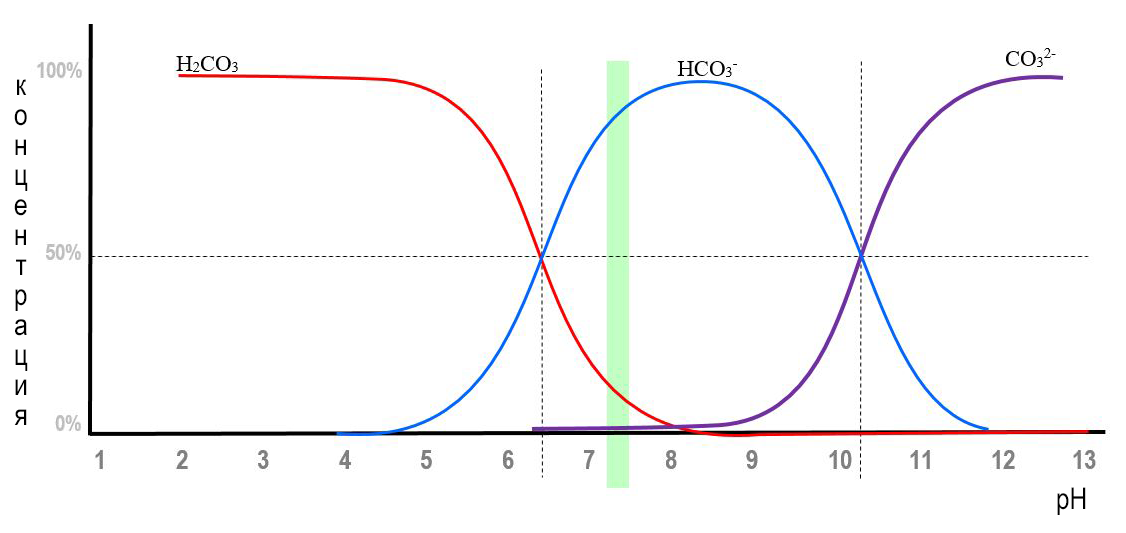
Концентрация водородных ионов определяет соотношение между бикарбонатными HCO3 2- и карбонатными CO3 2- ионами (рис.).
Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Изменения pH тесно связаны с процессами гидролиза, например гидролизом солей металлов: Fe 2+ + 2H2O ↔ Fe(OH)2- + 2H + .
От величины pH зависит развитие и жизнедеятельность многих организмов, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ. Например, увеличение присутствия в воде анионов ОН— уменьшает растворимость металлов, т.к. большинство гидоксидов металлов трудно растворимы.
Природные воды в зависимости от рН рационально делить на семь групп:
| Группа | рН | Примечание | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Сильнокислые воды | 11) вода приобретает характерную мылкость, неприятный запах, вызывает раздражение глаз и кожи. Для быстрого (сигнального) анализа неизвестных растворов используется рН-индикаторная бумага, имеющая точность определения рН не более ±1, что недостаточно для выполнения анализа природной и питьевой воды. Растворенный кислородРастворенный кислород находится в природной воде в виде молекул O2. В 100 объемах H2O растворяется 3 объема O2 (при норм. условиях, т.е. при давлении 1 атм. и температуре 20 o С). На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции потребления его на окисление:
Скорость потребления кислорода увеличивается с повышением температуры, количества организмов и веществ, подвергающихся химическому и биохимическому окислению. В поверхностных водах содержание растворенного кислорода варьируется в широких пределах – от 0 до 14 мг/л и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/л растворенного кислорода. В зимний и летний количество кислорода в воде различается. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в водоемах, содержащих большое количество биогенных и гумусовых веществ. В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/л в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/л в зимний период и 6 мг/л в летний. В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/л в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/л в зимний период и 6 мг/л в летний. Содержание кислорода в водоемах с различной степенью загрязненности:
Низкое содержание растворенного кислорода в системах водоснабжения может способствовать увеличению содержания растворенного неорганического железа, а также микробиологическому восстановлению нитрата в нитрит и сульфата в сульфид, что вызывает появление запаха. Уменьшение количества кислорода приводит также к повышению концентрации двухвалентного железа в растворе и осложняет его удаление. В то же время высокое содержание растворенного кислорода придает воде коррозионные свойства по отношению к металлам и бетону. ЖесткостьЖесткость воды представляет собой свойство природной воды, зависящее от наличия в ней главным образом растворенных солей кальция и магния. Суммарное содержание этих солей называют общей жесткостью. Общая жесткость подразделяется на:
Результаты определения жесткости обычно выражают в мг-экв/л. В следующей таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||