5 аномальных фактов о воде
Несмотря на простую химическую формулу, вода — вещество с очень необычными свойствами. Она таит в себе множество загадок, которые порой не под силу разгадать даже ученым.
Перед вами пять наиболее интересных фактов о воде.
1. Горячая вода замерзает быстрее холодной
Возьмем две емкости с водой: в одну нальем горячую, а в другую — холодную воду, и поместим их в морозильную камеру. Горячая вода замерзнет быстрее холодной, хотя по логике вещей, первой должна была превратиться в лед холодная вода: ведь горячей воде надо сначала остыть до температуры холодной, а потом уже превращаться в лед, в то время как холодной воде остывать не надо.
Почему же так происходит?
В 1963 году один танзанский студент по имени Эрасто Б. Мпемба (Erasto B. Mpemba) замораживая приготовленную смесь для мороженого, заметил, что горячая смесь застывает в морозильной камере быстрее, чем холодная. Когда юноша поделился своим открытием с учителем физики, тот лишь посмеялся над ним.
К счастью, ученик оказался настойчивым и убедил учителя провести эксперимент, который и подтвердил его открытие: в определенных условиях горячая вода действительно замерзает быстрее холодной.
Теперь этот феномен горячей воды, замерзающей быстрее холодной, носит название «эффект Мпемба». Правда, за долго до него это уникальное свойство воды было отмечено Аристотелем, Фрэнсисом Бэконом и Рене Декартом.
Ученые так до конца и не понимают природу этого явления, объясняя его либо разницей в переохлаждении, испарении, образовании льда, конвекции, либо воздействием разжиженных газов на горячую и холодную воду.
2. Сверхохлаждение и «мгновенное» замерзание
Все знают, что вода всегда превращается в лед при охлаждении до 0 °C … за исключением некоторых случаев! Таким случаем, например, является сверхохлаждение, которое представляет собой свойство очень чистой воды оставаться жидкой, даже будучи охлажденной до температуры ниже точки замерзания.
Это явление становится возможным благодаря тому, что окружающая среда не содержит центров или ядер кристаллизации, которые могли бы спровоцировать образование кристаллов льда. И поэтому вода остается в жидкой форме, даже будучи охлажденной до температуры ниже нуля градусов по Цельсию.
Процесс кристаллизации может быть спровоцирован, например, пузырьками газа, примесями (загрязнениями), неровной поверхностью емкости. Без них вода будет оставаться в жидком состоянии. Когда процесс кристаллизации запускается, можно наблюдать, как сверхохлажденная вода моментально превращается в лед.
Заметьте, что «сверхнагретая» вода также остается жидкой, даже будучи нагретой до температуры выше точки закипания.
3. «Стеклянная» вода
Не задумываясь, назовите, сколько различных состояний есть у воды? Если вы ответили три: твердое, жидкое, газообразное, то вы ошиблись. Ученые выделяют как минимум 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде.
Помните разговор про сверхохлажденную воду? Так вот, что бы вы ни делали, при температуре -38 °C даже самая чистая сверхохлажденная вода внезапно превратится в лед.
Что же произойдет при дальнейшем понижении температуры?
При -120 °C с водой начинает происходить что-то странное: она становится сверхвязкой или тягучей, как патока, а при температуре ниже -135 °C она превращается в «стеклянную» или «стекловидную» воду – твердое вещество, в котором отсутствует кристаллическая структура.
4. Квантовые свойства воды
На молекулярном уровне вода удивляет ещё больше. В 1995 году проводимый учеными эксперимент по рассеянию нейтронов дал неожиданный результат: физики обнаружили, что нейтроны, направленные на молекулы воды, «видят» на 25% меньше протонов водорода, чем ожидалось.
Оказалось, что на скорости одной аттосекунды (10 -18 секунд) имеет место необычный квантовый эффект, и химическая формула воды вместо H2O, становится H1.5O!
5. Есть ли у воды память?
Альтернативная официальной медицине гомеопатия утверждает, что разбавленный раствор лекарственного препарата может оказывать лечебный эффект на организм, даже если коэффициент разбавления настолько велик, что в растворе уже не осталось ничего, кроме молекул воды.
Сторонники гомеопатии объясняют этот парадокс концепцией под названием «память воды», согласно которой вода на молекулярном уровне обладает «памятью» о веществе, некогда в ней растворенном и сохраняет свойства раствора первоначальной концентрации после того, как в нём не остается ни одной молекулы ингредиента.
Международная группа ученых во главе с профессором Мэдлин Эннис (Madeleine Ennis) из Королевского университета в Белфасте (Queen’s University of Belfast), критиковавшая принципы гомеопатии, в 2002 году провела эксперимент, чтобы раз и навсегда опровергнуть эту концепцию.
Результат оказался обратным. После чего, ученые заявили, что им удалось доказать реальность эффекта «памяти воды». Однако опыты, проведенные под наблюдением независимых экспертов, результатов не принесли. Споры о существовании феномена «памяти воды» продолжаются.
Вода обладает множеством других необычных свойств, о которых мы не рассказали в этой статье. Например, плотность воды меняется в зависимости от температуры (плотность льда меньше плотности воды); вода обладает довольно большой величиной поверхностного натяжения; в жидком состоянии вода представляет собой сложную и динамически меняющуюся сеть из водных кластеров, и именно поведение кластеров влияет на структуру воды и т.д.
Источник
Вода с сахаром температура замерзания
Во что лучше поместить ёмкость с мороженым при его приготовлении для наилучшего охлаждения: в чистый лёд или смесь льда и соли? Ответ поясните.
Возьмём в руки кусок сахара и коснёмся им поверхности кипятка. Кипяток втянется в сахар и дойдёт до наших пальцев. Однако мы не почувствуем ожога, как почувствовали бы, если бы вместо сахара был кусок ваты. Это наблюдение показывает, что растворение сахара сопровождается охлаждением раствора. Если бы мы хотели сохранить температуру раствора неизменной, то должны были бы подводить к раствору энергию. Отсюда следует, что при растворении сахара внутренняя энергия системы сахар-вода увеличивается.
То же самое происходит при растворении большинства других кристаллических веществ. Во всех подобных случаях внутренняя энергия раствора больше, чем внутренняя энергия взятых в отдельности кристалла и растворителя при той же температуре.
В примере с сахаром необходимое для его растворения количество теплоты отдаёт кипяток, охлаждение которого заметно даже по непосредственному ощущению.
Если растворение происходит в воде при комнатной температуре, то температура получившейся смеси в некоторых случаях может оказаться даже ниже 0 °С, хотя смесь и остаётся жидкой, поскольку температура застывания раствора может быть значительно ниже нуля. Этот эффект используют для получения сильно охлажденных смесей из снега и различных солей.
Снег, начиная таять при 0 °С, превращается в воду, в которой растворяется соль; несмотря на понижение температуры, сопровождающее растворение, получившаяся смесь не затвердевает. Снег, смешанный с этим раствором, продолжает таять, забирая энергию от раствора и, соответственно, охлаждая его. Процесс может продолжаться до тех пор, пока не будет достигнута температура замерзания полученного раствора. Смесь снега и поваренной соли в отношении 2 : 1 позволяет, таким образом, получить охлаждение до −21 °С; смесь снега с хлористым кальцием (СаСl2) в отношении 7 : 10 — до −50 °С.
Источник
Лёд из воды с сахаром (или другим веществом)
Добрый день. Можете мне объяснить по структуре кристалла льда. Например при замерзании чистой воды, в узлах кристалл решетки находятся молекулы воды. А вот например, если замерзает сладкая вода (вода в которой разбавлен сахар), то в узлах кристалл решетки кристалла находятся молекулы воды и молекулы сахара (вместо сахара, можно использовать любое другое вещество растворяющееся в воде)? Павел Сергеевич, Черновцы
Здравствуйте, уважаемый Павел Сергеевич. Теоретически, большинство молекул белков, жиров и углеводов по своему строению довольно идеально подходят к структуре льда, как бы “вписываясь” в пустоты его кристаллической решетки. Но на практике всё происходит совершенно иначе. Замерзая и превращаясь в лёд вода как бы изгоняет из растущего кристалла все примеси и чужеродные молекулы. Именно на этом принципе и основано очищение воды методом замораживания-оттаивания, когда в результате получается свободная от примесей талая вода.
По другому ведёт себя вода и в отношении молекул, форма которых не подходит в структуре льда: крупные она, замерзая, ломает, а мелкие изгоняет. Достаточно вспомнить лед в Северном Ледовитом океане пресный, потому что вода, замерзая, освобождается от солей.
Вы можете самостоятельно произвести в домашних условиях такой простой эксперимент: В стеклянный стакан с водой налейте немного чернил, акварельной краски или чайной заварки. Укутайте его верхнюю часть слоем теплоизоляции (шерстяной тканью), чтобы слой льда нарастал от дна стакана к поверхности воды, и поставки в морозильную камеру. Теоретически можно предположить, что через несколько часов в стакане окажется кусок окрашенного льда. Были даже советы эти цветные льдинки развешивать на уличных елках. Но разноцветного льда на практике, однако, так получить не удастся.
Ледяной цилиндрик, вынутый из стакана, будет выглядеть очень любопытно. В нижней его части, там, где начиналось замерзание воды, располагается абсолютно прозрачный лед. Верхняя же его часть окрашена, и гораздо более интенсивно, чем сам раствор. Граница между двумя областями бывает настолько резка, что кажется — это два совершенно разных вещества. Если концентрация краски слишком велика, на поверхности льда может даже остаться её раствор. Почему же лед «не хочет» делаться цветным?
Кристалл стремится вырасти как можно более правильным — это «выгодно» с точки зрения его внутренней энергии. А любые посторонние примеси – будь то молекулы или атомы искажают форму решетки. Поэтому растущий кристалл вытесняет любые посторонние атомы и молекулы, стараясь строить идеальную решетку, пока это возможно. И только когда примесям деваться уже некуда, он начинает встраивать их в свою структуру или оставляет в виде капсул с концентрированной жидкостью. Поэтому морской лед пресный, а даже самые грязные лужи покрываются прозрачным и чистым льдом.
На Дону и Кубани, где издавна выращивали виноград и делали сухие вина, зимой готовят крепкие напитки — «выморозки». Для этого продукт естественного брожения — вино крепостью 10-12 градусов — выставляют на мороз. В растворе в первую очередь замерзает вода, и остается более концентрированный раствор спирта. Его сливают и повторяют операцию до тех пор, пока не добьются нужной крепости. Чем выше концентрация спирта в растворе, тем ниже температура его замерзания.
Водопроводная вода содержит примерно сто частей примесей на миллион частей воды (в основном это хлор, растворенный для дезинфекции, поваренная соль, которая есть везде, и твердые микрочастицы). Дистилляцией в обычных лабораторных условиях их количество нетрудно понизить раз в сто, получив воду с чистотой 99,9999%. Если же сосуд с этой водой медленно охлаждать с одной стороны, получится лед с чистотой уже до шести девяток после запятой. В нем отыщется только одна частица примеси на сто миллионов частиц воды.
В минералогических коллекциях нередко можно видеть, например, прозрачные кристаллы корунда Al2O3, которые заканчиваются рубиновой «шапочкой». Это растущий кристалл «собрал» со всего объема примесь — ионы хрома Cr3+, которые превращают бесцветный корунд в красный рубин.
Свойство растущего кристалла вытеснять примеси используют в технике для очистки материалов методом зонной плавки. Образец проходит сквозь кольцевую печь; в ней он плавится, а за ней кристаллизуется. Примеси непрерывно переходят из зоны кристаллизации в расплав и постепенно мигрируют вдоль образца в его конец.
Но, оказывается, включить в кристаллическую решётку небольшие атомы, например, благородных газов – гелия, аргона, криптона, всё же возможно. И даже более того, структура некоторых льдов стабилизируется при включении атомов благородных газов в его кристаллическую решётку. Однако, получить такие экзотические льды в обычных природных условиях не возможно, зато возможно их получить, например, в условиях космоса, при очень низких температурах и высоких давлениях.
Вообще, в природе существует 14 модификаций льда (более подробно о структуре льда читайте на нашем сайте). Но вполне возможно, что в будущем будут открыты и другие его разновидности. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии и обозначающегося как лёд I , образуются в условиях экзотических — при очень низких температурах (порядка -110150 0С ) и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Наиболее изученным является лёд I-й природной модификации. Лёд встречается в природе в виде льда (материкового, плавающего, подземного и т.д.), а также в виде снега, инея и т.д. Он распространён во всех областях обитания человека. Собираясь в огромных количествах, снег и лед образуют особые структуры с принципиально иными, нежели у отдельных кристаллов или снежинок, свойствами. Ледники, ледяные покровы, вечная мерзлота, сезонный снежный покров существенно влияют на климат больших регионов и планеты в целом: скопившийся на полюсах Земли лёд способен вызывать многолетние колебания уровня Мирового океана. Лед имеет столь большое значение для нашей планеты и обитания на ней живых существ, что ученые отвели для него особую среду — криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
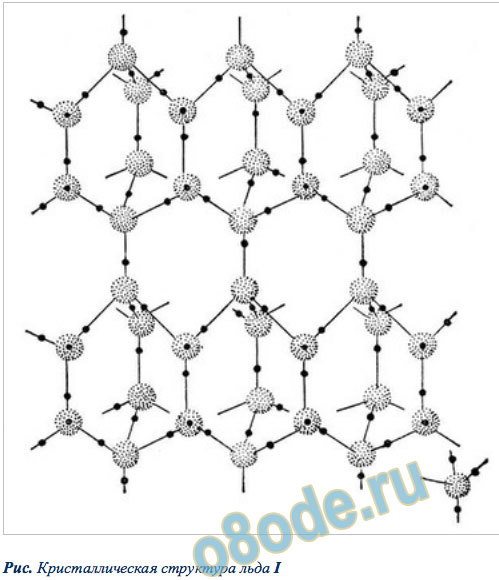
Рис. Кристаллическая структура льда I
Природный лёд I обычно значительно чище, чем вода, т.к. растворимость веществ (кроме NH4F) во льде крайне низкая. А вот лёд II наоборот стабилизуется только в присутствии следовых количеств газов; в чистом виде его никто не получал из-за его нестабильности. Если, например, давление создают с помощью гелия, он обязательно растворится в замерзающей воде. Есть сведения, что аргон — другой инертный газ, пригодный для использования в этой установке, — тоже способен давать со льдом твёрдые растворы. Однако изучением таких клатратных соединений льда с благородными газами специально никто не занимался.
Разгадка структуры льда заключается в строении его молекулы. Кристаллы всех модификаций льда построены из молекул воды H2O, соединённых водородными связями в трёхмерный каркас. Молекулу воды можно упрощенно представить себе в виде тетраэдра (пирамиды с треугольным основанием). В её центре находится атом кислорода, в двух вершинах — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, поэтому их называют неподеленными.
Каждая молекула участвует в 4 таких связях, направленных к вершинам тетраэдра. При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы воды. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру. При этом в структурах льда I, Ic, VII и VIII этот тетраэдр правильный. В структурах льда II, III, V и VI тетраэдры заметно искажены. В структурах льда VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы в виде сетчатой сетки, по структуре напоминающей соты с полыми каналами. Если лед нагреть, сетчатая структура разрушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, — поэтому вода тяжелее льда.
Лед, который образуется при атмосферном давлении и плавится при 0 °С, — самое привычное, но всё же до конца не понятное вещество. Многое в его структуре и свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а атомы водорода занимают самые разные положения вдоль связей. Поэтому возможны 6 эквивалентных ориентаций молекул воды относительно их соседей. Часть из них исключается, поскольку нахождение одновременно 2 протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды.
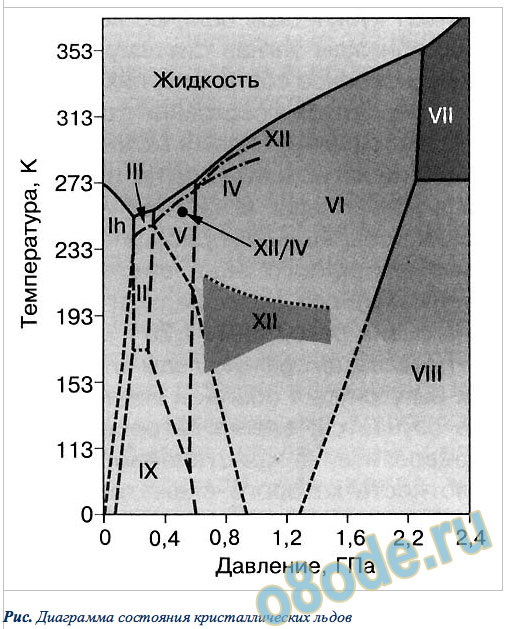
Другая интересная разновидность льда – лёд II. Расположен лёд II на диаграмме состояния между льдом III и льдом IX. Они различаются между собой упорядочением протонов, кислородный же каркас у них одинаков: спирали из одних молекул воды, как будто нанизанные на оси из других молекул воды. Когда же вероятности протона занять то или иное место равны, лёд будет неупорядоченным.
Рис. Диаграмма состояния кристаллических льдов
Лёд III и V-й модификации длительное время сохраняются при атмосферном давлении, если температура не превышает —170°С. При нагревании приблизительно до —150°С лёд превращаются в кубический лёд Ic.
При конденсации паров воды на более холодной подложке образуется аморфный лёд. Эта форма льда может самопроизвольно переходить в гексагональный лёд, причём тем быстрее, чем выше температура.
Лёд IV-й модификации является метастабильной фазой льда. Он образуется гораздо легче и особенно стабилен, если давлению подвергается тяжёлая вода.
Кривая плавления льда V и VII исследована до давления 20 Гн/м2 (200 тыс. кгс/см2). При этом давлении лёд VII плавится при температуре 400°С.
Лёд VIII является низкотемпературной упорядоченной формой льда VII.
Лёд IX — метастабильная фаза, возникающая при переохлаждении льда III и по существу представляющая собой его низкотемпературную форму.
Две самых последние модификации льда — XIII и XIV — открыли ученые из Оксфорда совсем недавно, в 2006 году. Предположение о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре –160°С очень высока, и собраться вместе молекулам чистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно. Этого удалось достичь с помощью катализатора — соляной кислоты, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но они могут встречаться на замерзших спутниках других планет.
Однако, все эксперименты с экзотическими льдами, как правило, связаны с их охлаждением до температур сухого льда, жидкого азота, а то и гелия, а также со сжатием до давления в тысячи атмосфер. Общее представление о результатах можно получить, глядя на рисунок выше, где показана диаграмма состояния кристаллических льдов.
Многие льды высокого давления можно сохранить и при нормальном давлении. Для этого их охлаждают в жидком азоте, а затем давление сбрасывают. Именно на таких закалённых льдах и были проведены основные исследования. Они показали, что их строение весьма разнообразно.
Структуру первого льда высокого давления, льда II, определили на заре исследований в этой области, когда появились первые мощные приборы для рентгеноструктурного в 1964 году. Как оказалось, этот лёд состоит из полых колонок, образованных шестизвенными гофрированными циклами. Каждая колонка окружена шестью такими же колонками, сдвинутыми друг относительно друга на треть периода. Структуру этого льда можно получить, если часть сот льда Ih развалить и превратить их в ажурные каркасы, связывающие остальные соты. При этом размер получившихся шестигранных каналов сильно увеличивается — именно у льда II самые широкие каналы, их диаметр составляет 3 Å. В таких каналах могут располагаться атомы гелия, неона и даже молекулы водорода.
Рис. Структура льда II
Включить атомы благородного газа, например, гелия в кристаллическую структуру льда II можно двумя способами. Во-первых, приложить (в атмосфере гелия) к воде давление в 0,28–0,5 ГПа и охладить её до 250–270К. Хотя в этой области диаграммы стабильны льды III и V, получится гидрат на основе льда II. Что интересно, протоны в нём уже упорядочены. (Обычно они упорядочиваются только при сильном охлаждении уже получившегося льда.)
Во-вторых, можно растворить гелий во льду Ih при низкой температуре и давлении 0,3 ГПа. Появление гелия приводит к расширению кристаллической решётки, и затем её нагрев до 180К помогает пройти структурному превращению.
Относительная лёгкость получения твёрдых растворов в льду II, а также его высокий потенциал в качестве хранилища газообразного водорода (одна молекула газа на шесть молекул воды) привлекают к нему внимание учёных-практиков: сейчас активно обсуждается возможность его применения в водородной энергетике.
Но самое удивительное в структуре экзотических льдов заключается в том, что молекулы воды при низких отрицательных температурах и высоких давлениях внутри нанотрубок могут кристаллизоваться в форме двойной спирали, похожей на ДНК. Это было доказано компьютерными экспериментами американских учёных под руководством Сяо Чэн Цзэна в Университете штата Небраска (США).
Вода в моделируемом эксперименте «помещалась» в нанотрубки под высоким давлением, варьирующимися в разных опытах от 10 до 40000 атмосфер. После этого задавали температуру, которая во всех запусках имела значение -23°C. Запас по сравнению с температурой замерзания воды делался в связи с тем, что с повышением давления температура плавления водяного льда понижается. Диаметр нанотрубок составлял от 1,35 до 1,90 нм.
Рис. Общий вид структуры воды (изображение New Scientist)
Молекулы воды связываются между собой посредством водородных связей, расстояние между атомами кислорода и водорода равно 96 пм, а между двумя водородами — 150 пм. В твёрдом состоянии атом кислорода участвует в образовании двух водородных связей с соседними молекулами воды. При этом отдельные молекулы H2O соприкасаются друг с другом разноимёнными полюсами. Таким образом, образуются слои, в которых каждая молекула связана с тремя молекулами своего слоя и одной из соседнего. В результате, кристаллическая структура льда состоит из шестигранных «трубок» соединенных между собой, как пчелиные соты.
Рис. Внутренняя стенка структуры воды (изображение New Scientist)
Учёные ожидали увидеть, что вода во всех случаях образует тонкую трубчатую структуру. Однако, модель показала, что при диаметре трубки в 1,35 нм и давлении в 40000 атмосфер водородные связи искривились, приведя к образованию спирали с двойной стенкой. Внутренняя стенка этой структуры является скрученной в четверо спиралью, а внешняя состоит из четырёх двойных спиралей, похожих на структуру молекулы ДНК.
Последний факт накладывает отпечаток не только на эволюцию наших представлений о воде, но и эволюцию ранней жизни и самой молекулы ДНК. Если предположить, что в эпоху зарождения жизни криолитные глинистые породы имели форму нанотрубок, возникает вопрос — не могла ли вода, сорбированная в них служить структурной основой (матрицей) для синтеза ДНК и считывания информации? Возможно, поэтому спиральная структура ДНК повторяет спиральную структуру воды в нанотрубках. Как сообщает журнал New Scientist, теперь нашим зарубежным коллегам предстоит подтвердить существование таких макромолекул воды в реальных экспериментальных условиях с использованием инфракрасной спектроскопии и спектроскопии нейтронного рассеяния.
Какая вода быстрее замёрзнет: Солёная или сладкая (с добавлением сахара)?
Источник