- Отвечаем на вопрос: какая вода замерзает скорее — пресная или соленая, и почему?
- Какая превратится в лед быстрее?
- Сравнительные показатели
- Температура замерзания
- Почему несоленая замерзнет при 0 градусов, а соленая – меньше 0 градусов?
- Факторы и их влияние
- Как происходит кристаллизация в различных растворах?
- Видео по теме статьи
- Заключение
- Почему лед тает под солью, несмотря на минусовую температуру зимой
- Почему лед тает под солью
- Депрессия точки замерзания
- Изготовление мороженого
- Другие субстанции
- Теплофизические свойства и температура замерзания водных растворов NaCl и CaCl2
- Теплофизические свойства раствора CaCl2 (кальций хлористый)
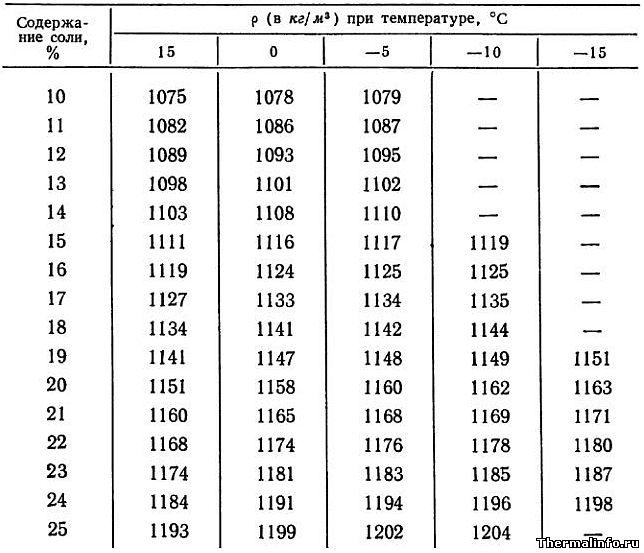
- Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
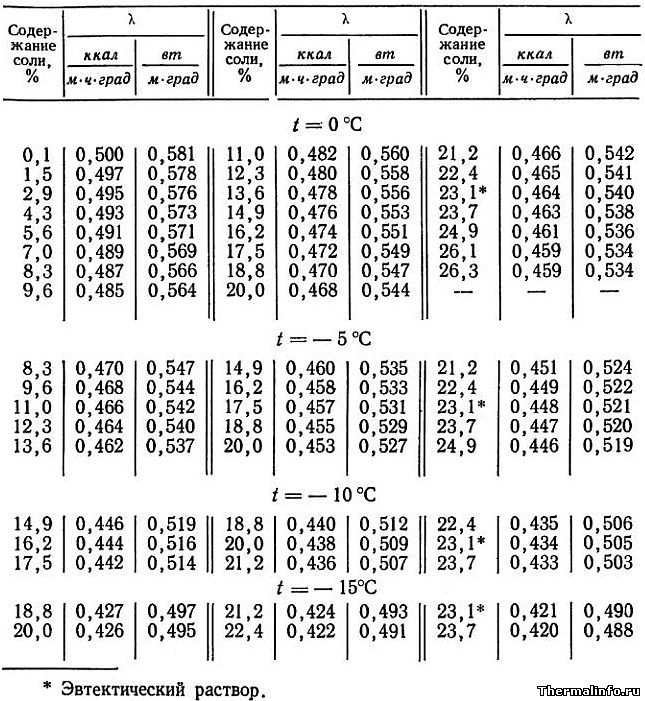
- Теплопроводность раствора CaCl2 в зависимости от температуры
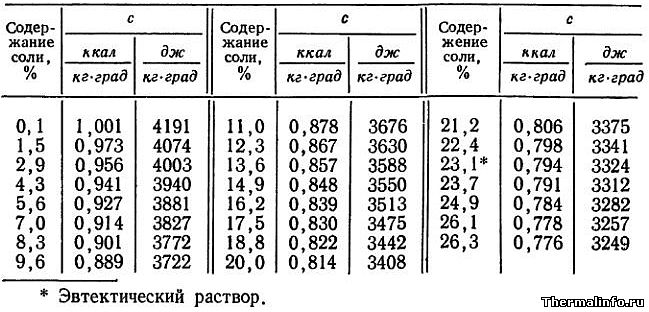
- Теплоемкость раствора CaCl2 при 0°С
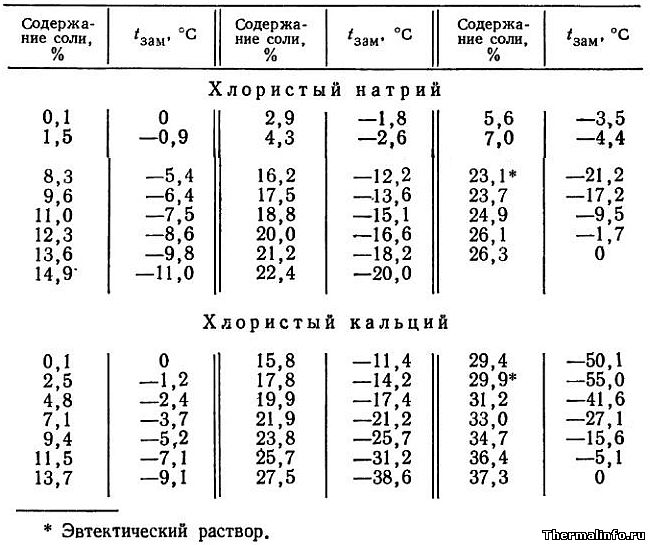
- Температура замерзания растворов солей NaCl и CaCl2
- Плотность раствора NaCl в зависимости от температуры
- Теплопроводность раствора NaCl в зависимости от температуры
- Удельная теплоемкость раствора NaCl при 0°С
- Теплофизические свойства раствора NaCl
- Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
- Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
Отвечаем на вопрос: какая вода замерзает скорее — пресная или соленая, и почему?
Пресная и соленая вода – это различные по составу растворы. Их физические свойства различаются. Незначительно, но это влияет на их хозяйственное использование.
Температура замерзания – это одна из ее качественных характеристик. О том, какая вода замерзает быстрее — пресная или соленая, и почему, расскажем в статье.
Какая превратится в лед быстрее?
При одинаковых внешних факторах скорость кристаллизации пресной воды будет выше, чем соленой. При резком охлаждении молекулы воды начинают сцепляться друг с другом, и формируется осколок льда.
Скорость образования льда из питьевой воды при -43°С составляет одну миллионную секунды (0,000001 с). В нормальных условиях кристаллизация пресной воды начинается при 0°С.

Соленая вода не имеет четко установленной температуры замерзания. Этот показатель зависит от концентрации растворенных веществ.
Рассчитать показатели, при которых начинается образование льда можно по формуле:
Результат всегда будет ниже 0 градусов. Кроме этого, механизм образования льда такого раствора отличается от процессов, проходящих в питьевой воде.
Сравнительные показатели
Наличие примесей существенно влияет на физические свойства вещества:
- Изменяется плотность,
- температурные режимы,
- поведение при переходах из одного агрегатного состояния в другое.
Температура замерзания
Минерализация питьевой воды составляет 0,1%, поэтому температура замерзания 0 градусов Цельсия. Концентрация минеральных добавок в соленой воде варьируется. Температуру замерзания рассчитывают по формуле t3 = -0,0545*S, то есть изменение происходит на -0,54°С на каждые 10 промилле солености.
Например, при минерализации раствора равной 24,7 промилле (морская вода) показатель равен -1,33°С. В Мертвом море насыщенность минеральными добавками достигает 350 промилле. Вода в нем будет кристаллизоваться при -19° Цельсия.
Почему несоленая замерзнет при 0 градусов, а соленая – меньше 0 градусов?
Соленые и пресные воды отличаются по составу. Это 2 различных раствора. Они отличаются по физическим показателям. Поэтому температуры кристаллизации отличаются.
Факторы и их влияние
На начало процесса образования льда в питьевой воде оказывает влияние 2 фактора – процент растворенных минеральных веществ и давление.
Если понизить давление, то процесс кристаллизации замедлится. При изменении показателя на 1 атмосферу температура повышается на 0,01°C.
Факторы, влияющие на температуру образования льда из соленой воды:
- концентрация минеральных веществ;
- внешние условия – погода, наличие ветра, лабораторные условия или естественная среда.
Как происходит кристаллизация в различных растворах?
Процесс кристаллизации жидкости отличается в зависимости от степени ее минерализации:
 Пресная – после образования начального кристалла льда начинается хаотическое изменение ее агрегатного состояния. Могут сформироваться шестиугольный и кубический лед.
Пресная – после образования начального кристалла льда начинается хаотическое изменение ее агрегатного состояния. Могут сформироваться шестиугольный и кубический лед. Они состоят из гексаэдров с атомами кислорода в вершине, но относительное расположение колец отличается. Кубический лед встречается на высоте несколько тысяч метров
Дальнейший процесс зависит от внешних факторов. Соленая вода замерзает, начиная от края емкости, в центре образуется непрозрачный стержень. В нем содержится большая часть минеральных добавок. Эта часть замерзает последней.
Если процесс идет в естественных условиях, то верхняя охлажденная часть будет опускаться вниз. На поверхность поднимаются теплые потоки.
Видео по теме статьи
Какая вода замерзнет быстрее — соленая или пресная, видео-эксперимент:
Заключение
Сравнивать скорость замерзания пресной и соленой воды некорректно. Так как это разные растворы с различными физическими характеристиками.
В одинаковых условиях лед в емкости с первой образуется раньше, чем в пробирке со второй. Ведь их способы и механизмы кристаллизации различны, как и плотность растворов.
Источник
Почему лед тает под солью, несмотря на минусовую температуру зимой
Вы знаете, что можно посыпать солью обледеневшую дорогу или тротуар, чтобы в дальнейшем на них никто не поскользнулся? Но известно ли вам, как соль плавит лед? Что такое депрессия точки замерзания и как она работает, выясним в статье.
Почему лед тает под солью
Замерзшая вода тает под солью ввиду таких причин:
- Соль помогает предотвратить повторное превращение воды в лед путем понижения температуры ее трансформации. Это явление называют депрессией точки замерзания.
- Диапазон рабочих температур не одинаков для всех видов соли. Например, хлорид кальция понижает температуру застывания больше, чем хлорид натрия.
- В дополнение к таянию льда депрессия точки замерзания может использоваться, чтобы изготовить мороженое без морозильника.
Депрессия точки замерзания
Соль растворяет лед ввиду того, что она понижает точку замерзания воды. Так каков этот процесс? Лед начнет таять лишь в том случае, если на его поверхности есть немного жидкости. Хорошей новостью является то, что вам не нужна большая лужа для достижения результата. Лед обычно покрыт тонкой водяной пленкой, и это все, что требуется.
Чистая вода застывает при 0°C. Вода с солью (или любой иной субстанцией) заледенеет, когда температура будет более низкой. Насколько должно быть холодно, зависит от агента, ликвидирующего гололед. Если вы бросите соль на лед тогда, когда температура не собирается подниматься до новой точки застывания соленого раствора, вы не получите выгоды. Например, если вы бросите столовую соль (натрия хлорид) на лед, когда на улице -17°С, то вы просто покроете лед слоем соли. Но если вы ту же соль положите на лед при температуре -9,5°С, вы сможете предотвратить вторичное застывание тающего льда. Магния хлорид работает до -15°С, а хлорид кальция – до -28,8°С.
Если температура снизится до той отметки, на которой солевой раствор может замерзнуть, энергия будет освобождаться и появятся связи, благодаря которым жидкость заледенеет. Этой энергии хватит, чтобы растопить немного чистого льда и продолжить процесс таяния.
Изготовление мороженого
Вы можете самостоятельно реализовать эффект понижения температуры замерзания, даже если у вас нет рядом заледеневшей дороги. Одним из способов является приготовление собственного мороженого в пакете, где смешивание соли с водой приводит к получению очень холодной смеси. Если вы хотите выяснить, как можно холодный лед получить с помощью соли, смешайте 0,935 кг обычной столовой соли с 2,8 кг колотого льда или снега. Будьте осторожны! Температура смеси опустится до -21°C, что может вызвать обморожение, если вы будете долго держать ее в руках.
Поваренная соль делится в воде на ионы натрия и хлорида. Сахар в воде растворяется, но на ионы не распадается. И все же добавление сахара в воду тоже влияет на температуру замерзания.
Другие субстанции
Реакция соли с водой не единственная, которая вызывает замерзание. Каждый раз, когда вы частицы добавляете в жидкость, температура замерзания снижается, а температура кипения повышается. Еще один отличный пример снижения температуры замерзания — водка. Этот алкогольный напиток содержит и воду, и этанол. В домашней морозилке обычно водка не превращается в лед, так как спирт понижает температуру видоизменения воды.
Источник
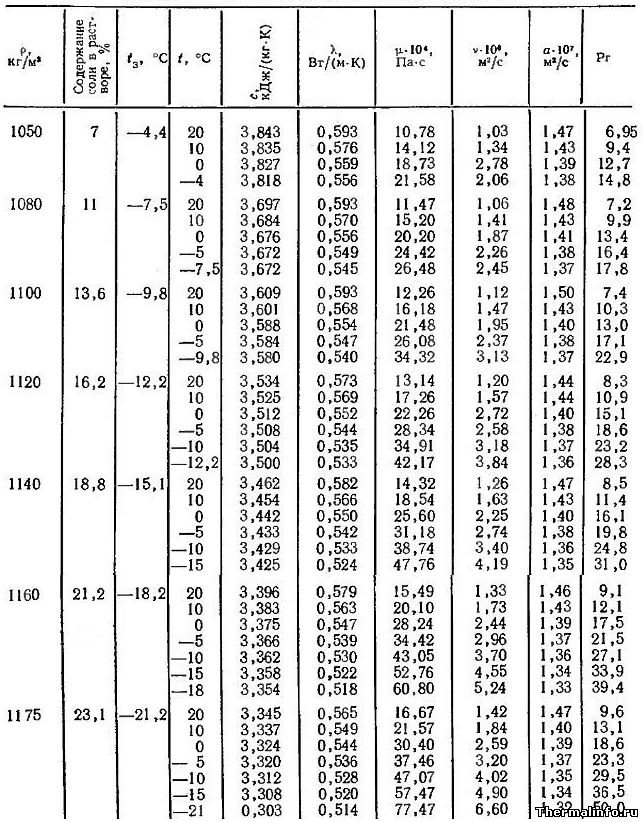
Теплофизические свойства и температура замерзания водных растворов NaCl и CaCl2
Теплофизические свойства раствора CaCl2 (кальций хлористый)
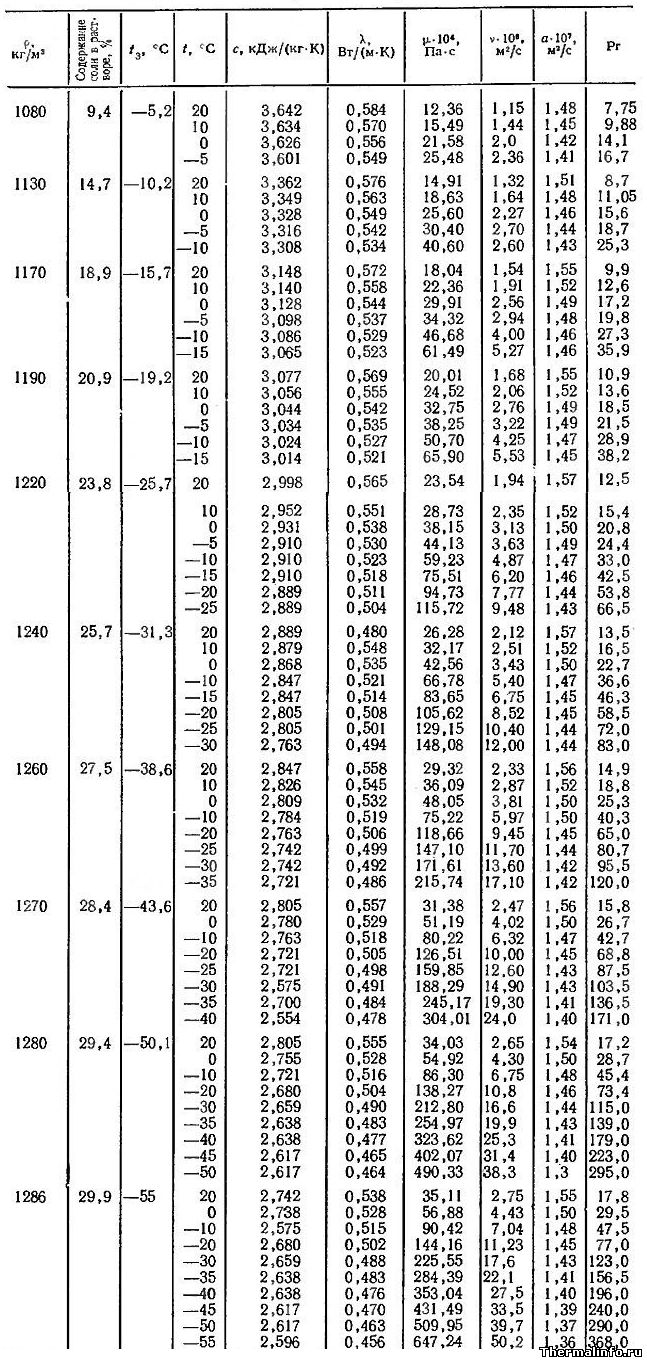
В таблице представлены теплофизические свойства раствора хлористого кальция CaCl2 в зависимости от температуры и концентрации соли: удельная теплоемкость раствора, теплопроводность, вязкость водных растворов, их температуропроводность и число Прандтля. Концентрация соли CaCl2 в растворе от 9,4 до 29,9 %. Температура, при которой приведены свойства определяется содержанием соли в растворе и находится в диапазоне от -55 до 20°С.
Водный раствор хлорида кальция CaCl2 может не замерзать до температуры минус 55°С. Для достижения этого эффекта концентрация соли в растворе должна быть 29,9%, а его плотность составит величину 1286 кг/м 3 .
При увеличении концентрации соли в растворе увеличивается не только его плотность, но и такие теплофизические свойства, как динамическая и кинематическая вязкость водных растворов, а также число Прандтля. Например, динамическая вязкость раствора CaCl2 с концентрацией соли 9,4 % при температуре 20°С равна 0,001236 Па·с, а при увеличении концентрации хлорида кальция в растворе до 30% его динамическая вязкость увеличивается до значения 0,003511 Па·с.
Следует отметить, что на вязкость водных растворов этой соли наиболее сильное влияние оказывает температура. При охлаждении раствора хлорида кальция с 20 до -55°С его динамическая вязкость может увеличиться в 18 раз, а кинематическая — в 25 раз.
Даны следующие теплофизические свойства раствора CaCl2:
- плотность раствора, кг/м 3 ;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость водных растворов, Па·с;
- кинематическая вязкость раствора, м 2 /с;
- коэффициент температуропроводности, м 2 /с;
- число Прандтля.
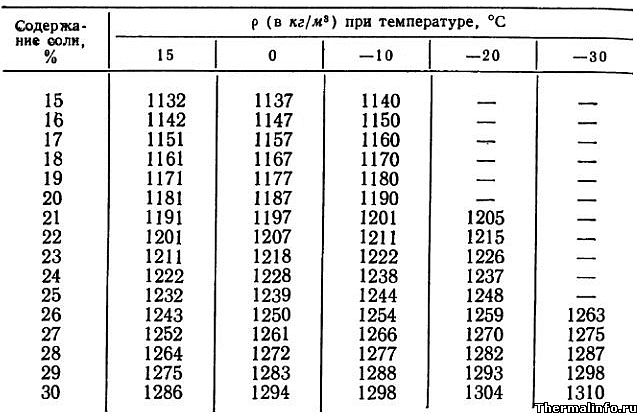
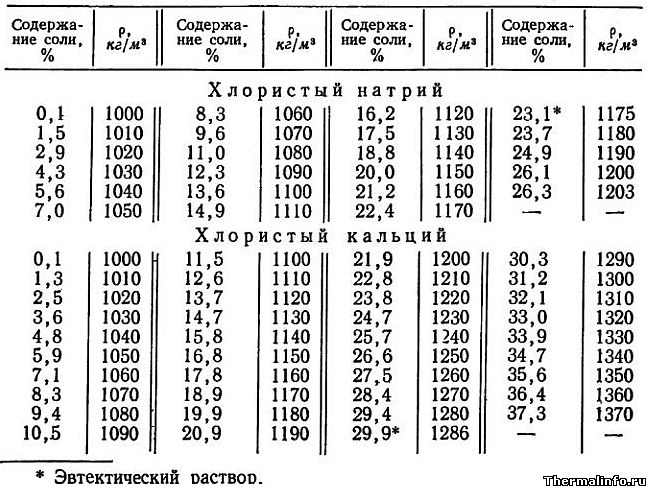
Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
В таблице указаны значения плотности раствора хлористого кальция CaCl2 различной концентрации в зависимости от температуры.
Концентрация хлорида кальция CaCl2 в растворе от 15 до 30 % при температуре от -30 до 15°С. Плотность водного раствора хлористого кальция увеличивается при снижении температуры раствора и увеличением в нем концентрации соли.
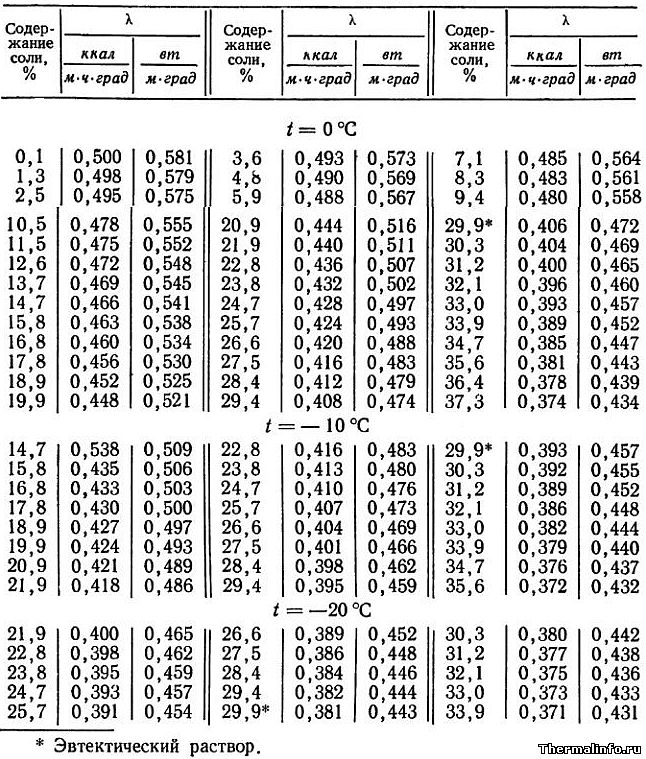
Теплопроводность раствора CaCl2 в зависимости от температуры
В таблице представлены значения теплопроводности раствора хлористого кальция CaCl2 различной концентрации при отрицательных температурах.
Концентрация соли CaCl2 в растворе от 0,1 до 37,3 % при температуре от -20 до 0°С. По мере роста концентрации соли в растворе его теплопроводность снижается.
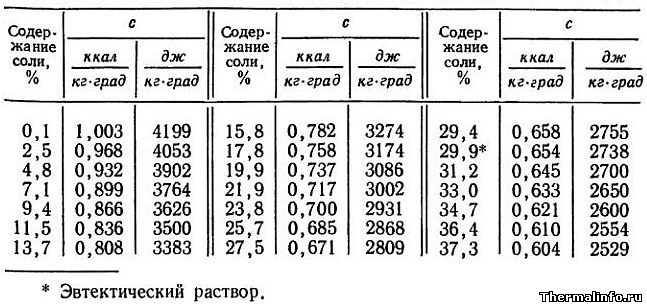
Теплоемкость раствора CaCl2 при 0°С
В таблице представлены значения массовой теплоемкости раствора хлористого кальция CaCl2 различной концентрации при 0°С. Концентрация соли CaCl2 в растворе от 0,1 до 37,3 %. Следует отметить, что с повышением концентрации соли в растворе, его теплоемкость снижается.
Температура замерзания растворов солей NaCl и CaCl2
В таблице приведена температура замерзания растворов солей хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации соли. Концентрация соли в растворе от 0,1 до 37,3 %. Температура замерзания солевого раствора определяется концентрацией соли в растворе и для хлорида натрия NaCl может достигать значения минус 21,2°С для эвтектического раствора.
Необходимо отметить, что раствор хлористого натрия может не замерзать до температуры минус 21,2°С, а раствор хлористого кальция не замерзает при температуре до минус 55°С.
Плотность раствора NaCl в зависимости от температуры
В таблице представлены значения плотности раствора хлористого натрия NaCl различной концентрации в зависимости от температуры.
Концентрация соли NaCl в растворе от 10 до 25 %. Значения плотности раствора указаны при температуре от -15 до 15°С.
Теплопроводность раствора NaCl в зависимости от температуры
В таблице даны значения теплопроводности раствора хлористого натрия NaCl различной концентрации при отрицательных температурах.
Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре от -15 до 0°С. По данным таблицы видно, что теплопроводность водного раствора хлорида натрия снижается по мере роста концентрации соли в растворе.
Удельная теплоемкость раствора NaCl при 0°С
В таблице представлены значения массовой удельной теплоемкости водного раствора хлористого натрия NaCl различной концентрации при 0°С. Концентрация соли NaCl в растворе от 0,1 до 26,3 %. По данным таблицы видно, что с повышением концентрации соли в растворе, его теплоемкость снижается.
Теплофизические свойства раствора NaCl
В таблице представлены теплофизические свойства раствора хлористого натрия NaCl в зависимости от температуры и концентрации соли. Концентрация хлорида натрия NaCl в растворе от 7 до 23,1 %. Необходимо отметить, что при охлаждении водного раствора хлорида натрия его удельная теплоемкость меняется слабо, теплопроводность снижается, а значение вязкости раствора увеличивается.
Даны следующие теплофизические свойства раствора NaCl:
- плотность раствора, кг/м 3 ;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость раствора, Па·с;
- кинематическая вязкость раствора, м 2 /с;
- коэффициент температуропроводности, м 2 /с;
- число Прандтля.
Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
В таблице представлены значения плотности растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации. Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре раствора 15°С. Концентрация хлорида кальция CaCl2 в растворе находится в диапазоне от 0,1 до 37,3 % при его температуре 15°С. Плотность растворов хлорида натрия и кальция растет при увеличении содержания в нем соли.
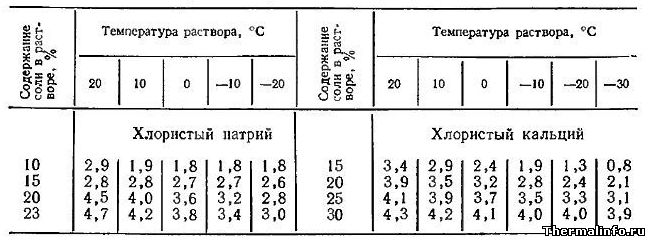
Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
В таблице даны значения среднего коэффициента объемного расширения водных растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации и температуры.
Коэффициент объемного расширения раствора соли NaCl указан при температуре от -20 до 20°С.
Коэффициент объемного расширения раствора хлорида CaCl2 представлен при температуре от -30 до 20°С.
- Чубик И. А., Маслов А. М. Справочник по теплофизическим характеристикам пищевых продуктов и полуфабрикатов.
- Данилова Г. Н. и др. Сборник задач по процессам теплообмена в пищевой и холодильной промышленности. М.: Пищевая промышленность, 1976.- 240 с.
Источник