Термические свойства воды
Термические свойства воды
Термины «теплота» и «температура» нередко используют без разбора для обозначения того ощущения, которое мы испытываем, погружаясь в ванну, однако эти термины имеют совершенно различный
смысл. Теплота — это мера энергии, заключенной в данном веществе, суммарная кинетическая энергия всех его молекул. Температура — это мера скорости движения молекул в веществе. При данной температуре отдельные молекулы разных веществ имеют одинаковую кинетическую энергию, однако эти вещества могут содержать разные количества тепловой энергии — в зависимости от их плотности и молекулярного веса. Например, 1 м3 воды при 30 °С содержит примерно в 500 раз больше тепла, чем такой же объем воздуха при той же температуре, потому что число молекул в этом объеме воды в 500 раз больше.
Зависимость изменения количества тепловой энергии в данном теле от изменения температуры выражается величиной, известной под названием удельной теплоемкости; удельная теплоемкость — это то количество тепловой энергии, которое нужно сообщить данному телу или отнять от него, чтобы изменить его температуру на 1 °С. Небольшое количество тепла, сообщенное данному объему воздуха, быстро изменит его температуру, однако сообщение такого же количества тепла такому же объему воды вызовет лишь незначительное изменение ее температуры. Именно поэтому для того, чтобы довести до кипения большой котел воды, нужно больше времени, чем для того, чтобы нагреть печку, и поэтому-то температура воздуха колеблется в гораздо более широких пределах, чем температура океана или больших озер.
Высокая удельная теплоемкость воды (которая примерно в 500 раз выше, чем у воздуха) и ее высокая теплопроводность (скорость теплопередачи в воде примерно в 30 раз выше, чем в воздухе) определяют постоянство и относительно равномерное распределение температуры в водной среде. Даже в небольших озерах суточные колебания температуры поверхностных слоев воды не выходят за пределы нескольких градусов, тогда как перепады температуры окружающего воздуха могут достигать 10—20 °С. Вода сглаживает также и сезонные колебания температуры. Водным организмам не приходится сталкиваться с такими резкими колебаниями температуры, как наземным организмам, обитающим за пределами тропиков.
Теплопроводность воды обеспечивает однородность водной среды, по в то же время обусловливает быструю теплоотдачу у водных организмов. Воздух обладает лучшими теплоизоляционными свойствами, чем вода, — условие, сделавшее возможным эволюцию тепло кровности у наземных млекопитающих и птиц. Бедность воды кислородом наложила еще одно ограничение на эволюцию тепло кровности у водных животных. Тепло кровность свойственна только тем водным млекопитающим и птицам (киты, тюлени, пингвины, утки и др.), которые дышат воздухом и могут поддерживать высокую скорость метаболических процессов.
Минеральные вещества
В состав соединений, образующих ткани животных и растений, входят не только кислород, водород и углерод. Для построения своего тела и осуществления жизненных функций им необходимы также различные другие элементы. В наибольших количествах (после водорода, кислорода и углерода, которые включаются в живые ткани в результате фотосинтеза) организмам требуются азот, фосфор, сера, калий, кальций, магний, железо и натрий. Основные функции этих элементов перечислены в табл. 3.2. Кроме того, организму необходимы многие другие элементы, хотя и в меньших количествах.
ТАБЛИЦА 3.2. Главные элементы, необходимые живым организмам, и выполняемые ими функции
Структурный компонент белков и нуклеиновых кислот
Структурный компонент нуклеиновых кислот, фосфолипидов и костной ткани
Главный растворенный компонент животных клеток.
Структурный компонент многих белков
Регулирует проницаемость клеточных мембран; структурный компонент костной ткани и вещества, заполняющего промежутки между одревесневшими растительными клетками
Структурный компонент хлорофилла; необходим для: нормального функционирования многих ферментов
Структурный компонент гемоглобина и многих ферментов
Главный растворенный компонент внеклеточных жидкостей
Растения получают минеральные вещества в виде ионов — частиц,- несущих электрический заряд и образующихся в результате диссоциации химических соединений в воде. Например, хлористый натрий, или поваренная соль (NaCl), при растворении диссонирует на ион натрия [Na+] и хлорид-ион [С1
]. Растения получают азот в виде иона аммония [NH4] или нитрат-иона [NO3], фосфор — в виде фосфат-иона^ [РОГ], кальций и калий — в виде простых ионов Са2+ и К+ и т. д. Растворимость минеральных веществ, определяющая их доступность, изменяется в зависимости от температуры, кислотности и присутствия; других растворенных веществ.
В любой воде из естественных источников содержатся растворенные минеральные вещества. Они присутствуют даже в дождевой воде, попадая в нее с частицами пыли и брызгами морской воды. Большинство озер и рек содержит от 0,01 до 0,02% растворенных минеральных, веществ. Эти вещества в конечном счете стекают в моря, в которых соли и другие неорганические соединения, накапливаясь на протяжении: тысячелетий, достигают в среднем концентрации 3,5%. В жарком климате, где концентрация растворенных минеральных веществ в результате испарения воды происходит быстрее, чем разбавление дождевой’ водой, содержание этих веществ в озерах, не имеющих естественного» стока, например, в Большом соленом озере в штате Юта, может доходить до 10%.
Пресная и морская вода различается как по составу, так и по» количеству растворенных минеральных веществ (табл. 3.3). Морская вода богата натрием, магнием, хлорид- и сульфат-ионами, тогда как. в пресной воде преобладают кальций и карбонат-ионы.
Растворенные в воде вещества создают ряд проблем для растений и животных. Во-первых, организмы должны усваивать минеральные вещества из почвы, воды или из пищи. Во-вторых, они должны поддерживать в своем теле более высокую концентрацию этих веществ, чем* в окружающей среде. Наконец, для морских организмов существует’ третья проблема: концентрация многих ионов в морской воде выше, чем в жидкостях этих организмов. При отсутствии регуляторных механизмов ионы диффундировали бы сквозь клеточные мембраны из областей высокой в области низкой концентрации, что приводило бы к: выравниванию концентраций. Вода также проходит сквозь мембраны (осмос) в сторону более высоких концентраций ионов, что приводит к их разбавлению.
ТАБЛИЦА 3.3. Минеральный состав (в %) воды из двух рек, морской воды, плазмы крови и содержимого клеток лягушки
Для морской рыбы, в крови которой концентрация минеральных ионов вдвое ниже, чем в окружающей воде, попытки развести океан водой из собственного организма были бы абсолютно безуспешными. Предотвратить проникновение ионов из среды в ткани тела для морских рыб — задача столь же сложная, как удержать ионы в тканях — для пресноводных видов. Эта проблема решается благодаря полупроницаемое™ клеточных мембран — их способности избирательно пропускать ионы и воду в одном или в другом направлении. У водных животных жабры и почки непрерывно регулируют содержание ионов в тканях и жидкостях тела, поддерживая его на определенном уровне. Почки пресноводных рыб активно препятствуют выходу ионов из организма: вода осмотический всасывается через кожу. Кроме того, у пресноводных рыб жабры активно поглощают ионы из окружающей воды. Жабры и почки морских рыб избирательно выделяют ионы, чтобы уравновесить поступление ионов в организм путем диффузии из окружающей воды. Помимо этого, морские рыбы пьют воду, чтобы восполнить ее потери в результате осмоса, происходящего через кожу.
Потери воды
Обитание на суше ставит перед живыми организмами серьезную Проблему: сохранение воды в теле. Форма и функции большинства надземных организмов, в сущности, приспособлены к тому, чтобы предотвращать иссушение. Их наружные покровы — хитин членистоногих (насекомых, пауков и др.), кожа пресмыкающихся, птиц и млекопитающих, кора и кутикула растений — почти всегда непроницаемы для воды. Более того, органы дыхания, поверхности которых должны все время, оставаться влажными для того, чтобы происходил газообмен, из наружных (жабры рыб и амфибий) превратились во внутренние (легкие, позвоночных, трахеи насекомых), расположенные в глубине тела и тем самым лучше защищенные; у наземных растений газообмен происходит через небольшие отверстия (устьица), находящиеся на поверхности листа (рис. 3.3). Эти морфологические приспособления значительно сокращают потери влаги за счет испарения. Те наземные организмы, у которых нет таких хорошо развитых приспособлений для сохранения воды, например, земляные черви, могут жить только во влажной почве, где воздух> к насыщен водяными парами.
Рис. 3.3. Лист засухоустойчивого растения — олеандра.
. Поперечный разрез листа. Видно расположение устьиц — отверстий, ведущих внутрь листа, через которые происходит газообмен. Устьица лежат в углублениях, расположенных на нижней поверхности листа и заполненных волосками. Волоски ослабляют движение воздуха и задерживают влагу, уменьшая тем самым потери воды через листья. Б. Микрофотография нижней поверхности листа, сделанная при помощи сканирующего электронного микроскопа; видно заполненное волосками углубление, увеличенное примерно в 500 раз.
Потери воды и солевой (ионный) баланс так же тесно связаны между собой, как физические процессы диффузии и осмоса. Животные, которые питаются мясом, получают с пищей больше солей, чем это им необходимо. Пресноводные плотоядные избавляются от избытка солей очень просто: они пьют большие количества воды и выделяют соли со своей сильно разбавленной мочой. При недостатке воды животные не могут быть столь расточительны и должны тем или иным способом концентрировать соли в моче, чтобы с выделением данного количества солей терять меньше воды. Концентрация солей происходит главным образом в почках, однако у многих рептилий и птиц, в частности у морских птиц, имеются особые солевые железы, сходные со слезными железами человека; эти железы, расположенные над глазницами, выделяют соли. Как и следовало ожидать, особенно интенсивно концентрируют соли почки пустынных животных. Если, например, у человека концентрация солей в моче всего в четыре раза превышает их концентрацию в плазме крови, то у кенгуровой крысы почки вырабатывают мочу, в которой содержится в 18 раз больше солей, чем в плазме крови. Благодаря этому кенгуровая крыса (рис. 3.4), обитающая в пустыне, может обходиться совершенно без питьевой воды.
Плотоядные животные потребляют с пищей не только слишком много солей, но и слишком много азота. Азот, получаемый в виде белков, должен удаляться из организма в процессе метаболизма белков. У водных организмов конечным продуктом азотистого обмена служит аммиак (NH3). Аммиак ядовит для живых тканей, однако водные организмы могут быстро выделять его с обильной и сильно разбавленной мочой, прежде чем его концентрация достигает опасного уровня. Наземные животные не могут позволить себе терять так много воды для того, чтобы выделять азот, и у них в качестве конечного продукта белкового обмена образуется какой-нибудь менее токсичный азотсодержащий продукт, который при накапливании в крови и моче не вызывает опасных побочных эффектов. У млекопитающих таким продуктом
выделения служит мочевина, имеющая химическую формулу CO(NH2)2. Птицы и рептилии в своем приспособлении к наземной жизни пошли на* один шаг дальше: у них азот выделяется в виде более сложного продукта— мочевой кислоты (C5H4N4O3). В условиях недостатка влаги образование мочевой кислоты представляет собой явное преимущество* так как она выделяется в виде сухих кристаллов, т. е. организм при этом теряет очень мало воды.
Итак, мы рассмотрели некоторые из основных различий между водными и наземными местообитаниями и особые проблемы, возникающие перед населяющими эти местообитания организмами. Характеристик» водных и наземных сред определяются прежде всего плотностью и термическими свойствами воды и воздуха, а также относительной доступностью кислорода, воды и минеральных веществ. Одна из характерных особенностей почти всех наземных местообитаний в отличие от водных— это наличие почвы. Как мы увидим в следующей главе, почва, представляет собой сложное сочетание породы и разлагающихся органических остатков; происходящие в наземных экосистемах превращения энергии и минеральный обмен совершаются в основном именно в почве. В водных местообитаниях почва не образуется, потому что во многих местах волны препятствуют накоплению рыхлых отложений, а также потому, что у водных растений нет кожистых листьев и деревянистых ветвей, которые, разлагаясь, создают один из главных компонентов почвы. Вероятно, наиболее близкую аналогию» почвы в море представляет собой илистый органический материал, осаждающийся на дне океана. В этом грунте, как и в наземных почвах, обитают многие роющие формы, питающиеся детритом. Под действием волн материал грунта взмучивается, и минеральные вещества вымываются из него в толщу воды. Но на этом аналогия кончается. В отличие от водных растений деревья, кустарники и травянистая растительность наземных местообитаний получают все необходимые им минеральные вещества из почвы и в свою очередь вносят вклад в ее структуру и состав. Кроме того, свойства почвы частично определяются лежащей под ней материнской породой, тогда как отложения, образующие грунт, просто накапливаются на дне океана. Наконец, грунт водоемов всегда полностью насыщен водой, и в нем нет деления на зоны, характерного* для почвы.
Источник
Физические основы гидрологических явлении и процессов
Основные физические свойства воды, снега и льда
Общие сведения. Вода имеет большое значение в жизни Земли. Являясь одним из распространенных и наиболее подвижных природных тел, она участвует почти во всех физических, климатических и биологических процессах, совершающихся на Земле.
При анализе гидрологических явлений принимается, что количество свободной воды на Земле сохраняется постоянным. Вода в результате некоторых процессов вступает в прочные соединения с другими веществами и перестает существовать как свободное образование, однако в глубоких слоях земной коры имеют место и обратные процессы: при высоких давлениях и температурах вновь образуется некоторое количество воды.
Жидкая вода в тонких слоях бесцветна, в толстых имеет голубовато-зеленый оттенок. Чистая вода, без примесей, почти не проводит электрический ток. Температура замерзания дистиллированной воды принята за 0° С, а температура кипения при нормальном давлении — за 100° С.
Природная вода никогда не бывает совершенно чистой. Наиболее химически чистой является дождевая вода, но и она содержит различные примеси, которые захватывает из воздуха. Попадая на землю, дождевая вода отчасти стекает по поверхности, отчасти просачивается в почво-грунты, образуя подземные воды. Стекая по поверхности земли и в толще почво-грунтов, вода растворяет различные вещества и превращается в раствор. Качественный и количественный характер изменений химического состава растворенных веществ и физических свойств воды весьма различен и зависит от всего комплекса физико-географических условий, в которых совершается процесс круговорота воды на Земле.
Строение воды. Вода состоит из 11,11% водорода и 88,89% кислорода (по весу). При образовании воды с одним атомом кислорода соединяются два атома водорода. В молекуле воды атомы водорода и кислорода расположены по углам равнобедренного треугольника: при вершине находится атом кислорода, а в углах при основании — по атому водорода; угол при вершине треугольника около 105°, а расстояние между ядрами водорода и кислорода около 0,97*10 -8 см и между ядрами водорода 1,53*10 -8 см (рис.7).
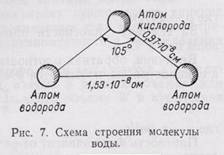
Молекула воды характеризуется значительной полярностью вследствие того, что в ней оба атома водорода располагаются не на прямой, проведенной через центр атома кислорода, а как бы по одну сторону от атома кислорода. Это приводит к неравномерности распределения электрических зарядов. Сторона молекулы с атомом кислорода имеет некоторый избыток отрицательного заряда, а противоположная сторона, в которой размещены атомы водорода, — избыток положительного заряда электричества. Наличием полярности и некоторых других сил обусловлена способность молекул воды объединяться в агрегаты по несколько молекул.
Простейшую формулу H2O имеет молекула парообразной воды. Молекула воды в жидком состоянии представляет собой объединение двух простых молекул (Н2O)2, молекула льда — объединение трех простых молекул (Н20)3. Простая, не объединившаяся с другой молекула воды Н20 называется гидроль, образование из двух объединившихся молекул воды, т. е. (Н20)2, — дигидроль, а соединение из трех простых молекул (Н20)3 — тригидроль. Образование дигидроля и тригидроля происходит вследствие притяжения молекул воды друг к другу в результате отмеченного выше эффекта полярности, свойственного молекулам воды.
Во льду преобладают молекулы тригидроля, имеющие наибольший объем, а простые, необъединившиеся молекулы в нем отсутствуют. В парообразном состоянии при температуре свыше 100° С, вода состоит главным образом из молекул гидроля, так как значительная скорость движения молекул при этой температуре нарушает ассоциацию (объединение) молекул. В жидком состоянии вода представляет собой смесь гидроля, дигидроля и тригидроля, соотношение между которыми меняется с изменением температуры. Между формами молекул воды в зависимости от температуры установлено следующее соотношение (в процентах):
| Форма молекулы | Лед | Вода | |||
| 0ºС | 4ºС | 38ºС | 98ºС | ||
| H2O | 0 | 19 | 20 | 29 | 36 |
| (H2O)2 | 41 | 58 | 59 | 50 | 51 |
| (H2O)3 | 59 | 23 | 21 | 21 | 13 |
Существует и вторая модель строения воды. Исследование воды при помощи спектрального анализа показывает, что структура расположения кристаллов в молекуле воды при температурах ниже 4° С, включая и фазу льда, сходна со строением кристалла тридимита, а при более высоких температурах — со строением кристалла кварца. При понижении температуры кварцевая структура воды постепенно замещается тридимитовой. Принимая во внимание, что лед по структуре сходен с тридимитом (т. е. подобен графиту), и предполагая, что строение воды подобно строению кварца (т. е. алмаза), можно понять, что замещение одной структуры другой приводит к возникновению аномалий воды, в частности к уменьшению плотности при замерзании.
Плотность и удельный объем. Под плотностью воды понимается отношение ее массы m к объему V, занимаемому ею при данной температуре. За единицу плотности принята плотность дистиллированной воды при 4° С.
Величина, обратная плотности, т. е. отношение единицы объема к единице массы, называется удельным объемом:
Плотность воды зависит от ее температуры, минерализации, давления, количества взвешенных частиц и растворенных газов. С повышением температуры плотность всех жидкостей, как правило, уменьшается. Вода в этом отношении ведет себя аномально: при температурах выше 4° С плотность ее с повышением температуры уменьшается, а в интервале температур 0-4° С увеличивается. Аномальное изменение плотности воды объясняется особенностями ее строения. При нагревании воды идут два параллельных процесса: первый — нормальное увеличение объема за счет увеличения расстояния между молекулами, второй — уменьшение объема благодаря возникновению более плотных гидролей и дигидролей.
В зоне температур выше 4° С интенсивнее происходит первый процесс, в интервале 0-4°С — второй. В момент выравнивания влияния, оказываемого этими процессами на изменение объема воды, наступающего при 4° С, наблюдается наибольшая плотность, С точки зрения структурной модели строения воды аномальное изменение плотности при изменениии температуры объясняется постепенной заменой при повышении температуры от 0 до 4° С тридимитовой рыхлой упаковки более плотной кварцевой.
Изменения плотности воды на один градус температуры в различных интервалах температуры неодинаковы. Они очень малы около температуры наибольшей плотности и быстро возрастают по мере удаления от нее. Так, при температуре, близкой к 4°С, изменение плотности воды на один градус температуры составляет 8*10 -6 , при температуре около 30°С — до 3*10 -4 .
При переходе воды из жидкого состояния в твердое (лед) плотность резко, скачкообразно изменяется приблизительно на 9%; плотность дистиллированной воды при 0°С равна 0,99987, а плотность льда, образовавшегося из той же воды при 0°С, равна 0,9167.
С понижением температуры плотность чистого льда несколько возрастает и при -20° С достигает 0,92.
Своеобразный режим изменения плотности воды в связи с изменениями температуры имеет колоссальное значение в природе. Благодаря этому естественные водоемы (например, озера) при отрицательных температурах воздуха зимой даже в условиях сурового климата не промерзают до дна в случае достаточной глубины водоема. При этом под ледяным покровом остается жидкая вода, потому что при промерзании лед, значительно более легкий, чем вода, остается на поверхности водоема, на дно которого опускаются охладившиеся до 4°С наиболее плотные массы воды.
Изменение плотности воды оказывает существенное влияние на режим водоемов, вызывая конвекционные токи и течения, стремящиеся выровнять возникшую неравномерность в распределении плотности.
Плотность снега в гидрометеорологии выражается в виде отношения веса снега к весу воды, взятых в равных объемах, или отношения веса снега Р в граммах к его объему W в кубических сантиметрах
Слой воды hв, содержащийся в снеге, выражается как произведение высоты снега hс на его плотность с, т. е. hв = с*hс. С плотностью снега непосредственно связаны пористость, теплопроводность, водоудерживающая способность, твердость и другие механические и водно-физические свойства снежного покрова.
Плотность снега колеблется в широких пределах как по времени, так и по площади. Наименьшей плотностью, порядка 0,01 г/см 3 , обладает свежий снег, выпавший при низкой температуре и безветренной погоде. С течением времени под влиянием ветра и оттепелей снег уплотняется. Сильно промокший и затем смерзшийся снег обладает плотностью до 0,70 г/см 3 .
В районах с устойчивым снежным покровом обнаруживается некоторая закономерность увеличения плотности снега к началу таяния в направлении с севера на юг. Так, на севере Европейской территории России плотность снега в конце зимы находится в пределах 0,22-0,28 г/см 3 , в средней полосе — в пределах 0,24- 0,32 г/см 3 . На юге она изменяется в широких пределах — от 0,22- 0,23 в районах, не подвергшихся действию оттепелей, до 0,34- 0,36 г/см 3 при наличии зимних оттепелей.
Плотность снега в начале таяния изменяется в среднем от 0,18 до 0,35, в период интенсивного таяния от 0,35 до 0,45 и в конце таяния доходит до 0,50. Плотность снега в лесу в среднем на 10-15% меньше, чем на открытых участках. Для северных и северозападных районов, где влияние оттепелей на плотность снега сравнительно невелико, отмечается прямая связь плотности с высотой снежного покрова. Это позволяет устанавливать эмпирические зависимости непосредственно между запасом воды в снежном покрове и его высотой.
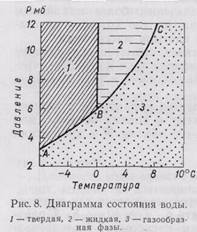
Возможность перехода воды из одного агрегатного состояния в другое (из жидкого в лед или в пар и обратно) определяется температурой и давлением. Диаграмма состояния воды изображена на рис. 8. Линия АВ показывает границу равновесия между парообразной и твердой водой, линия ВС — между парообразной и жидкой водой. При температуре 0,0075°С и давлении 6,1 мб в устойчивом равновесии могут одновременно существовать лед, пар и жидкая вода (точка В на графике).
Если очень чистую воду охлаждать, тщательно предохраняя ее от сотрясения, то лед долго не образуется, несмотря на низкую температуру; практически такое охлаждение производилось до -72° С. Однако переохлажденная вода малоустойчива: при внесении в нес кристаллика льда или при встряхивании она сразу же превращается в лед. Переохлаждение воды в естественных водоемах на 0,005-0,01° С встречается весьма часто. В грунтах вследствие повышенной минерализации переохлаждение воды может быть более значительным.
Удельная теплота парообразования воды и плавления снега и льда. Удельной теплотой парообразования L называется количество тепла, необходимое для перевода 1 г воды из жидкого состояния в парообразное без изменения температуры при нормальном атмосферном давлении. Скрытая теплота испарения воды при 0°С равна 597 кал/г, при температуре 100°С — 539 кал/г, или 2,23*10 6 Дж/кг. При переходе водяного пара в жидкую воду выделяется такое же количество тепла. Теплота, затрачиваемая на перевод жидкости в пар, состоит из двух частей
При температуре испаряющей поверхности 10° С на работу против внешнего давления тратится около 5% удельной теплоты парообразования, а остальные 95% — на повышение внутренней энергии.
С повышением температуры удельная теплота парообразования уменьшается. Эта зависимость может быть охарактеризована следующей эмпирической формулой:
Количество тепла, затрачиваемого на испарение столбика воды высотой E см с площадью основания 1 см 2 при плотности воды = 1, определяется по формуле
Удельной теплотой плавления Lпл называется количество тепла, поглощаемого при переходе 1 г снега или льда в жидкую воду той же температуры. Это же количество тепла выделяется при замерзании 1 г воды. Удельная теплота плавления чистого льда равна 79,9 кал/г при 0° С и нормальном атмосферном давлении.
Количество теплоты, поглощаемое при плавлении или выделяемое при кристаллизации столбиком чистого льда высотой h см и площадью 1 см 2 , определяется выражением
Интересно отметить, что удельная теплота испарения воды и удельная теплота плавления льда значительно больше, чем многих других жидкостей. Эта аномалия объясняется, так же как и аномалия плотности, особенностями строения воды. При переходе жидкой воды в пар и льда в жидкую воду энергия затрачивается не только на преодоление сил взаимного притяжения молекул, но и на разрушение агрегатов двойных и тройных молекул.
Удельная теплота испарения льда и снега при 0° С и нормальном атмосферном давлении равна сумме удельной теплоты плавления льда (79,9 кал/г) и удельной теплоты испарения воды (597 кал/г), т. е. 677 кал/г. Это непосредственно следует из закона сохранения энергии. Действительно, частица льда может либо непосредственно перейти в пар (возгонка), либо сначала перейти в жидкость, а затем уже из жидкости в пар. Так как в обоих случаях начальное и конечное состояние системы одинаково, то изменение энергии должно быть одинаковым.
Количество тепла, затрачиваемого на испарение воды с естественных водоемов, составляет большую долю их теплового баланса; в условиях средних и южных широт России это 40-75% общего количества.
Теплоемкость и теплопроводность. Количество тепла, необходимое для нагревания 1 г воды на 1°С, называется удельной теплоемкостью. В гидрологии теплоемкость обычно выражается в кал/(г*град). Вода характеризуется наибольшей теплоемкостью по сравнению с другими жидкими и твердыми веществами, за исключением водорода и аммиака.
Благодаря большой теплоемкости воды суточные и сезонные изменения ее температуры оказываются менее значительными, чем изменение температуры воздуха, удельная теплоемкость которого в 4 раза меньше, чем теплоемкость воды. Так же как и плотность, теплоемкость воды изменяется с температурой аномально: при 30°С она наименьшая — 0,9975 кал/(г*град) при 15 и 70°С равна 1,000, при 3,6 и 100°С возрастает до 1,0057; теплоемкость водяного пара при 100°С и давлении 760 мм равна 0,462, теплоемкость льда при 0°С — 0,485, а при 10°С — 0,444 кал/(г*град).
Передача тепла путем молекулярной теплопроводности состоит в том, что повышенные колебания молекул в более нагретых слоях постепенно передаются молекулам смежных слоев и таким образом энергия теплового движения постепенно передается от слоя к слою. В результате возникает поток тепла от более нагретых слоев к слоям с более низкой температурой.
Коэффициент теплопроводности воды при 0° С равен 0,001358 кал/(см*с*град). С повышением температуры он увеличивается и при температуре 20° С равен 0,00143 кал/(см*с*град). Вследствие малых значений коэффициента молекулярной теплопроводности перенос тепла с помощью описанного механизма не играет существенной роли в термическом режиме водных объектов. В природных условиях решающую роль при переносе тепла в воде играют турбулентные процессы.
Коэффициент теплопроводности чистого, лишенного пузырьков воздуха льда равен 0,0054 кал/(см*с*град). С понижением температуры теплопроводность льда несколько уменьшается. Теплопроводность снега зависит в значительной мере от его плотности.
Молекулярная вязкость. Поверхностное натяжение. Вязкостью жидкости называется ее свойство оказывать сопротивление взаимному передвижению смежных слоев. Вязкость играет двойную роль при движении жидкости. С одной стороны, она выступает как фактор, формирующий скоростное поле потока, передающий скорости от одного слоя к другому, сглаживающий различие скоростей в соседних точках, а с другой — как фактор, оказывающий сопротивление движению, т. е. способствующий превращению механической энергии в тепловую. Влияние молекулярной вязкости на сопротивление движению воды в естественных условиях в большинстве случаев является малым и им можно пренебречь. В этих условиях основные потери энергии возникают вследствие преодоления сопротивлений, возникающих в результате неупорядоченного, вихревого характера течения воды.
Коэффициент вязкости воды зависит от температуры: с повышением температуры он значительно уменьшается.
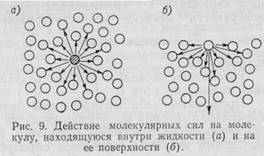
Силы притяжения, действующие между молекулами воды, вызывают на поверхностях раздела вода — воздух — твердое тело явление, называемое поверхностным натяжением. Оно проявляется на границе раздела вследствие разности сил молекулярного притяжения, так как поверхностные молекулы испытывают притяжение, направленное к массе воды, большее, чем в направлении парообразных частиц воды, находящихся в воздухе.
Каждая молекула, расположенная под поверхностью на глубине, большей, чем радиус сил молекулярного притяжения (примерно 5*10 -6 см), окружена со всех сторон молекулами воды, действующими на нее с некоторыми силами. Благодаря симметричному расположению эти силы будут компенсироваться. Когда молекула попадает в поверхностный слой воды толщиной, равной радиусу сил молекулярного притяжения, возникает равнодействующая молекулярных сил, направленная внутрь жидкости. Этот радиус превышает радиус самих молекул, но ненамного, так как силы молекулярного притяжения с увеличением расстояния быстро затухают.
Вода характеризуется очень большим поверхностным натяжением: при 0°С — 75,5 дн/см, при 100°С — 57,15 дн/см. Все жидкости при обычной температуре, за исключением ртути, обладают во много раз меньшим поверхностным натяжением. На границе соприкосновения с твердым телом вода смачивает его поверхность, а действие силы поверхностного натяжения при водит к тому, что поверхность воды в непосредственной близости к твердому телу искривляется, несколько приподнимаясь. Если соприкосновение воды с твердыми стенками происходит в порах или пустотах достаточно большого диаметра, то основная, центральная часть поверхности заключенной в них воды остается плоской. Если же диаметр пор и пустот настолько мал, что он делается соизмеримым с радиусом кривизны пристенного искривления поверхности воды, то искривленные края с обеих сторон сливаются и образуют вогнутый мениск. Практически верхняя граница диаметра пор и пустот, в которых наблюдается образование менисков, измеряется несколькими миллимет-рами. Чем меньше диаметр пор, тем больше кривизна мениска, т. е. тем меньше радиус кривизны.
При образовании вогнутого мениска давление на его поверхности за счет сил поверхностного натяжения оказывается меньше, чем давление на плоской поверхности воды. Связь между поверхностным давлением при плоской поверхности Р0 и давлением на вогнутом мениске P1 выражается соотношение
Поглощение и рассеяние водой (снегом, льдом) солнечной энергии. Солнечная энергия, поступающая к поверхности воды (снега, льда), частично проникает в воду и поглощается ею, частично отражается. Поглощенная лучистая энергия превращается в тепловую.
Количество отражаемой от поверхности воды прямой солнечной радиации зависит от угла падения лучей или высоты солнца; отражение рассеянной радиации от высоты солнца не зависит и происходит по другим законам. Отношение отраженной солнечной энергии к поступающей носит название коэффициента отражения, или альбедо. При больших высотах солнца, порядка 30-80°, от гладкой поверхности воды отражается только 6-2% энергии; при уменьшении высоты солнца количество отраженной энергии быстро возрастает и при угле 15° составляет 21,5%, при 10° — 35%, а при 1° — от поверхности воды отражается 90% падающей на нее прямой солнечной радиации. Коэффициент отражения рассеянной радиации для водной поверхности составляет 5-10%, увеличиваясь с убыванием потока рассеянной радиации.
Отражательная способность снега и льда, помимо высоты солнца, зависит от их структуры, степени загрязненности и пр.
В среднем для условий Европейской территории СССР альбедо снежного покрова для свежевыпавшего сухого снега составляет 0,82, а для мокрого 0,50. Коэффициент отражения в период снеготаяния быстро изменяется от 0,70-0,82 в начале до 0,30 в конце снеготаяния; он закономерно убывает вместе с уменьшением высоты снега и скачкообразно возрастает при каждом новом снегопаде. Наиболее быстро коэффициент отражения уменьшается с уменьшением высоты при небольшой толщине снежного покрова (до 10 см), медленнее — при высоте от 10 до 30 см и остается почти неизменным при высоте 40-50 см.
Поглощение солнечной энергии изменяется в зависимости от длины световой волны и наличия в воде взвешенных и растворенных веществ. Наибольшего значения он достигает в инфракрасной части спектра (длина волны более 0,76 мкм); наименьшие его значения приходятся на видимую световую часть спектра (длина волны от 0,40 до 0,76 мкм). В ультрафиолетовой части спектра (длина волны менее 0,40 мкм) коэффициент поглощения снова возрастает. Таким образом, вода хуже пропускает инфракрасные лучи и лучше световые (видимые) лучи, которые, проникая вглубь, обусловливают освещенность воды. В видимой части спектра (длина волны от 0,40 до 0,76 мкм) более интенсивно поглощается длинноволновое излучение.
В зависимости от коэффициента поглощения, изменяющегося с изменением длин световых волн, на различные глубины проникает разное количество солнечной энергии. После прохождения слоя воды 1,0 см все лучи в спектре с длиной волны более 1,5 мкм полностью поглощаются; на глубину 1,0 см проникает 74% поступающей солнечной энергии, на глубину 100 см — 36%, а до глубины 10 м доходит 18%; остальная часть солнечной энергии поглощается вышележащим слоем воды и расходуется на нагревание.
Рассеяние света происходит как в самой водной массе, так и под влиянием взвешенных в ней частиц. Чем длиннее волна, тем она меньше рассеивается; поглощаются же, наоборот, сильнее длинные волны и слабее короткие. Иначе говоря, сильнее рассеивается и менее поглощается коротковолновая сине-фиолетовая часть спектра и, наоборот, меньше рассеиваются и больше поглощаются красные лучи.
Совокупным действием поглощения и рассеяния объясняется цвет воды природных водоемов. Вследствие того что фиолетовые и синие лучи поглощаются в меньшей степени, чем красные, и в большей степени рассеиваются, цвет воды отличается синеватым и сине-зеленоватым оттенками.
Некоторые характеристики физических свойств снега. Структура снега бывает относительно простой непосредственно после его выпадения: в последующем под влиянием ветрового переноса, оттепелей и собственного веса снега она подвергается весьма значительным изменениям. Вместе с ней изменяются и другие физические характеристики снега.
В снежном покрове, залегающем на земной поверхности, помимо ледяных кристаллов снега, содержится также воздух, а иногда и жидкая вода.
Весовое содержание заключенного в снежном покрове воздуха мало и лишь при плотностях снега менее 0,10 г/см 3 оно составляет несколько процентов от веса снега. Напротив, объем воздуха в снежном покрове весьма велик. Принимая плотность льда равной 0,916 г/см 3 , получим, что при плотности снежного покрова 0,46 г/см 3 занимаемые в нем воздухом и льдом объемы равны. При плотности менее 0,46 г/см 3 объем содержащегося в снежном покрове воздуха превышает объем льда в несколько раз и становится меньше последнего лишь при плотностях более 0,46 г/см 3 .
Изменение структуры снежного покрова связано с изменением с течением времени со-стояния и структуры ледяных (снежных) кристаллов. Снег, выпадающий в безветренную погоду, состоит из разнообразных по форме ледяных звездочек, хлопьев или тончайших игл. Эти первичные ледяные образования, хаотически и непрочно соединяясь между собой, создают рыхлый с малой плотностью свежевыпавший снег. Под влиянием ветров, собственного веса и оттепелей снежный покров уплотняется, снежинки хотя и сохраняют кристаллическую структуру, но форма их подвергается значительным изменениям. Такой уплотненный (лежалый) снег имеет плотность 0,20- 0,60 г/см 3 в зависимости от степени его увлажненности и условий уплотнения.
Лежалый снег в дальнейшем переходит в стадию старого (фирнизированного) снега, полностью утрачивающего свою первичную структуру и формы кристаллов снежинок. Плотность такого снега 0,30-0,70 г/см 3 . Он состоит из ледяных зерен диаметром 1-5 мм и более. Зернистая структура характерна для снега, подвергавшегося действию оттепелей. Возникновение зернистой структуры происходит под действием частичного таяния и повторного замерзания ледяных кристаллов, которые в ходе этого процесса обволакиваются пленкой талой воды и смерзаются. Этому, в частности, способствуют суточные колебания температуры в период весеннего снеготаяния.
Водоудерживающая способность (влагоемкость) снега. Образовавшаяся при таянии снега вода первоначально содержится в виде пленочной и подвешенной капиллярной влаги, удерживаемой прочно на поверхности частиц снега и в промежутках между ними молекулярными и капиллярными силами.
Относительное количество воды, которое снег способен удерживать в своих порах и капиллярных промежутках вне зоны капиллярного поднятия в виде гигроскопической, пленочной и частично гравитационной воды, представляет собой водоудерживающую способность (влагоемкость) снега, определяемую отношением количества жидкой воды к общему количеству воды, содержащейся в данном объеме снега в жидкой и твердой фазах. Водоудерживающая способность снега может быть выражена в процентах или в долях единицы.
Водоудерживающая способность (влагоемкость) снега зависит от степени его перекристаллизации и плотности. Мелкозернистый метелевый снег обладает большей водоудерживающей способностью, чем крупнозернистый при одной и той же плотности. В процессе таяния мелкозернистый снег быстро перекристаллизовывается и его водоудерживающая способность убывает.
Под влиянием различных явлений погоды в зависимости от степени перекристаллизации и плотности водоудерживающая способность снега по мере его таяния непрерывно меняется.
Влажность снега наряду с максимальной влагоемкостью характеризует его водные свойства. Влажностью снега называется количество воды, содержащейся в нем в рассматриваемый момент времени, выраженное в процентах к общему весу пробы влажного снега.
Водоотдача. С развитием процесса таяния промежутки между частицами снега заполняются водой, сила тяжести которой превосходит капиллярные силы. Появляется так называемая гравитационная вода, которая под действием силы тяжести передвигается вниз, пока не достигает почвы, и пока, таким образом, не наступит момент водоотдачи.
Водоотдачей называется процесс поступления воды из снега на почву; интенсивность водоотдачи определяется количеством воды (обычно в миллиметрах слоя), поступающей из снега на поверхность почвы за единицу времени. Когда на поверхности почвы появляется вода, в слое снега, прилегающем к почве, образуется зона капиллярного поднятия. Предельная высота ее зависит от размеров пор снега в этом слое и составляет для мелкозернистого снега 5-6 см, среднезернистого 2-3 см и для крупнозернистого около 1 см.
Между началом таяния и водоотдачи имеет место процесс удержания талой воды снежным покровом, обусловливающий разрыв между таянием и водоотдачей по времени наступления и величине. Разрыв этот особенно значителен в начальный период снеготаяния, когда вся талая вода уходит на образование пленок, заполнение капиллярных промежутков и вообще на увлажнение всей массы снега, без чего процесс водоотдачи из снега невозможен. Когда же процесс таяния достигает известного развития, водоотдача в отдельные промежутки времени может превысить слой воды, образовавшийся за счет стаявшего в этот период снега.
Кроме задержания талых вод снежным покровом вследствие его влагоемкости, имеет место также временное задержание воды, текущей по поверхности склонов, в результате запруживания понижений, в которых течет вода под снегом.
Источник