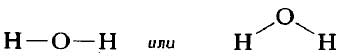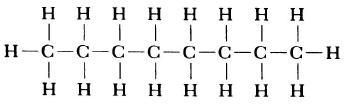- Научная электронная библиотека
- 2. Строение молекулы воды
- Строение молекулы воды
- Общие сведения о строении молекулы воды
- Электронное строение молекулы воды
- Примеры решения задач
- Урок 3. Схема образования молекул
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
Научная электронная библиотека
Шишелова Т. И., Созинова Т. В., Коновалова А. Н.,
2. Строение молекулы воды
Молекула воды (H2O) состоит из двух атомов водорода (H 1 ) и одного атома кислорода (O 16 ).
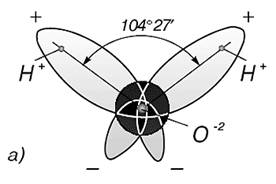
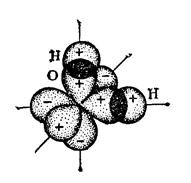
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O-H — 0,9568 Å; H-H — 1,54 Å. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.
Свойства воды в основном зависят от величины водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине, а также из-за того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря чему, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: два атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение.
Рис. 1. Строение молекулы воды [1]
а — угол между связями O-H;
б — расположение полюсов заряда;
в — внешний вид электронного облака молекулы воды
При испарении рвутся все оставшиеся связи. Для разрыва связей требуется большое количество энергии, отсюда высокая температура, удельная теплота плавления и кипения, высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. Строение электронного облака молекулы воды таково, что во льду каждая молекула связана четырьмя водородными связями с ближайшими к ней молекулами, координационное число молекул в структуре льда равно четырем. О размере молекулы можно судить по величине расстояния между ближайшими молекулами во льду, составляющего 2,67Å. Соответственно молекуле воды можно приписать радиус равный 1,38Å.
Тенденция каждой молекулы воды к окружению четырьмя ближайшими молекулами и к образованию с ними водородных связей сохраняется и в жидкости, исследования показали, что в воде сохраняется ближняя упорядоченность, свойственная структуре льда. Расстояние между ближайшими молекулами при плавлении льда изменяется от 2,76 Å до 2,90 Å. Свойственное среднее расположение ближайших молекул ведет к очень рыхлой, ажурной структуре. Именно с этим связаны аномалии воды.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула является миниатюрным диполем с высоким дипольным моментом.
Полярность молекул, наличие в них частично нескомпенсированных электрических зарядов создает группировки молекул — ассоциаты. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. В температурном интервале от 0 до 100°С концентрация отдельных мономерных молекул жидкой воды не превышает 1%. Все остальные молекулы объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой [Н2O]x. Причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды.
Источник
Строение молекулы воды
Общие сведения о строении молекулы воды
Вода – термодинамически устойчивое соединение. Стандартная энергия Гиббса образования жидкой воды при температуре 298 Л рана – 237, 57кДж/моль, водяного пара – 228,94 кДж/моль. В этой связи константа диссоциации водяного пара на водород и кислород очень мала (8,88×10 -41 ).
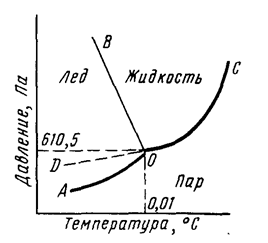
Агрегатное состояние воды определяется температурой и давлением (рис. 1). Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Рис. 1. Диаграмма состояния воды.
Электронное строение молекулы воды
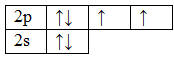
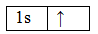
Структурная молекула воды имеет вид H2O. Запишем электронные конфигурации атомов кислорода и водорода в основном состоянии, а затем зарисуем их электронно-графические формулы:
8О 1s 2 2s 2 2p 4
При образовании молекулы воды электронные облака двух неспаренных 2p-электронов атома кислорода перекрываются с 1s-электронными облаками двух атомов водорода; схема этого перекрывания изображена на рис. 2. Поскольку p-электронные облака атома кислорода ориентированы во взаимно перпендикулярных направлениях, то молекула воды имеет угловое строение, причем можно ожидать, что угол между связями О-Н будет составлять 90 o .
Рис. 2. Схема строения молекулы воды.
Однако, на деле валентный угол между атомами кислорода и водорода отличается от 90 o , он составляет 104,5 o .
Примеры решения задач
| Задание | Напишите уравнения реакций между водой и следующими веществами: а) кальцием; б) оксидом углерода (IV); в) железом при нагревании); г) оксидом серы (VI); д) оксидом кальция. |
| Ответ | При растворении кальция в воде происходит образование мутного раствора белого цвета (гидроксид кальция) и выделение пузырьков газа (водород): |
При растворении оксида углерода (IV) в воде происходит образование угольной кислоты. Это обратимая реакция:
При взаимодействии раскаленного железа с водяным паром протекает химическая реакция, уравнение которой имеет вид:
При пропускании оксида серы (VI) через воду происходит образование серной кислоты:
При растворении оксида кальция в воде происходит образование гидроксида кальция. Реакция сопровождается выделением тепла (экзотермическая):
| Задание | Какая масса водорода выделится, если в воду добавить 1г кальция? |
| Решение | Запишем уравнение реакции растворения кальция в воде: |
Рассчитаем количество вещества кальция, вступившего в реакцию (молярная масса – 40 г/моль):
n(Ca) = 1 / 40 = 0,025 моль.
Согласно уравнению реакции n(Ca) : n(H2) = 1 : 1, т.е. n(Ca) = n(H2) = 0,025 моль. Тогда, масса выделившегося водорода будет равна (молярная масса – 2 г/моль):
Источник
Урок 3. Схема образования молекул
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
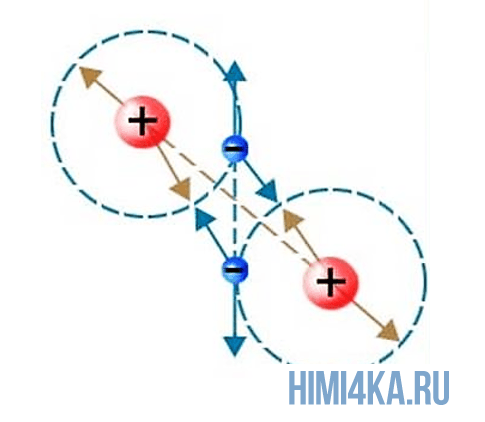
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
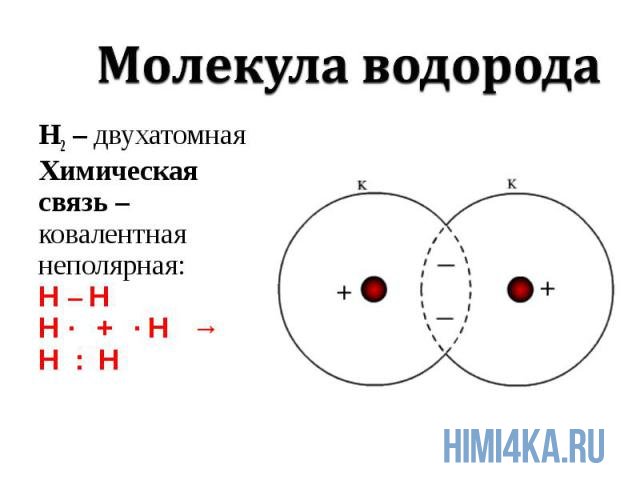
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла , потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность , и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
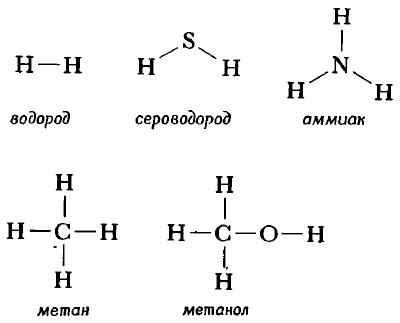
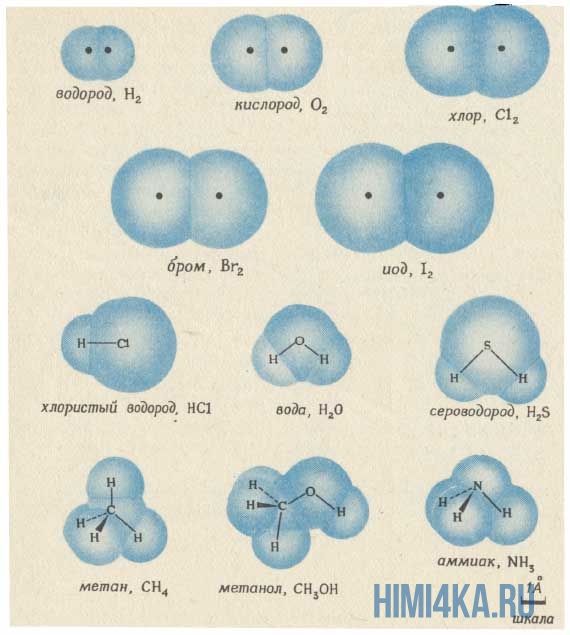
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
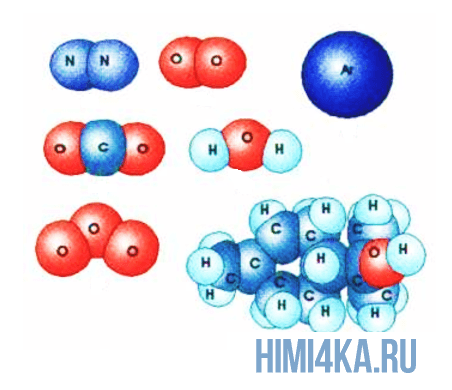
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
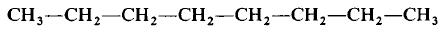
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник