Вода слабый электролит обратимо диссоциирует по уравнению
Одним из важнейших растворителей является вода. Являясь слабым электролитом, вода в незначительной степени диссоциирует на ионы:
В чистой воде концентрации ионов водорода и гидроксид-ионов равны:
Измерения электропроводности чистой воды показали, что при 22 °С степень ее ионизации a = 1,8 . 10 -9 . Так как в 1 литре воды содержится
то концентрация ионов будет равна
а произведение равновесных концентраций:
При данной температуре величина Kw является постоянной и называется ионным произведением воды.
Постоянство величины Kw позволяет утверждать, что при увеличении в растворе концентрации ионов водорода H + (растворение кислоты) происходит уменьшение концентрации гидроксид-ионов, и наоборот.
Если [H + ]=[OH — ]=10 -7 моль/л, то среда раствор нейтральная;
если [H + ]>10 -7 моль/л, то раствор кислый;
если [OH — ]>10 -7 моль/л, то раствор щелочной.
Поскольку значения концентрации ионов водорода в химии растворов используется очень часто, то для удобства введено представление о водородном показателе.
Водородный показатель pH – величина, характеризующая концентрацию ионов водорода и кислотность среды. pH – это отрицательный логарифм концентрации ионов водорода:
Гидроксидный показатель pOH – величина, характеризующая концентрацию гидроксид-ионов и щелочность среды. pOH – это отрицательный логарифм концентрации гидроксид-ионов
Водородный и гидроксидный показатели связаны между собой соотношением
Источник
Диссоциация слабых электролитов



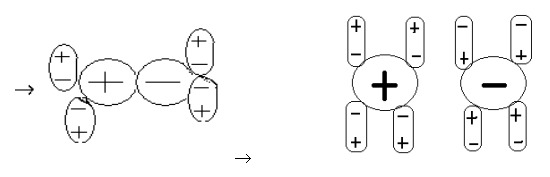
Диполь- дипольный механизм
И электролит, и вода являются диполями. Два диполя притягиваются друг к другу, взаимно усиливая диполи. Оба полюса молекулы электролита оказываются гидратированными молекулами воды. Затем происходит полный разрыв молекулы электролита. В конечном итоге картина та же самая: гидратированные ионы уходят в раствор, рис.1.
Суть диссоциации слабых электролитов в том, что они диссоциируют на ионы не полностью, обратимо.
Диссоциация слабых электролитов:
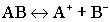
Диссоциация слабых электролитов имеет две количественные характеристики:
1) λ — степень диссоциации. Степень диссоциации не является константой, она зависит от двух факторов:
· от температуры (прямая зависимость);
· от концентрации раствора (обратная зависимость).
2) Константа диссоциации — это, по сути, константа равновесия обратимой реакции.
Константа диссоциации изменяется с температурой, причём зависимость прямая. От концентрации растворов константа диссоциации не зависит.
Взаимосвязь между степенью и константой диссоциации установил немецкий химик Оствальд.
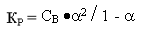
Для слабых электролитов степень диссоциации много меньше единицы и поэтому в знаменателе формулы закона Оствальда ею пренебрегают.
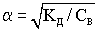
Многие слабые электролиты диссоциируют ступенчато. Каждая ступень имеет свою константу диссоциации
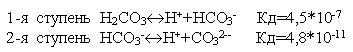
По первой ступени диссоциация заметна при нормальных условиях (при комнатной температуре).
Диссоциация по второй ступени заметна при повышенной температуре, особенно при температуре кипения.
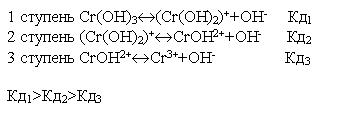
Источник
Вода –слабый электролит, диссоциирующий по уравнению



При 25°С концентрация водородных или гидроксильных ионов в чистой воде составляет 10 моль/л, что соответствует рН 7.
Полярность молекул воды обуславливает ее свойство растворять вещества лучше, чем другие жидкости. Газы хорошо растворяются в воде, если способны вступать с ней в химические связи (аммиак, сероводород, сернистый газ, углекислый газ и др.), прочие газы мало растворимы в водеПри реально существующих на Земле диапазонах атмосферного давления и температуры вода может находиться одновременно в разных агрегатных состояниях (твердом, жидком, газообразном).
При нормальном давлении температура плавления и кипения воды соответствуют 0 и 100°С. С ростом давления увеличиваются температура плавления и кипения. На температуру замерзания воды оказывает влияние ее соленость. Увеличение солености на каждые 10‰ снижает температуру замерзания на 0,54°С.
Плотность воды зависит от температуры и давления, солености а также от содержания растворенных и тонкодисперсных взвешенных частиц и скачкообразно меняется при фазовых переходах. При повышении температуры плотность воды в большей части диапазона изменения температуры уменьшается, что связано с увеличением расстояния между молекулами при росте температуры. Эта закономерность нарушается лишь при плавлении льда и при нагревании воды в диапазоне от 0 до 3,98°С. Плотность воды в твердом состоянии меньше, чем в жидком. В указанном диапазоне температур плотность воды с повышением температуры не уменьшается, а увеличивается. Эти аномалии воды имеют огромное гидрологическое значение: лед легче воды и “плавает” на ее поверхности; водоемы обычно не промерзают до дна, так как охлажденная вода становится менее плотной и поэтому остается в поверхностном слое.
Сжимаемость воды очень мала, но на больших глубинах в океане все же сказывается на плотности воды Если бы вода была совершенно несжимаема, то уровень Мирового океана был бы на 30 м выше.
Очень высокая удельная температура плавления и испарения, а также весьма большая теплоемкость воды оказывают огромное регулирующее влияние на тепловые процессы не только в водных объектах, но и на всей планете. При нагревании земной поверхности огромные количества теплоты тратятся на таяние льдов, нагревание и испарение воды. В результате нагрев земной поверхности замедляется. Наоборот, в процессе охлаждения земной поверхности при конденсации водяного пара и замерзании воды выделяются огромные количества теплоты, сдерживающие процесс охлаждения. Малая теплопроводность воды способствует ее медленному нагреванию и охлаждению. Снег предохраняет почву, а лед – водоемы от промерзания. Передача теплоты в воде рек, озер и морей происходит благодаря турбулентной, а не молекулярной теплопроводности.
Вязкость воды в сравнении с вязкостью других жидкостей невелика, благодаря чему вода текуча, и даже небольшие по величине внешние силы приводят ее в движение. Лед – твердое тело, обладающее пластичностью, которая позволяет ему в некоторых условиях, например в ледниках, двигаться.
У воды в сравнении с другими жидкостями очень высокое поверхностное натяжение. Это качество воды способствует размыву почв и грунтов, позволяет воде подниматься по капиллярам и порам почвы и растений.
Вода пропускает видимую часть электромагнитного спектра с длинами волн от 0,38 до 0,77 мкм лучше, чем более коротко- и длинноволновую части. Свет распространяется в воде на небольшие расстояния. Солнечный свет может проникать в водоемы лишь на небольшую глубину (несколько десятков метров); именно здесь и могут протекать процессы фотосинтеза.
19.Строение атмосферы и ее состав – газовая оболочка Земли, характеризующаяся резко выраженной неоднородностью строения. Атмосферу делят на пять сфер: тропосферу, стратосферу, мезосферу, термосферу и экзосферу. Мощность тропосферы 8-10 км в полярных областях и 16-18 км у экватора. Это самая плотная часть атмосферы, и она непосредственно граничит с поверхностью океана и суши. Температура здесь понижается с высотой (до 6 о С на каждый километр), верхняя граница тропосферы называется тропопаузой.

Для планеты значение тропосферы исключительно велико. Именно здесь зарождаются облака, выпадают осадки, происходят горизонтальные и вертикальные передвижения воздушных масс. Из-за непрерывного перемешивания воздуха и динамического равновесия, поддерживаемого антагонистическими действиями автотрофных и гетеротрофных организмов и различными геохимическими явлениями, газовый состав атмосферы во всей толще тропосферы остается практически постоянным. Состав сухого вещества (в процентах по объему): азот –78,09; кислород – 20,95; аргон – 0,93; углекислый газ – 0,03. Кроме названных компонентов воздух обычно содержит следы водорода, перекиси азота, озона, сернистого ангидрида, оксида углерода, аммиака и т.д. О роли отдельных компонентов атмосферы мы поговорим позднее.
Стратосфера разделена на 2 зоны: нижнюю, с температурой, характерной для тропопаузы, достигающую высоты 25 км, и верхнюю, которая называется область инверсии и простирается до высоты 50 км. Важно отметить, что в стратосфере на высоте в пределах 25-28 км содержание озона превышает содержание этого газа у поверхности в 10 раз. Этот слой атмосферы принято называть озоновым слоем, он и определяет верхний предел распространения жизни на планете.
Далее, до высоты 80 км простирается мезосфера, опять характеризующаяся понижением температуры с высотой. Верхней границей мезосферы является мезопауза.
Область до высоты 600 км называется термосферой (ионосферой).
Верхней оболочкой атмосферы является экзосфера, которая постепенно переходит в межпланетное пространство. Экзосфера – область диссипации атмосферных газов. Диссипация – процесс преодоления молекулами, атомами и ионами поля притяжения Земли.
Газы, входящие в состав атмосферы, можно разделить на три группы: постоянные (азот, кислород, инертные газы), переменные (углекислый газ, вода) и случайные (определяются местными условиями).
В настоящее время на состав и функционирование атмосферы большое влияние оказывают антропогенные факторы, причем как в самых нижних, так и в высотных ее частях. Техногенный выброс различных веществ в атмосферу является наиболее очевидным из нарушений равновесия в окружающей среде, производимых человеком.
Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник