- Простые и сложные вещества
- Основные классы неорганических веществ
- Бинарные соединения
- Запомни!
- Оксиды
- Основные оксиды
- Пример
- Амфотерные оксиды
- Пример
- Кислотные оксиды
- Пример
- Гидроксиды
- Основания
- Пример
- Амфотерные гидроксиды
- Пример
- Кислоты
- Пример
- Пример
- Названия кислот и кислотных остатков
- Полезные ссылки
- Дополнительные материалы
- Жёсткость воды
- Сложные вещества
- Жёсткость воды
- Химический состав питьевой воды: какие элементы туда входят, свойства жидкости, нормы качества, характерные особенности, таблица
- Составные элементы
- Основные (преобладающие) компоненты
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
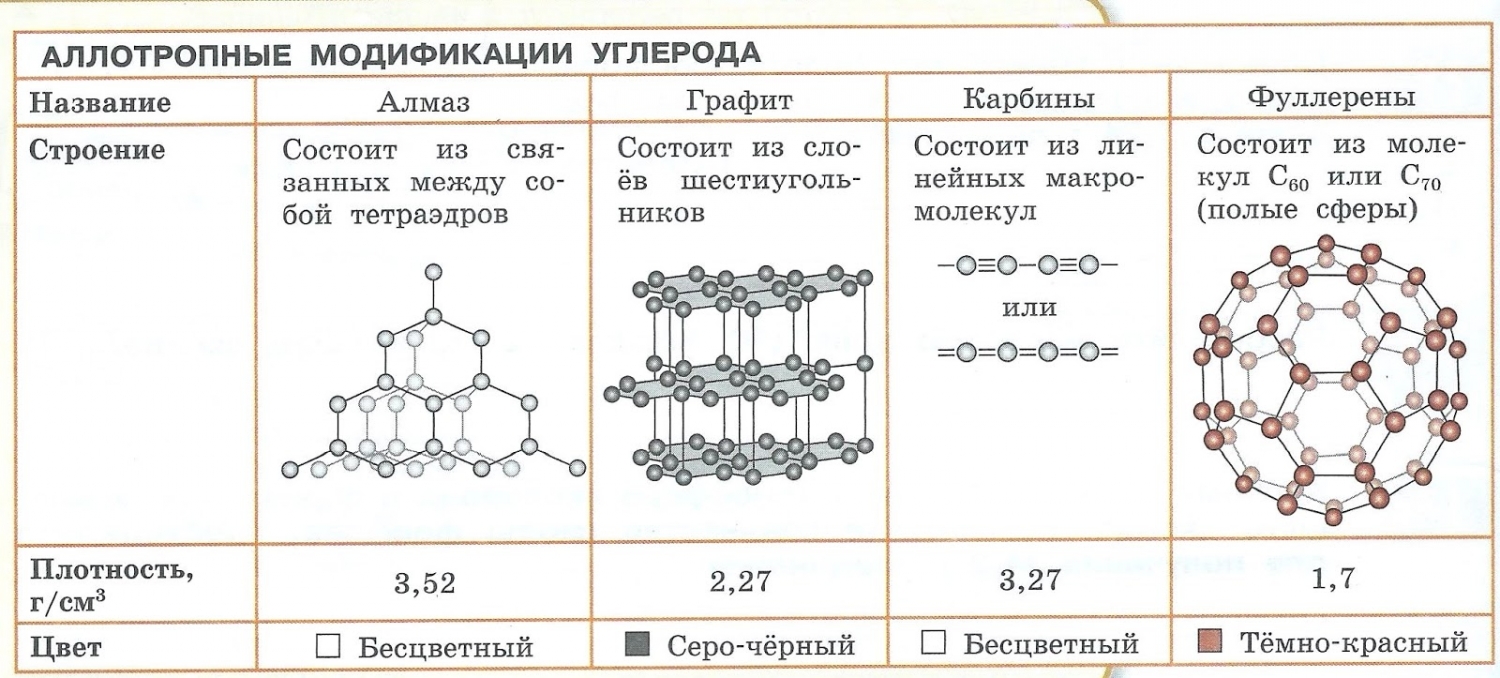
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
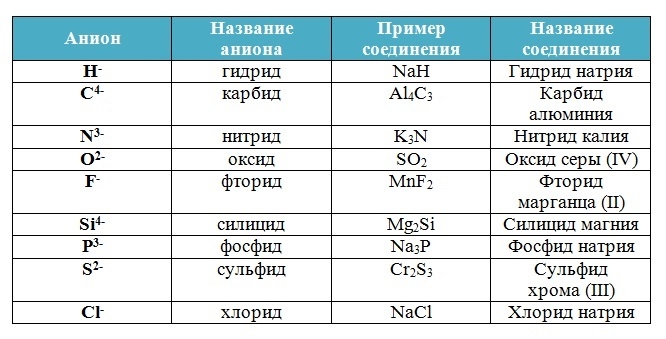
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
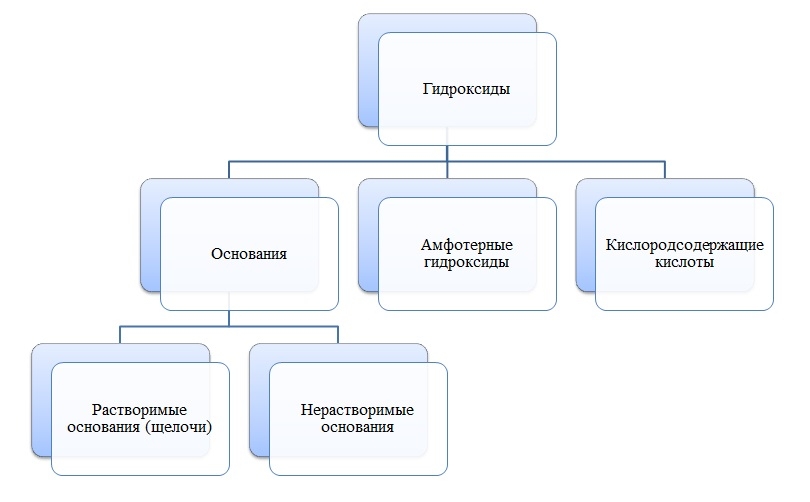
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Дополнительные материалы
Станьте первым, кто оставит
комментарий к данному материалу.
Источник
Жёсткость воды
Сложные вещества
Сложные вещества — это химические вещества, образованные соединением нескольких простых веществ. В хозяйстве в большей степени мы пользуемся сложными веществами и в гораздо меньшей степени — простыми веществами.
К используемым нами сложным веществам относятся соли (c химической точки зрения), оксиды, основания или щелочи, кислоты, а также многие органические соединения, например спирты, парафины, альдегиды и т.д.
| Ваш вес | Дневная норма воды |
| 18 кг | 0,5 л |
| 27 кг | 0,75 л |
| 36 кг | 1,0 л |
| 45 кг | 1,25 л |
| 54 кг | 1,5 л |
| 63 кг | 1,75 л |
| 72 кг | 2,0 л |
| 81 кг | 2,25 л |
| 90 кг | 2,5 л |
| 99 кг | 2,75 л |
| 108 кг | 3,0 л |
| 117 кг | 3,25 л |
| 126 кг | 3,5 л |
| 135 кг | 3,75 л |
| 144 кг | 4,0 л |
Вода — сильный растворитель. Как вы думаете, при какой температуре вода больше весит?
Наибольшая плотность воды зафиксирована при температуре 4°С, выше и ниже этой температуры плотность постепенно уменьшается. Соответственно, и весит вода больше всего при 4°С.
Дистиллированная вода по вкусу отличается от водопроводной. Это объясняется тем, что в обычной воде растворены десятки различных солей ,- это соли кальция (присутствие данных солей затрудняет образование мыльного раствора при стирке), магния (обычно придаёт горечь воде), а также соли железа, щелочных металлов и много других веществ.
Вода, обогащенная ионами металлов, полезна для организма (но не из-под крана!). Например, калий и магний — для работы сердечных мышц, кальций и железо – для свёртывания крови, натрий — для образования минеральных солей, имеющих щелочную реакцию и способных расщеплять органические вещества.
Всем известно, что организм человека состоит на 81% из воды и, конечно же, постоянно нуждается в её пополнении. Поэтому сужествует норма приёма воды организмом человека в зависимости от веса человека:
Жёсткость воды
Жёсткость воды — определяется наличием в воде катионов кальция (Ca) и магния (Mg). Чем выше содержание этих катионов, тем больше жёсткость воды. Существует временная жёсткость воды и постоянная жёсткость воды. Временная жёсткость устраняется при кипячении. Соли, растворённые в воде (гидрокарбонаты кальция и магния Ca(HCO3)2, Mg(HCO3)2) легко распадаются при нагревании,образуя воду и углекислый газ:
Постоянная жёсткость воды кипячением удалить невозможно. Такая вода содержит соли — сульфаты, хлориды, нитраты кальция, магния. Но всё-таки можно избавиться и от постоянной жёсткости воды: используем известковое молоко (гашеная известь — Ca(OH)2) или соду.
Одним из наиболее эффективных средств устранения постоянной жёсткости воды является использование ортофосфата натрия (Na3PO4). При взаимодействии его с водой соли, придающие воде жёсткость, выпадают в осадок:
При кипячении жёсткой воды на стенках посуды образуется накипь — соли кальция и магния. Они плохо проводят тепло. Если накипи образовалось много, то стенки посуды могут перегреться.
При стирке в жёсткой воде мыла расходуется значительно больше. Это связано с образованием нерастворимых в воде сложных веществ — стеаратов кальция и магния (Ca(C17H35C00)2 и Mg(C17H35COO)2)
В жёсткой воде и овощи варятся дольше, так как углеводы, содержащиеся в овощах, образуют с солями кальция и магния нерастворимые сложные вещества.
Вода и Лёд. Почему вода тяжелее льда?!
Фрагменты (Н2О)8 сохраняются и в жидкой воде. Внутрь таких агрегатов попадает часть молекул Н2О, поэтому плотность воды оказывается выше плотности льда (900 кг/м 3 )
О проточной питьевой воде:
Все знают, что обезвреживание проточной воды производят с помощью хлорки, или точнее раствора,содержащего хлор. Микроорганизмы в такой среде выжить не могут и гибнут. Но при этом ухудшается и качество воды, ведь хлор — очень сильный окислитель, вступает в химическую реакцию с растворёнными в ней примесями и образует хлорорганические соединения, вредные для здоровья. Одни из самых токсичных и вредных веществ — диоксины. Эти вещества — самые настоящие яды! Они поражают органы человека, нарушают их правильное функционирование. Не всегда и фильтры могут справляться с переизбытками растворённого хлора.
Из всей воды, на нашей планете только 1% пригодна для питья. Несмотря на то, что существует большое разнообразие различных очистительных фильтров, даже самый лучший фильтр (содержащие слои ионообменной среды, активированного угля) не способен устранить все токсичные вещества из воды. получить чистую воду можно регулярной заменой фильтра (картриджа), при этом надо учитывать, источник, из которого берётся вода и как очищается (например, в особо загрязнённых районах фильтр нужно менять чаще, так как он быстрее портится).
Самую чистую и полезную воду получают из природных источников, которая предварительно обрабатывается, дополнительно очищается и разливается в стеклянные бутылки!
Снег образуется, когда микроскопические капельки воды в облаках притягиваются к частичкам пыли и замерзают. Кристаллики льда, которые при этом появляются, не превышают сначала 0,1мм в диаметре, падают вниз и растут из-за конденсации на них влаги из воздуха. При таком движении образуются шестигранные кристаллические формы. Через структуру молекул воды между вершинами кристалла возможно образование углов размерами лишь 60 и 120 градусов. Основной кристалл воды имеет в горизонтальной плоскости форму правильного шестиугольника. На вершинах этого шестиугольника оседают новые кристаллы, на них – новые и таким образом образуются различные формы звёздочек – снежинки.

При достаточно высокой температуре воздуха кристаллы неоднократно тают и снова кристаллизируются. Это нарушает правильную форму снежинок и образует смешанные разновидности. Кристаллизация всех шести углов снежинок происходит одновременно в практически одинаковых условиях и, поэтому, формы углов снежинок получаются тоже одинаковыми.
С точки зрения кристаллографии наиболее естественной формой снежинок является «шестиугольная» симметрия. При этом в природе широко распрострастранены треугольные снежинки. Причины такого различия до настоящего времени остаются неизвестными.
Для образования треугольной снежинки необходима температура 2 градуса ниже нуля.
Новое исследование проведено американскими физиками по количественным оценкам влияния различных факторов на рост снежинки. Как считают физики, имеется 2 основных фактора: динамика диффузии молекулы воды в воздухе и динамика поведения этих молекул на поверхности кристалла. Им удалось установить, что эти параметры непосредственно определяются потоками воздуха, которые охватывают снежинку. Свои теоретические допущения учёные проверили с помощью специальной «снежной машины» — камеры, с помощью которой можно контролировать рост снежинок. В результате было определено, что треугольные снежинки являются наиболее стойкими, то есть изменение потоков воздуха не приводит к изменению формы снежинки. Именно это, по мнению учёных, объясняет распространение треугольных снежинок.
Совсем недавно учёным из Великобритании удалось получить «пятиугольник» снежинку. Они разместили тонкий слой льдинок на поверхности меди. В этом слое молекулы воды разместились в вершинах пятиугольников.
Только на нашем сайте топ выгодных франшиз России по выгодной цене
Источник
Химический состав питьевой воды: какие элементы туда входят, свойства жидкости, нормы качества, характерные особенности, таблица
Чистая формула Н2О встречается разве только в условиях лабораторий. И это хорошо, ведь даже для здоровья более полезно наличие ряда микроэлементов, которые поступают в организм с жидкостью. Для показательного примера предположим, что мы взяли одну каплю из родника (или иного водоема природного образования) и оставили ее на предметном стекле. Спустя несколько минут при определенных условиях она испарится (водород и кислород – это газы, которые просто улетучиваются), но на поверхности останутся разводы. Это и будут кристаллы соли, соединения металлов, которые в большом количестве содержатся в живительной для всей природы влаге. Итак, в статье поговорим о том, какой химический состав у питьевой воды, что является нормой, представим свойства в таблице.
Составные элементы
Сразу оговоримся, что в рамках данной темы мы рассматриваем водный ресурс, полученный из источника (скважина, колодец, родник, естественный водоем с водонапорной башней и пр.) и прошедший через многоступенчатую систему водоподготовки. Целью этих очистительных манипуляций является создание раствора, очищенного от вредных и особенно крупных взвесей. Иными словами, состав и концентрация микроэлементов должны соответствовать стандартам.
Нормативные акты (ГОСТы и СанПиН) разрабатываются с учетом санитарных и экологических рекомендаций отдельно для холодного и горячего водоснабжения. Таким образом, в каждом литре H2O находится некоторое количество (в мг) веществ, которые обогащают ее, придают запах, цвет и уровень прозрачности или мутности.
Также имеют значения при проверке еще и такие факторы:
- рН. Это уровень кислотности от 0 до 14. Оптимальным показателем, который наиболее соответствует нейтральной кислотно-щелочной среде организма, считается 7.
- Жесткость. Это концентрация калиевых и магниевых солей, которые при переизбытке негативно сказываются на качестве водного ресурса. Он плохо отражается на здоровье, способствует образованию камней в почках, а также влияет на бытовую технику, создавая слой накипи.
Кроме всем известных показателей, в лабораториях используют термины «железистость», «хлорирование». Привычный для городских централизованных систем водоподготовки способ обеззараживания может при избыточном хлоре в составе привести к негативным последствиям для состояния кожи, ногтей и волос.
Таким образом, мы понимаем, что все вышеперечисленные характеристики зависят от того, что входит в состав воды и в каком количестве. Постараемся разобраться в нормах и излишках примесей.
Основные (преобладающие) компоненты
Ниже мы приведем таблицу с элементами, которые могут содержаться в качестве взвесей, а также их максимальная концентрация в пересчете на литр водного питьевого раствора – требования взяты из нормативных документов российского законодательства (европейские регламенты обычно намного более жесткие по отношению к допустимым загрязнениям). Но прежде чем перечислить вещества, отметим, что нельзя руководствоваться только цифрами. Дело в том, что сами по себе химикаты могут быть не вредны, но при их взаимодействии образуются соединения, опасные для здоровья. Хотя по отдельности их содержание было в пределах нормы. Поэтому следует заказывать полноценные анализы химических и физических особенностей воды из источника. Итак, что может быть в растворе (мг/л):
Источник