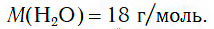Урок 27. Состав и физические свойства воды
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Состав и строение воды
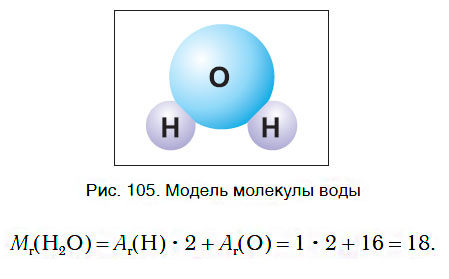
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
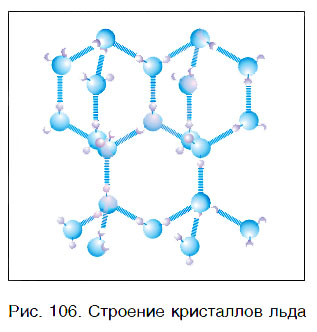
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см 3 , а плотность жидкой воды — примерно 1,00 г/см 3 . Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Состав воды. Химические свойства воды. 8-й класс
Класс: 8
Презентация к уроку
Цели.
Оборудование: модель молекулы воды; металлы: натрий, медь, магний; вода, фенолфталеин; 3 стакана (литровые), металлическая ложечка, спиртовка, магнитофон, компьютер, диски.
1. Организационный момент. (Слайд 1)
2. Решение задачи на вывод формулы воды. (Слайд 2)
Задача: Элементарный состав вещества следующий: массовая доля водорода – 11,8%, массовая доля кислорода – 88,2%. Выведите химическую формулу (один учащийся решает на доске, остальные в тетрадях).
После решения проверяем задачу.
Н : О = 11,8/1 : 88,2/16 = 11,8 : 5,6 = 2 : 1
3. Слово учителя: Сегодня на уроке мы начнем знакомство с замечательным веществом – “вода”. Изучим ее состав и свойства.
Откройте тетради и запишите тему урока. (Cлайд 3)
Казалось бы, что мы все знаем о воде, но до сих пор она преподносит загадки одна сложнее другой.
Известный русский геолог академик А.П.Карпинский говорил, что нет более драгоценного ископаемого, чем вода, без которой жизнь невозможна. Водная среда включает поверхностные и подземные воды. Поверхностные воды в основном сосредоточены в Мировом океане, содержащем около 97% всей воды на Земле (если распределить воду ровным слоем, то она покроет Землю толщиной 3000 метров), на суше содержится небольшая часть воды – 2,6%. Причем из этой воды большая часть недоступна (ледники, снега, грунтовые воды). Только очень малая часть всего влагозапаса (0,014%) доступна людям.
Хочется отметить, что есть много районов на Земле, где воды катастрофически не хватает, в других местах она потеряла свои ценные качества и стала непригодной из-за неразумной деятельности человека. В связи с эволюционной теорией, жизнь на Земле зародилась в воде. Она считается первичной средой для эволюции органического мира и входит в состав всех живых организмов. Общая масса воды, содержащейся в живых организмах, составляет около 2500 кубических километров.
Итак, вода: (Cлайд 4)
а) молекулярная формула (учащиеся называют и записывают);
б) относительная молекулярная масса (вычисляют: на доске 1 ученик, остальные в тетрадях);
в) структурная формула: показываю шаростержневую модель молекулы воды, по модели определяют валентности кислорода и водорода. По валентности составляют структурную формулу.
Вопрос классу: В каких агрегатных состояниях может находиться вода?
Учащиеся называют. (Диск: глава 4 “Химическая термодинамика”, модель 4.7. “Агрегатные состояния воды”.)
Сообщение учителя: есть еще одна загадка воды. Если было бы абсолютно чистое озеро, то можно было бы скользить на коньках. Вода образует прочную пленку. Загадок воды много и на все вопросы еще нет ответов.
Есть ли вода на других планетах? (Сообщение учащегося)
Вспомним, как происходит круговорот воды в природе (смотрим на экран). (Диск: модель 10.1. Круговорот воды и загрязнение окружающей среды)
В этой модели схематично показано важное природное явление – круговорот воды. Вы видите, как нагревание моря солнечным излучением приводит к образованию облаков из водяных паров, затем к выпадению осадков и возвращению воды в море с помощью рек.
А при загрязнении окружающей среды вы видите, что загрязнение вносятся как при выбросе в атмосферу агрессивных веществ в процессе работы предприятия и электростанций, так и при сбросе в реки и другие водоемы неочищенных промышленных стоков.
Слово учителя: продолжим беседу о воде, о ее роли в живых организмах. (Сообщение учащегося)
Продолжает учитель: а сейчас мы перечислим физические свойства воды: агрегатное состояние, цвет, запах, температуру кипения и замерзания.
Вода – химически активное вещество, она взаимодействует со многими веществами. Самое общеизвестное, видимое из таких взаимодействий – растворение веществ в воде. Вода является наиболее универсальным растворителем, т.е. в ней хорошо растворяются многие вещества.
Любая природная вода представляет собой раствор, в котором содержатся различные соли, газы и другие вещества.
Рассмотрим химические свойства воды.
Вода взаимодействует с металлами: демонстрация опыта: в 3 литровые стаканы с водой опускаем кусочки металлов с разной активностью: натрий, магний, медь.
Что вы наблюдаете?
Беседа, выводы: вода взаимодействует с металлами по-разному.
(Учитель знакомит с “Рядом активности металлов”, помещенным на форзаце учебника). В этом ряду металлы расположены в порядке уменьшения их химической активности. Все металлы можно разделить на 3 группы: активные (начинаются натрием, кончаются магнием) они реагируют с водой без нагревания, менее активные (магний – свинец) они реагируют с водой при нагревании и металлы, которые с водой не взаимодействуют (ртуть – золото).
Продукты реакции можно обнаружить индикатором, например, фенолфталеином: там, где малиновое окрашивание, там щелочь.
Запишем уравнения реакций.
(Записывают уравнения реакций в тетрадях)
4. Подведем итоги урока.
Сегодня на уроке мы изучили состав воды, физические и химические свойства.
Беседа по вопросам.
- Из каких элементов состоит вода?
- Перечислите физические свойства воды.
- Как вода взаимодействует с металлами?
- Значение воды в жизни человека.
5. Домашнее задание: §29, решить задачи №1, 2.
Источник
Вода, ее состав, свойства, значение.
методическая разработка по химии (8 класс) на тему
Скачать:
| Вложение | Размер |
|---|---|
| urok-issledovanie._voda_ee_sostav_svoystva_znachenie.docx | 38.2 КБ |
| презентация | 441.16 КБ |
Как сдать ЕГЭ на 80+ баллов?
Репетиторы Учи.Дома помогут подготовиться к ЕГЭ. Приходите на бесплатный пробный урок, на котором репетиторы определят ваш уровень подготовки и составят индивидуальный план обучения.
Бесплатно, онлайн, 40 минут
Предварительный просмотр:
Тема. Вода, ее состав, свойства, значение.
Цель: расширить представления о воде как об уникальном веществе на Земле, свойствах, значении и охране водоемов от загрязнения. Познакомить с методами оценки качества воды.
- Закрепить знания о составе, свойствах воды;
- Показать значение воды, ее запасы, распространение, использование.
- Рассмотреть экологическую проблему-загрязнение воды;
- Провести исследования: «Качественная оценка свойств воды из разных источников».
Оборудование: презентация с таблицами (приложение № 1); песня Водовоза; лабораторное оборудование: три колбы с водой из разных источников, шесть чистых пробирки, мыльный раствор, индикаторная бумага, бумажная полоска «Аквачек», мерный цилиндр, линейка; технологическая карта, бланк практической работы.
- Организационный момент.
- Новый материал.
- Вводная беседа.
Химическое вещество вода всем хорошо известно, и на первых порах кажется, что в ней нет ничего удивительного или интересного. На самом деле это далеко не так. Посмотрим на известную нам с первых дней жизни воду несколько иначе, и я буду рада, если кто-то увидит, откроет для себя обычное — необычное вещество, которое называется водой.
Есть старая – старая песня (звучит отрывок из песни Водовоза)
Почему я водовоз?
Потому что без воды —
И ни туды и ни сюды!
Отдыхаем — воду пьем,
Заседаем — воду льем,-
И, выходит,- без воды,
И ни туды и ни сюды!
Действительно, вода нас поит, кормит, моет, лечит, одевает, обувает, гасит пожары, «расти» для нас хлеб, масло, сахар, шоколад и конфеты, дает электроэнергию, позволяет ездить, плавать, летать и вообще… жить !
Сейчас никому не составит труда назвать формулу воды (ученик записывает формулу). Каждый знает, что это «аш» два «о». Такую классическую формулу предложили в 1805 году А. Гумбольд и И.Ж. Гей-Люссак. (дем. слайд № 2)
- Значение и свойства воды.
Вода — самая распространенное вещество на Земле: ¾ поверхности планеты покрыто морями, океанами, реками, ледниками. Она находится во всех геосферах, играет важную роль как климатообразующий фактор и является также основным компонентом среды и живых организмов.
Каково значение воды для живых организмов? (учащимся предлагается вспомнить значение воды из курса биологии, географии).
Значение воды для живых организмов.
1. Основная часть всех живых организмов. (дем. слайд № 3)
Воды в живых организмах в 5 раз больше, чем во всех пресных водоёмах нашей планеты.
Таблица № 2. Общее количество воды в организме.
Венерин пояс (растение)
Травяная лягушка (головастик)
Т. о. общее количество воды в организме сильно различаются в живой природе и колеблются от 99% до 46%. При этом замечено, что между водным и наземным организмами существуют значительные различия по содержанию воды.
2. Среда обитания. (дем. слайд № 4)
2. В промышленности и быту — хозяйственные нужды. (дем. слайд № 5)
Таблица №3. Расход воды на хозяйственные нужды
— 1т. чугуна и перевод его в сталь.
Запишем в тетрадь. Значение воды для живых организмов.
1. Основная часть всех живых организмов.
2. Среда обитания.
3. Использование воды в промышленности и быту.
Какими свойствами обладает вода? (учащимся предлагается описать физические свойства воды, которая представлена в колбе на предметном столе).
Учитель дополняет: вода — единственное на Земле вещество, встречающееся одновременно в трех агрегатных состояниях: газообразное, твердое, жидкость. Обладает большой теплопроводностью, хороший растворитель, при t=0 0 С замерзает,t кип = 100 0 С.
Запишем в тетрадь.
Физические свойства воды агрегатное состояние: газообразное, твердое, жидкость, большой теплопроводностью, хороший растворитель, при t=0 0 С замерзает,t кип = 100 0 С.
Природная вода никогда не бывает совершенно чистая. Например: морская вода содержит различные химические элементы и их соединения (дем. слайд № 6)
Таблица № 4 «Главные компоненты воды Мирового океана»
Итак, из таблицы видно, что в Мировом океане резко преобладает хлор и натрий, в результате чего образуется всем известная поваренная «соленая» соль – NaCI (хлорид натрия). Издавна люди из морской воды добывали поваренную соль, да и сейчас она дает 25% всей мировой добычи соли.
В настоящее время люди так увлеклись покорением природы, что не заметили, как в реках стало меньше рыбы, а в лесах птиц и зверей. Питьевая вода потеряла свою свежесть, чистоту, стала опасной для употребления из-за насыщенности кислотами, тяжелыми металлами, другими вредными веществами. Сброс сточных вод в поверхностные водные объекты Краснодарского края составил 4775,7 млн. м 3 , из них загрязненных сточных вод — 985,6 млн. м 3 . Из-за ненормативной работы городских очистных сооружений первой и второй очереди в р. Кубань в черте г. Краснодар ежегодно сбрасывается около 100 млн. м 3 недостаточно очищенных сточных вод. Это связано в основном с отсутствием или неэффективной работой локальных очистных сооружений на ряде промышленных предприятий города. Не менее важной причиной является отсутствие сооружений доочистки на самих муниципальных сооружениях. Кроме того, из-за аварийного состояния существующих городских канализационных сетей, а также недостаточного их развития, по ливневой канализации Краснодара в р. Кубань в 2002 г. было сброшено 220 тыс. м 3 сточных вод без очистки. ( http://www.priroda.ru ) (дем. слайд № 7)
Но загрязняющими веществами являются не любое количество, а лишь их избыточное, которое нарушает нормативы количество воды.
ПДК — это официально утверждённая максимальная величина допустимого содержания вредного вещества в воде, т. е. при котором ещё возможно нормально существование организмов и полное осуществление её биологических циклов. Существуют различные ПДК, которые классифицируют по назначению (использованию) воды.
Оценка качественных свойств Н 2 0 определяется по следующим показателям: цветность, прозрачность, мутность, t, запах, количество растворимых примесей, рH (кислотность), жёсткость и др. Эталон качественных свойств питьевой воды (дем. слайд № 8):
Цвет 40 градусов
Прозрачность не менее 30 см
Запах слабый или очень слабый
Жесткость не больше 7,0 мг/экв на литр
Кислотность рН 6,5-8,5
Предлагаю провести небольшое исследование к ачества воды из разных источников (на столах учащихся технологическая карта (приложение № 2) и бланк практической работы (приложение № 3), который заполняется учащимися и оценивается). После выполнения работы учитель собирает бланки оформленной практической работы для оценивания учащихся. Затем предлагает сделать вывод о качестве исследуемой воды, и дать рекомендации по ее использованию.
Вывод: образец под № 2 может использоваться в пищу, но необходимо улучшить свойства: цвет и запах, образец под № 1,3- использовать для с/х нужд.
Заключительное слово учителя.
Опираясь на данные наших исследований и значимости воды в жизни всех живых организмов, необходимо развивать чувства ответственности за природу и заботливо относится к ней. Необходимо рационально использовать воду. Один из примеров рационального использование воды в нашем городе — это очистка канализационных вод.
Хочу закончить следующими словами Сент – Экзюпери, французского писателя, поэта и профессионального летчика:
«Есть такое твёрдое правило: встал поутру, умылся, привёл себя в порядок — и сразу же приведи в порядок свою планету». (дем. слайд № 9)
Источник