- Урок 27. Состав и физические свойства воды
- Состав и строение воды
- Физические свойства воды
- Вода как растворитель
- Вода: строение и свойства
- Физические свойства
- Химические свойства
- Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды
- 1. Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксиду кальция, оксиду серы (IV). Основные загрязнители природной воды
- 2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
- Структура, свойства и биологические функции воды
Урок 27. Состав и физические свойства воды
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Состав и строение воды
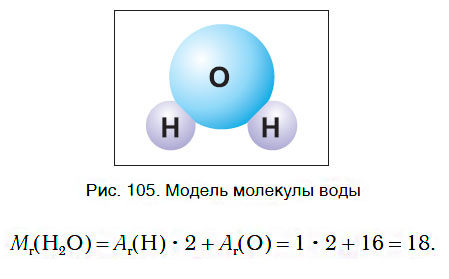
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
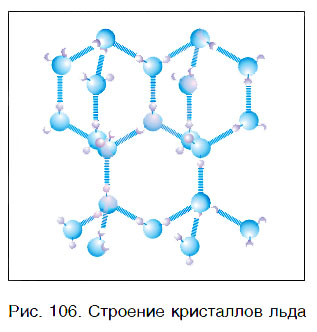
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см 3 , а плотность жидкой воды — примерно 1,00 г/см 3 . Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник
Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды
1. Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксиду кальция, оксиду серы (IV). Основные загрязнители природной воды
Состав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа пропорционален количеству вещества):
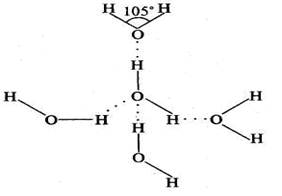
Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Угол между связями около 105°:
O — H
|
H
Поскольку кислород является более электроотрицательным элементом (сильным окислителем), общая электронная пара ковалентной связи смещается к атому кислорода, на нем образуется частичный отрицательный заряд δ−, на атомах водорода — частичный положительный δ+. Соседние молекулы притягиваются друг к другу противоположными зарядами — это обуславливает сравнительно высокую температуру кипения воды.
Вода при комнатной температуре — бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении — 100° С. Чистая вода не проводит электрический ток.
Интересной особенностью воды является то, что она имеет наибольшую плотность 1 г/см 3 при температуре около 4° С . При дальнейшем понижении температуры плотность воды снижается. Поэтому с наступлением зимы верхние замерзающие слои воды становятся легче и не погружаются вниз. Лед образуется на поверхности. Промерзания водоема до дна обычно не происходит (к тому же лед тоже имеет плотность меньше воды и плавает на поверхности).
Химические свойства:
- Вода разлагается при пропускании электрического тока* на водород и кислород:
2H2O = 2H2↑ + O2↑ - Вода взаимодействует с натрием и некоторыми другими активными металлами, которые вытесняют из нее водород, образуется щелочь (гидроксид натрия):
2Na + 2HOH = 2NaOH + H2↑ - Оксид кальция (негашеная известь) бурно взаимодействует с водой (гасится) с выделением большого количества тепла, что может быть даже причиной пожара. Образуется гидроксид кальция (гашеная известь):
CaO + H2O = Ca(OH)2 + Q - Большинство оксидов неметаллов реагируют с водой с образованием кислот. Оксид серы (IV) взаимодействует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
К основным загрязнителям природной воды относятся сточные воды промышленных предприятий, содержащие соединения ртути, мышьяка и других токсичных элементов. Стоки животноводческих комплексов, городов могут содержать отходы, вызывающие бурное развитие бактерий. Большую опасность для природных водоемов представляет неправильное хранение (не обеспечивающее защиту от атмосферных осадков) или применение удобрений и ядохимикатов, смываемых в водоемы. Транспорт, особенно водный, загрязняет водоемы нефтепродуктами и бытовым мусором, выбрасываемым недобросовестными людьми прямо в воду.
Для охраны вод необходимо вводить замкнутое водоснабжение промышленных предприятий, комплексную переработку сырья и отходов, строительство очистных сооружений, экологическое воспитание населения.
* Для электролиза воды используются растворы солей
2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
Качественной реакцией на карбонаты служит взаимодействие с кислотами, сопровождающееся бурным выделением углекислого газа:
или, в ионном виде:
Доказать, что выделяется именно оксид углерода (IV), можно, пропуская его через раствор известковой воды, что вызывает её помутнение:
Чтобы распознать соль угольной кислоты, добавляем во все три пробирки немного кислоты (чтобы не вылилась через край при «вскипании»). Где будет выделяться бесцветный газ без запаха, там находится карбонат.
Источник
Структура, свойства и биологические функции воды



Жизнь на планете Земля зародилась в водной среде. Ни один организм не может обходиться без воды. Несмотря на простоту химического состава и строения, вода является одним из удивительных соединений, обладает уникальными физико-химическими свойствами и биологическими функциями.
Молекула воды (Н2О) — полярное соединение, в котором электрофильный атом кислорода притягивает спаренные электроны от атомов водорода, приобретая частичный отрицательный заряд, в то время как атомы водорода приобретают частично положительные заряды. Важной особенностью воды является способность ее молекул объединяться в структурные агрегаты за счет образования водородных связей между разноименно заряженными атомами. Образующие ассоциаты (рис. 1) состоят из нескольких молекул воды, поэтому формулу воды правильнее было бы записать как (Н2О)л, где п = 2, 3, 4, 5. Водородные связи имеют исключительно важное значение при формировании структур биополимеров, надмолекулярных комплексов, в метаболизме.
Дж. Пиментел и О. Мак-Клеллан считают, что в химии живых систем водородная связь так же важна, как и связь углерод—углерод. Что же такое водородная связь?
Рис. 1. Ассоциат молекул воды (точками обозначены водородные связи)
Водородная связь — это взаимодействие атома водорода с более электроотрицательным атомом, имеющее частично донорно-акцепторный, частично электростатический характер. Любая химическая связь характеризуется энергией ее образования. По энергии водородная связь занимает промежуточное положение между ковалентной (200—400 кДж/моль) и ионной химическими связями и слабыми ван-дер-ваальсовыми взаимодействиями, находясь в пределах 12—30 кДж/моль.
Необычная структура воды обусловливает ее уникальные физико-химические свойства. Все биохимические процессы в организме протекают в водной среде. Вещества, находящиеся в водном растворе, имеют водную оболочку, которая образуется в результате взаимодействия полярных молекул воды с заряженными группами макромолекул или ионов. Чем больше такая оболочка, тем лучше растворимо вещество.
По отношению к воде молекулы или их части делят на гидрофильные (водорастворимые) и гидрофобные (водонерастворимые). Гидрофильными являются все органические и неорганические соединения, диссоциирующие на ионы, биологические мономеры и биополимеры, имеющие полярные группы. К гидрофобным следует отнести соединения, молекулы которых содержат неполярные группы или цепи (триацилглицерины, стероиды и др.). Молекулы некоторых соединений содержат как гидрофильные, так и гидрофобные группы; такие соединения называются амфифильными (от греч. amphy — двоякий). К ним относятся жирные кислоты, фосфолипиды и др. Из вышесказанного следует, что диполи воды способны взаимодействовать не только между собой, но ft с полярными молекулами органических и неорганических веществ, локализованных в клетке организма. Этот процесс получил название гидратации веществ.
Физико-химические свойства воды определяют ее биологические функции:
• Вода является прекрасным растворителем.
• Вода выполняет функцию регулятора теплового баланса организма, так как ее теплоемкость значительно превышает теплоемкость любого биологического вещества. Поэтому вода может долго сохранять тепло при изменении температуры окружающей среды и переносить его на расстояние.
• Вода способствует сохранению внутриклеточного давления и формы клеток (тургор).
• В определенных биохимических процессах вода выступает в качестве субстрата.
Содержание воды в организме человеказависит от возраста: чем моложе человек, тем выше содержание воды. У новорожденных вода составляет 75% от массы тела, у детей от 1 года до 10 лет — 60—65%, а у людей старше 50 лет — 50—55%. Внутри клеток содержится 2/3 общего количества воды, внеклеточная вода составляет 1/3. Необходимое содержание воды в организме человека поддерживается за счет поступления ее извне (примерно 2 л в сутки); около 0,3 л в сутки образуется в процессе распада веществ внутри организма. Нарушение водного баланса в клетках организма приводит к тяжелым последствиям вплоть до гибели клеток. Функции клеток зависят от общего количества внутриклеточной и внеклеточной воды, от водного окружения макромолекул и субклеточных структур. Резкое изменение содержания воды в организме приводит к патологии.
Источник