- Определение технических показателей воды
- Техническая вода
- Содержание статьи
- Определение технической воды
- Состав технической воды
- Характеристики технической воды
- Требования к технической воде
- Применение технической воды
- Хранение технической воды
- Показатели технической воды
- Таблица 1 – Минеральный состав вод
- Таблица 2 – Характеристики водных сред
- Таблица 3 – Окисляемость водных сред
- Таблица 4 – Примеси в водных средах
- Таблица 5 — Нормативы по микробиологическим и паразитологическим показателям
- Таблица 6 — Нормативы по обобщающим показателям и вредным химическим веществам, мг/дм 3
- Таблица 7 — Нормативы по органолептическим показателям
- Статьи по теме
- Водоразбавляемые краски
- Водно-дисперсионная краска
- Акриловая краска и вода
Определение технических показателей воды



Качество воды, используемой для бытовых и технических целей, определяется соответствующими физическими и химическими показателями в зависимости от присутствия тех или иных примесей в воде. Главные химические характеристики воды – жесткость, окисляемость, содержание хлорид-иона, оксида углерода (IV), общее солесодержание.
Анализируют воду по указанным показателям как до очистки, так и после нее.
Цель работы: определить химическую характеристику воды.
Реактивы: раствор соляной кислоты с концентрацией 0,1 моль/л, индикатор – метиловый оранжевый.
Оборудование: конические колбы на 250 мл (2 шт.), бюретка на 25 мл, цилиндр на 100 мл.
1. Жесткость воды.
Соли, присутствующие в воде, вызывают ее жесткость. Различают временную (карбонатную) жесткость, которая обусловлена наличием гидрокарбонатных солей кальция и магния, и постоянную, которая характеризуются присутствием сульфатов, хлоридов и нитратов кальция и магния. Сумма временной и постоянной жесткости дает общую жесткость воды. Жесткость воды в соответствии со стандартом (СЭВ 1052 — 78) выражается в моль/л.
Определение временной жесткости воды.
Временную жесткость воды определяют титрованием пробы исследуемой воды раствором соляной кислоты:
Расчет ведут по формуле:
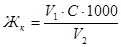
Жк – временная жесткость воды, ммоль/л;
V1 – объем соляной кислоты, затраченный на титрование, мл;
V2 – объем воды, взятый для анализа, мл;
С – концентрация раствора соляной кислоты, моль/л.
Порядок выполнения работы: в коническую колбу отбирают 100 мл анализируемой воды и титруют раствором соляной кислоты с индикатором – метиловым оранжевым до появления розового окрашивания.
Определение жесткости воды.
Общую жесткость воды определяют методом комплексометрического титрования, основанного на образовании прочного соединения трилона Б с ионами кальция и магния. Титрование воды проводят в присутствии индикаторов-хромогенов в слабощелочной среде, которую создают буферным раствором, содержащим NH4OH и NH4Cl (аммиачная смесь).
При этом ионы Са 2+ и Mg 2+ связываются с трилоном Б в комплексное соединение.
Изменение окраски индикатора от красно-фиолетовой до сине-фиолетовой свидетельствует о полном связывании в воде трилоном Б ионов кальция и магния.
Общую жесткость воды рассчитывают по формуле:
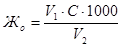
Жо – общая жесткость воды, ммоль/л;
V1 – объем соляной кислоты, затраченный на титрование, мл;
V2 – объем воды, взятый для анализа, мл;
С – концентрация раствора соляной кислоты, моль/л.
Реактивы: раствор трилона Б с концентрацией 0,05 ммоль/л, буферный раствор, индикатор – хромоген синий или черный, сульфид натрия, раствор солянокислого гидроксиламина 1%-ный, раствор ZnCl2 (0,05 моль/л) и сульфата магния (0,25 моль/л).
Оборудование: конические колбы на 250 мл, бюретки на 25 мл, пипетки на 100 мл, цилиндры мерные на 25 мл.
Порядок выполнения работы: в колбу вносят 100 мл анализируемой воды. Затем прибавляют 5 мл буферного раствора, 5-7 капель индикатора и сразу титруют при сильном взбалтывании раствора трилона Б до изменения окраски в эквивалентной точке.
Если на титрование израсходовано больше 10 мл раствора трилона Б, то это указывает, что в отмеренном объеме воды суммарное содержание ионов Са 2+ и Mg 2+ больше 5 ммоль/л. В таких случаях определение следует проводить, взяв меньший объем воды и разбавить его до 100 мл дистиллированной водой.
2. Окисляемость воды.
Окисляемость воды обуславливается присутствием в воде органических примесей. Под окисляемостью воды понимают массу кислорода в миллиграммах, идущую на окисление органических веществ, растворенных в 1 л воды при определенных условиях.
Определение окисляемости воды.
Окисляемость воды определяют методом перманганатометрии. При этом окисляются только легко окисляющиеся органические примеси. Для получения более точных результатов используют обратное титрование избытка перманганата калия. К прокипяченной пробе прибавляют избыток щавелевой кислоты, при этом часть ее окисляется оставшимся перманганатом калия, а остальное количество щавелевой кислоты оттитровывают перманганатом калия.

Реактивы: раствор перманганата калия 0,002 моль/л, щавелевой кислоты 0,005 моль/л, серной кислоты
Оборудование: колбы конические на 250 мл (2 шт.), бюретки градуированные (2 шт.).
Порядок выполнения работы: в коническую колбу отмеривают пипеткой 100 мл дистиллированной или отстоянной водопроводной воды, прибавляют 5 мл серной кислоты и 10 мл перманганата калия. Пробу закрывают воронкой, смесь кипятят 10 мин, считая с момента закипания. Чтобы не было бурного кипения, в колбу помещают стеклянные капилляры. К горячей окрашенной жидкости прибавляют 10 мл раствора щавелевой кислоты и перемешивают. Горячий обесцвеченный раствор титруют раствором перманганата калия до появления слаборозового окрашивания, не исчезающего 2-3 минуты.
Если при титровании после ведения в исследуемую воду щавелевой кислоты расход перманганата калия будет более 5 мл, анализ следует повторить с предварительным разбавлением исследуемой воды. При этом необходимо определить окисляемость дистиллированной воды, а также учесть кратность разбавления. Окисляемость воды (в пересчете на кислород) рассчитывают по формуле:
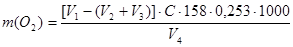
V1 – общий объем раствора перманганата калия, добавленного в пробу, мл;
V2 – объем раствора перманганата калия, идущий на окисление органических веществ в воде, добавленный в пробу для разбавления исследуемой воды, мл;
V3 – объем перманганата калия, идущего на окисление 10 мл щавелевой кислоты, мл;
V4 – объем исследуемой воды, мл;
С – концентрация перманганата калия, моль/л;
158 – молярная масса KMnO4, г/моль;
0,253 – коэффициент пересчета окисляемости воды на кислород.
Пример расчета. Исследуемая вода разбавлена в 10 раз (1 объем исследуемой воды и 9 объемов дистиллированной воды), окисляемость полученной смеси, вычисленная по приведенной формуле, составляет 8,4 мг/л О2.Окисляемость дистиллированной воды равна 0,4 мг/л О2. Следовательно, окисляемость исследуемой воды составляет:
8,4 – 0,4∙0,9 = 8,04 мг/л О2
3.Определение хлорид-иона в воде.
Определение проводят в водопроводной отстоянной воде.
Метод основан на осаждении хлорид-иона в нейтральной или слабощелочной среде нитратом серебра в присутствии дихромата калия в качестве индикатора. Изменение окраски индикатора от лимонно-желтой до оранжево-желтой свидетельствует о выделении хлорида серебра и образовании хромата серебра. Содержание хлорид-ионов вычисляют по формуле:
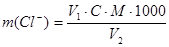
V1 – объем 0,02 молярного нитрата серебра, израсходованного на титрование, мл;
V2 – объем воды взятой на анализ, мл;
С – концентрация раствора нитрата серебра, моль/л;
М – молярная масса хлорид-иона, г/моль.
Реактивы: 0,02 молярный AgNО3, индикатор – дихромат калия.
Оборудование: конические колбы на 250 мл (2 шт), бюретка на 25 мл.
Порядок выполнения работы: в две колбы отмеривают по 100 мл исследуемой воды, рН которой должен быть в пределах 6-10. В пробы добавляют по 1 мл раствора дихромата калия и титруют раствором нитрата серебра до появления оранжево-желтого оттенка.
4. Определение содержания диоксида углерода.
Определение проводят в водопроводной отстоянной воде.
Содержание диоксида углерода рассчитывают по формуле:

V – объем раствора гидроксида натрия, израсходованного на титрование пробы, мл;
V1 – объем воды, взятой на анализ, мл;
С – концентрация гидроксида натрия, моль/л;
М – молярная масса СО2 г/моль.
Реактивы: 0,1 молярный раствор гидроксида натрия; индикатор – 1%-ный раствор фенолфталеина.
Оборудование: коническая колба на 250 мл, бюретка на 25 мл.
Порядок выполнения работы: в коническую колбу отмеривают 250 мл исследуемой воды, прибавляют 0,2 мл фенолфталеина и перемешивают. Сравнивают полученную окраску с контрольным раствором. Если она более интенсивна, то вода содержит СО2. Если вода не окрасилась или окраска слабее эталона, то раствор титруют 0,1 молярным раствором NaOH до окраски контрольного раствора.
5. Определение содержания сульфидов воде.
Определение проводят в негазированной минеральной воде.
В этом методе сульфид-ионы осаждают в виде сульфида цинка или сульфида кадмия, отфильтровывают и промывают. Содержание сульфид-ионов в осадке находят йодометрическим методом. Содержание сульфид-ионов рассчитывают по формуле:
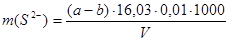
а – объем прибавленного раствора йода, мл;
b – объем раствора Na2S2О3, израсходованного на титрование избытка I2, мл;
16,03 – эквивалент иона;
0,01 – нормальность титрующих растворов;
Реактивы: суспензия карбоната кадмия или карбоната цинка; отдельно готовят 10 мл растворов сульфатов цинка или кадмия и 10 мл карбоната натрия (перед применением быстро смешивают эти растворы); соляная кислота – 1:9; 0,1 нормальные растворы Na2S2О3 и йода; 0,5%-ный раствор крахмала.
Оборудование: коническая колба на 250 мл, мерная колба на 200 мл, химический стакан, воронка, фильтры, стеклянная палочка, бюретка на 25 мл.
Ход определения: в коническую колбу емкостью 250 мл наливают 25-50 мл пробы, смесь разбавляют приблизительно до 150 мл дистиллированной водой. Затем прибавляют 20 мл суспензии, хорошо перемешивают и фильтруют. Осадок промывают горячей водой. Фильтр с осадком помещают в коническую колбу емкостью 250 мл, прибавляют 25-50 мл раствора йода и подкисляют жидкость 5 мл соляной кислоты. Фильтр измельчают стеклянной палочкой и оттитровывают избыток йода раствором Na2S2О3 в присутствии крахмала.
6. Определение сухого остатка (солесодержание).
Сухой остаток – это масса остатка, получаемого выпариванием профильтрованной пробы сточной воды и высушиванием при 103-105 °С или 178-182 °С. Величина эта должна выражать суммарное количество растворенных в пробе органических и неорганических веществ.
Если остаток высушивается при 103-105 °С, то в нем сохранится вся или почти вся кристаллизационная вода солей, образующих кристаллогидраты.
Если остаток высушивается при 178-182 °С, то вода будет удалена полностью, но некоторое количество кристаллизационной воды может остаться, особенно когда в пробе присутствуют преимущественно сульфаты. Гидрокарбонаты превратятся в карбонаты, но последние могут частично разложиться с образованием оксидов или оксосолей. Может произойти частичная потеря нитратов. Органические вещества теряются в большей мере, чем неорганические.
Оборудование: стакан или колба, воронка, фильтры, фарфоровая чашка, мерная колба на 50-100 мл, щипцы, электроплитка, водяная баня, сушильный шкаф.
Порядок выполнения работы: в прокаленную, охлажденную и взвешенную фарфоровую чашку помещают 50-250 мл анализируемой воды, предварительно профильтрованной. Воду выпаривают на электроплитке досуха, затем переносят в сушильный шкаф и высушивают при 103-105 °С или 178-182 °С до постоянной массы.
Содержание сухого остатка в мг/л рассчитывают по формуле:
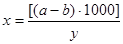
Источник
Техническая вода
Содержание статьи
Вода необходима всем живым существам для нормальной жизнедеятельности. Она применяется не только для питья, но и для многих других целей. Ее используют в промышленности при производстве разного рода продукции.
Определение технической воды
В современной промышленности при производстве фармацевтических препаратов и многих других видов продукции используется техническая вода. Она представляет собой воду, которую добывают из различных источников. Она перед использованием тщательным образом кондиционируется. Ее добыча осуществляется в речках, источника и во многих других типах водоемов.
В современном мире у предприятий, которые производят изделия на основе технической воды, имеются свои ресурсы водоснабжения. Они позволяют получать воду, которая соответствует всем требованиям той или иной организации. Ее применение обусловлено спецификой продукции, которую поставляет производственное предприятие.
Состав технической воды
Состав технической воды представляет собой совокупность определенных видов солей и минералов. Они содержатся в жидкости, взятой из разных источниках в определенных количествах.

- Железо
- Нитриты и нитраты
- Сульфаты и хлориды
- Фториды
- Аммиак
- Углекислота
- Сероводород
- Кислород в растворенном виде
На производственных предприятиях вода технического вида проходит тщательную проверку, чтобы она соответствовала всем требованиям. Ее очищают от посторонних примесей. Степень очистки зависит от того, для какой цели используется данный вид жидкости. На многих производственных предприятиях очистка проводится не тщательным образом, потому что в этом нет необходимости.
На производстве практически не используется питьевая вода. Это не выгодно самим компаниям. Целесообразней использовать техническую воду. Отличия: вода питьевая и техническая имеются в составе. В питьевой воде содержится меньшее количество солей и примесей. К тому же у них разные характеристики.
Характеристики технической воды
Техническая вода применяется на производственных предприятиях достаточно часто. Она имеет определенные свойства.
Техническая вода характеристики имеет следующие:
На производственных предприятиях в зависимости от типа производства используется либо горячая вода, либо холодная. Ее температурные особенности определяются в индивидуальном порядке.
У технической воды практически не бывает никакого запаха. Если он имеется, значит это может повлиять не лучшим образом на качество выпускаемой предприятием продукции.
В воде имеются вещества, вес которых можно измерить благодаря специализированному оборудованию. Существуют определенные нормы, которые определяют их оптимальное количество.
У технической воды должен иметь лишь небольшой оттенок, который не может повлиять на цвет конечного продукта, изготовленного на основе данной жидкости. если вода обладает интенсивным цветом, то ее не используют на производственных предприятиях.

В технической воде обычно имеется сухой остаток, который практически не растворяется. Его уровень должен быть очень низким. Если он высокий, то такую воду не использую для проведения работ.
Данная характеристика играет важную роль. Она позволяет предприятиям использовать либо мягкую воду, либо жесткую.
Средний уровень ph технической воды составляет 5.5
Требования к технической воде
К технической воде на предприятиях предъявляется большое количество требований. Для производства определенных видов продукции необходимо использовать разные по жесткости или составу жидкости. От этих показателей зависит качество и свойства окончательного продукта.
Требования к технической воде являются разными. Они определяются самими предприятиями.
В промышленности осуществляется очистка промышленной воды. Она заключается в том, чтобы вода приобрела те свойства, которые необходимы для создания того или иного продукта. Для этой цели используются промышленные фильтры, которые обладают особой структурой и принципом действия.
Применение технической воды
Использование технической воды присуще многим современным промышленным предприятиям. Она используется в тех случаях, когда не представляется возможным применение питьевой очищенной воды. В настоящее время техническая вода применяется в производстве медицинских препаратов. Кроме этого ее использую т и на многих объектах, где необходимо осуществлять мойку различных объектов. Она активно используется на автомойках.
Есть два метода применения данного вида воды:
Вода технического типа нашла широкое распространение на предприятиях, которые занимаются производством на ее основе различных средств для лечения и красоты, которыми сегодня пользуется каждый человек.
- в качестве одного из элементов технологического процесса
В данной роли вода выступает в качестве промывочного материала в различных видах систем. Также она может быть частью процесса охлаждения.
Хранение технической воды
Хранение технической воды должно быть правильным, чтобы она могла быть пригодной для использования в нужных целях. Ее хранят на производственных предприятиях в специальных тарах. При комнатной температуре она может сохранять свои качества длительный промежуток времени.
Показатели технической воды
Таблица 1 – Минеральный состав вод
| Среда | pH | Сухой остаток, мг/дм 3 | |||
|---|---|---|---|---|---|
| Сильнокислая | ≤ 4,5 | Малая | 9 | Очень высокая | 2000 — 8000 |
Таблица 2 – Характеристики водных сред
| Характеристика воды | Жесткость, мг-экв/дм 3 | Прозрачность | По шрифту Снеллена | Содержание взвеси, мг/дм 2 | ||
|---|---|---|---|---|---|---|
| Очень мягкая | ≤ 1,5 | Прозрачная | > 30 | 10 | Очень мутная | 300 |
Таблица 3 – Окисляемость водных сред
| Характеристика окисляемости (цветности) | Перманганатная окисляемость, мг/дм 3 O2 | Цветность, град Pt-Co шкалы |
|---|---|---|
| Очень малая | ≤ 2,5 | ≤ 25 |
| Малая | 2,5 — 6 | 25 — 50 |
| Средняя | 6 — 12 | 50 — 80 |
| Высокая | 12 — 20 | 80 — 120 |
| Очень высокая | > 20 | > 120 |
Таблица 4 – Примеси в водных средах
| Фазово-дисперсная группа | Характер примесей | Размер частиц, см | Структурные системы |
|---|---|---|---|
| I Взвеси | Суспензии, эмульсии, микроорганизмы | 10 -2 — 10 -5 | Гетерогенные |
| II Коллоидные растворы | Коллоиды, высокомолекулярные | 10 -5 — 10 -6 | Гетерогенные |
| III Молекулярные соединения | Газы, растворимые в воде; органические вещества, придающие запах и привкус | 10 -6 — 10 -7 | Гомогенные |
| IV Ионные растворы | Соли, кислоты, основания | 10 -7 — 10 -8 | Гомогенные |
Таблица 5 — Нормативы по микробиологическим и паразитологическим показателям
| Показатели | Единицы измерения | Нормативы |
|---|---|---|
| Термотолерантные колиформные бактерии | Число бактерий в 100 см 3 | Отсутствие |
| Общие колиформные бактерии | Число бактерий в 100 см 3 | Отсутствие |
| Общее микробное число | Число образующих колонии бактерий в 1 см 3 | Не более 50 |
| Колифаги | Число бляшкообразущих единиц в 100 см 3 | Отсутствие |
| Споры сульфитредуцирующих Клостридий | Число спор в 20 см 3 | Отсутствие |
| Цисты лямблий | Число цист в 50 см 3 | Отсутствие |
Таблица 6 — Нормативы по обобщающим показателям и вредным химическим веществам, мг/дм 3
| Показатель | Нормативы (ПДК), не более | Показатель | Нормативы (ПДК), не более |
|---|---|---|---|
| 1 | 2 | 1 | 2 |
| Обобщенные показатели | Мышьяк (As, суммарно) | 0,05 | |
| Реакция среды | 6 — 9 ед. рН | Никель (Ni, суммарно) | 0,1 |
| Общая минерализация (сухой остаток) | 1000 | Нитраты (по N03 — ) | 45 |
| Жесткость общая | 7 мг-экв/дм 3 | Ртуть (Hg, суммарно) | 0,0005 |
| Окисляемость перманганатная | 5 мг-экв/дм 3 | Свинец (РЬ, суммарно) | 0,03 |
| Нефтепродукты (суммарно) | 1 | Селен (Se, суммарно) | 0,01 |
| Поверхностно-активные вещества (ПАВ) | 0,5 | Стронций (Sr 2+ ) | 7 |
| Фенольный индекс | 0,25 | Сульфаты (SO4 2 — ) | 500 |
| Неорганические вещества | Фториды (F) для климатических районов: | ||
| I и II | 1,5 | ||
| III | 1,2 | ||
| Алюминий (Al 3+ ) | 0,5 | Хлориды (Сl — ) | 350 |
| Барий (Ва 2+ ) | 0,1 | Хром (Сr 6+ ) | 0,05 |
| Бериллий (Ве 2+ ) | 0,0002 | Цианиды (CN — ) | 0,035 |
| Бор (В, суммарно) | 0,5 | Цинк (Zn 2+ ) | 5 |
| Железо (Fe, суммарно) | 0,3 | Органические вещества | |
| Кадмий (Cd, суммарно) | 0,001 | γ-ГХЦГ(линдан) | |
| Марганец (Mn, суммарно) | 0,1 | ДДТ (сумма изомеров) | 0,002 |
| Медь (Cu, суммарно) | 1,0 | 2,4-Д | 0,03 |
| Молибден (Mo, суммарно) | 0,25 | ||
Таблица 7 — Нормативы по органолептическим показателям
| Показатель | Единицы измерения | Нормативы, не более |
|---|---|---|
| Запах | Баллы | 2 |
| Привкус | Баллы | 2 |
| Цветность | Градусы Pt-Co шкалы | 20 |
| Мутность | мг/дм 3 (по каолину) | 1,5 |
Статьи по теме
Водоразбавляемые краски
Водоразбавляемые краски относятся к числу наиболее экологически благоприятных, высококачественных, экономичных, а потому наиболее распространенных строительных красок.
Водно-дисперсионная краска
Водно-дисперсионные краски (или водорастворимые, или латексные, как их иногда называют) относятся к числу наиболее экономичных и удобных в нанесении продуктов.
Акриловая краска и вода
Водно-дисперсионные лакокрасочные материалы (ЛКМ) очень удобны в применении, не содержат органических растворителей, из-за чего практически не имеют запаха и считаются экологически чистыми, а также пожаровзрывобезопасными.
Источник