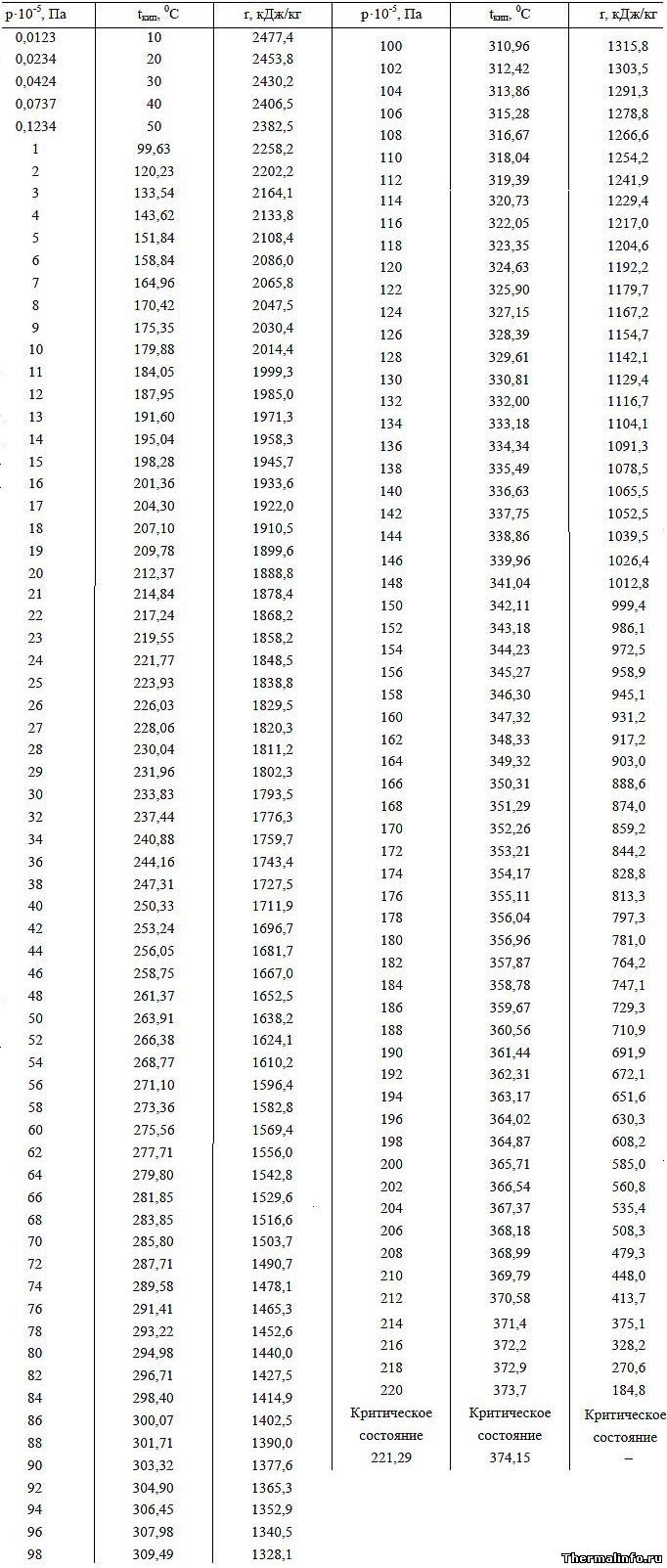
Теплота парообразования воды и температура кипения воды в зависимости от давления

Значения удельной теплоты парообразования воды (теплоты испарения воды) и зависимость температуры кипения воды от давления приведены в таблице для диапазона давления от 0,0121 до 218,4 атм. (0,0123·10 5 …221,29·10 5 Па).
По данным таблицы видно, что имеет место обратная зависимость удельной теплоты парообразования воды в зависимости от давления: при увеличении давления значение удельной теплоты парообразования воды снижается.
Температура кипения воды в зависимости от давления изменяется следующим образом: при росте давления температура кипения воды увеличивается и достигает в критическом состоянии максимального значения 374,15°С при давлении 218,4 атмосфер.
При нормальном атмосферном давлении удельная теплота парообразования воды равна 2258 кДж/кг, а температура кипения воды составляет 100°С. При увеличении давления, например до 100 атм., величина теплоты парообразования воды снижается до 1315 кДж/кг.
По данным таблицы, с учетом зависимости температуры кипения воды от давления, для осуществления кипения при 100 атм. необходимо нагреть воду до температуры 311°С.
Ривкин С.Л., Александров А.А. Теплофизические свойства воды и водяного пара. М.: Энергия, 1980. – 424 с.
Источник
Удельная теплоемкость воды H2O
Приведены таблицы значений удельной теплоемкости воды H2O и водяного пара в зависимости от температуры и давления. В первой таблице дана удельная теплоемкость воды в жидком состоянии при нормальном атмосферном давлении и температуре от 0,1 до 100°С.
Во второй таблице значения теплоемкости указаны в интервале температуры от 0 до 800°С и давлении от 0,1 до 100 бар. Вода в этих условиях может находится в жидком или газообразном состоянии, поскольку с понижением давления и (или) с ростом температуры она переходит в пар.
Жидкая вода обладает значительной величиной массовой удельной теплоемкости, по сравнению с другими жидкостями. При атмосферном давлении и температуре до 100°С она находится в виде жидкости и ее теплоемкость изменяется в диапазоне от 4174 до 4220 Дж/(кг·град).
При температуре 20 градусов Цельсия и нормальном атмосферном давлении удельная теплоемкость воды равна 4183 Дж/(кг·град). При температуре 100°С эта величина достигает значения 4220 Дж/(кг·град).
Изменение давления и температуры воды существенно влияет на ее удельную теплоемкость. Зависимость теплоемкости воды от температуры при атмосферном давлении не линейна. При нагревании воды до 30°С теплоемкость уменьшается, затем в интервале температуры 30…40°С значение этой величины остается практически постоянным (следует отметить, что в этом диапазоне температуры вода обладает наименьшей теплоемкостью). При температуре выше 40°С ее удельная теплоемкость увеличивается и достигает своего максимума при температуре кипения.
| t, °С | 0,1 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
|---|---|---|---|---|---|---|---|---|---|---|
| Cp, Дж/(кг·град) | 4217 | 4191 | 4187 | 4183 | 4179 | 4174 | 4174 | 4174 | 4177 | 4181 |
| t, °С | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 |
| Cp, Дж/(кг·град) | 4182 | 4182 | 4185 | 4187 | 4191 | 4195 | 4202 | 4208 | 4214 | 4220 |
Если продолжить нагрев воды до перехода ее в пар, то тогда, при дальнейшем нагреве пара при атмосферном давлении, величина теплоемкости будет снижаться до некоторого предела, а затем снова начнет увеличиваться. Эта точка перегиба кривой теплоемкости определяется значениями соответствующих температуры и давления.
Как видно по данным в таблице, с повышением давления удельная теплоемкость воды уменьшается, но увеличивается также и температура кипения воды, например, при давлении в 100 бар (атмосфер) она находится в жидком состоянии даже при температуре 300°С. Удельная теплоемкость воды при этом составляет величину 5700 Дж/(кг·град). При продолжении нагрева воды, например до 320°С, она переходит в пар, который имеет большую теплоемкость.
Однако, при низких давлениях, вода начинает кипеть и переходит в пар при температурах гораздо ниже 100°С. Например, по данным таблицы, при давлении 0,1 бар и температуре 50°С, вода уже находится в виде водяного пара и его теплоемкость при этих условиях составляет величину, равную 1929 Дж/(кг·град).
| ↓ t, °С | P, бар → | 0,1 | 1 | 10 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|
| 0 | 4218 | 4217 | 4212 | 4207 | 4196 | 4186 | 4176 | 4165 |
| 50 | 1929 | 4181 | 4179 | 4176 | 4172 | 4167 | 4163 | 4158 |
| 100 | 1910 | 2038 | 4214 | 4211 | 4207 | 4202 | 4198 | 4194 |
| 120 | 1913 | 2007 | 4243 | 4240 | 4235 | 4230 | 4226 | 4221 |
| 140 | 1918 | 1984 | 4283 | 4280 | 4275 | 4269 | 4263 | 4258 |
| 160 | 1926 | 1977 | 4337 | 4334 | 4327 | 4320 | 4313 | 4307 |
| 180 | 1933 | 1974 | 2613 | 4403 | 4395 | 4386 | 4378 | 4370 |
| 200 | 1944 | 1975 | 2433 | 4494 | 4483 | 4472 | 4461 | 4450 |
| 220 | 1954 | 1979 | 2316 | 2939 | 4601 | 4586 | 4571 | 4557 |
| 240 | 1964 | 1985 | 2242 | 2674 | 4763 | 4741 | 4720 | 4700 |
| 260 | 1976 | 1993 | 2194 | 2505 | 3582 | 4964 | 4932 | 4902 |
| 280 | 1987 | 2001 | 2163 | 2395 | 3116 | 4514 | 5250 | 5200 |
| 300 | 1999 | 2010 | 2141 | 2321 | 2834 | 3679 | 5310 | 5700 |
| 320 | 2011 | 2021 | 2126 | 2268 | 2649 | 3217 | 4118 | 5790 |
| 340 | 2024 | 2032 | 2122 | 2239 | 2536 | 2943 | 3526 | 4412 |
| 350 | 2030 | 2038 | 2125 | 2235 | 2504 | 2861 | 3350 | 4043 |
| 360 | 2037 | 2044 | 2127 | 2231 | 2478 | 2793 | 3216 | 3769 |
| 365 | 2040 | 2048 | 2128 | 2227 | 2462 | 2759 | 3134 | 3655 |
| 370 | 2043 | 2050 | 2128 | 2222 | 2446 | 2725 | 3072 | 3546 |
| 375 | 2046 | 2053 | 2127 | 2218 | 2428 | 2690 | 3018 | 3446 |
| 380 | 2049 | 2056 | 2127 | 2212 | 2412 | 2657 | 2964 | 3356 |
| 385 | 2052 | 2059 | 2126 | 2207 | 2396 | 2627 | 2913 | 3274 |
| 390 | 2056 | 2061 | 2125 | 2202 | 2381 | 2600 | 2867 | 3201 |
| 395 | 2059 | 2065 | 2125 | 2200 | 2369 | 2575 | 2826 | 3137 |
| 400 | 2062 | 2068 | 2126 | 2197 | 2358 | 2553 | 2789 | 3078 |
| 405 | 2066 | 2071 | 2127 | 2195 | 2349 | 2534 | 2756 | 3025 |
| 410 | 2069 | 2074 | 2128 | 2193 | 2340 | 2517 | 2727 | 2979 |
| 415 | 2072 | 2077 | 2129 | 2192 | 2334 | 2501 | 2700 | 2936 |
| 420 | 2076 | 2080 | 2131 | 2192 | 2327 | 2487 | 2675 | 2898 |
| 425 | 2079 | 2083 | 2132 | 2190 | 2321 | 2474 | 2653 | 2863 |
| 430 | 2082 | 2086 | 2134 | 2190 | 2316 | 2462 | 2632 | 2830 |
| 440 | 2089 | 2093 | 2138 | 2190 | 2307 | 2441 | 2596 | 2773 |
| 450 | 2095 | 2099 | 2141 | 2191 | 2300 | 2424 | 2565 | 2726 |
| 460 | 2102 | 2106 | 2146 | 2192 | 2294 | 2409 | 2538 | 2684 |
| 480 | 2116 | 2119 | 2154 | 2196 | 2286 | 2385 | 2496 | 2618 |
| 500 | 2129 | 2132 | 2164 | 2201 | 2281 | 2368 | 2464 | 2569 |
| 520 | 2142 | 2146 | 2175 | 2208 | 2280 | 2357 | 2441 | 2531 |
| 540 | 2156 | 2159 | 2185 | 2216 | 2280 | 2349 | 2423 | 2502 |
| 560 | 2170 | 2173 | 2197 | 2226 | 2285 | 2349 | 2416 | 2487 |
| 580 | 2184 | 2187 | 2208 | 2233 | 2285 | 2342 | 2401 | 2465 |
| 600 | 2198 | 2200 | 2219 | 2240 | 2287 | 2336 | 2389 | 2445 |
| 620 | 2212 | 2213 | 2230 | 2250 | 2291 | 2334 | 2381 | 2431 |
| 640 | 2226 | 2227 | 2243 | 2260 | 2298 | 2337 | 2379 | 2423 |
| 660 | 2240 | 2241 | 2256 | 2272 | 2307 | 2343 | 2381 | 2421 |
| 680 | 2254 | 2255 | 2270 | 2286 | 2317 | 2352 | 2388 | 2424 |
| 700 | 2268 | 2270 | 2283 | 2299 | 2330 | 2362 | 2398 | 2429 |
| 800 | 2339 | 2341 | 2352 | 2364 | 2389 | 2414 | 2440 | 2465 |
Примечание: В таблице синим цветом показаны значения удельной массовой теплоемкости воды в жидком состоянии, а черным – значения теплоемкости водяного пара.
Источник
Гидрология
Лекция. Химические и физические свойства природных вод
1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
Вода — это простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом. По своей химической природе—это оксид (окись) водорода Н2О. В чистом виде вода — вещество бесцветное, не имеющее ни вкуса, ни запаха.
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине.
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд.
Оба атома водорода , лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды— величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т. е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде.
При повышении температуры наряду с упомянутым уплотнением «упаковки» молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения воды, при температуре выше 4°С — тепловое расширение , поэтому вода обладает «аномальным» свойством — наибольшей плотностью не при температуре плавления, а при 4°С.
Водород и кислород имеют несколько природных изотопов:
1 Н — «обычный» водород),
2 Н — «тяжелый» водород, или дейтерий),
3 Н — радиоактивный «сверхтяжелый» водород, или тритий).
16 О, 17 О, 18 О. Поэтому и сама вода имеет переменный изотопный состав.
Природная вода — это смесь вод разного изотопногосостава.
Наиболее распространена вода, состоящая из изотопов 1 Н и 16 О – «обычная» вода, доля других изотопных видов воды ничтожна — менее 0,27 %. Приведенные в дальнейшем сведения относятся только к «обычной» воде.
Одна из главных причин, приводящих к различию изотопного состава природных вод,— процесс испарения.
В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, а в результате конденсации — более легкими.
Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат «тяжелого» водорода ( 3 Н) и «тяжелого» кислорода ( 18 О) меньше, чем океанические воды.
Воду с изотопным составом ‘Н2 16 О называют «обычной» водой и обозначают просто Н2О, остальные виды воды (кроме 3 Н2О) называют «тяжелой» водой. Иногда «тяжелой» водой считают лишь дейтериевую воду 2 Н2О (или О2О). Вода с изотопным составом 3 Н2О (или Т2О) — так называемая «сверхтяжелая» вода. Ее на Земле находится всего 13—20 кг.
Источник




