- Взаимодействие углекислого газа с веществами и его химические свойства
- Взаимодействие с другими веществами:
- Заключение
- Углекислый газ: характеристики и применение
- Что такое углекислый газ
- Свойства углекислого газа
- Углекислый газ: получение в промышленности
- Применение углекислого газа
- Углекислый газ: хранение и транспортировка
Взаимодействие углекислого газа с веществами и его химические свойства
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода ↔ угольная кислота

2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония

Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Этан + кислород = двуокись углерода + вода + энергия
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода

Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород

Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Спасибо, что указали на ошибку. Исправили.
Скажите пожалуйста На производстве углекислоты мы заменили на комрессорном агрегате старый охладитель углекислого газа с трубками из нержавейки на новый, с латунными трубками. То есть в начале этих трубок охладителя Углекислый газ будет под давлением 16 бар и температурой 130 градусов, на выходе + 10 градусов, всё это с выделением конденсата. Не будет ли какой-то непредвиденной реакции в зоне взаимодействия уг. газа, латуни и воды? Охладитель работает хорошо, но не разрушаться ли трубки от коррозии?
Необходимо определиться для начала, откуда поступает к вам углекислый газ, какие еще газы поступают вместе с углекислым газом в охладитель. У нас, в энергетическом производстве, на определенном участке пароводяного тракта установлены латунные трубки, в которых происходит нагрев теплоносителя. Мы производим замеры растворенного кислорода в конденсате перед подачей его на подогреватели с трубками из латуни. В нашем случае большая концентрация кислорода в воде, при нагревании последней, приводит к коррозии латунных трубок.
Здравствуйте Вячеслав. Углекислый газ поступает с брожения пивного сусла. Углекислый газ (у.г.) сжимается компрессором и при t 130* подаётся на теплообменник (т.о.). хладоносителем t -4*. На латунных стенках т.о. образуется конденсат который отделяется от у.г. в конденсатоотводчике. Содержание кислорода в конденсате не должно быть большим, если вообще не минимальное. После установки нового т.о. конденсатоотводчик стал забиваться непонятной серой массой похожей на мокрый графит. Компрессор разбирали — проблема не в нём (думали одно из графитовых колец размолотило). Разбирать и осматривать т.о. более трудоёмкий процесс.
Затрудняюсь вам ответить на этот вопрос, надо изучать состав газа на входе в теплообменник. Возможно образование угольной кислоты в теплообменнике. А при наличии кислорода кислота может вызывать коррозию, но это не точно.
Источник
Углекислый газ: характеристики и применение
Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
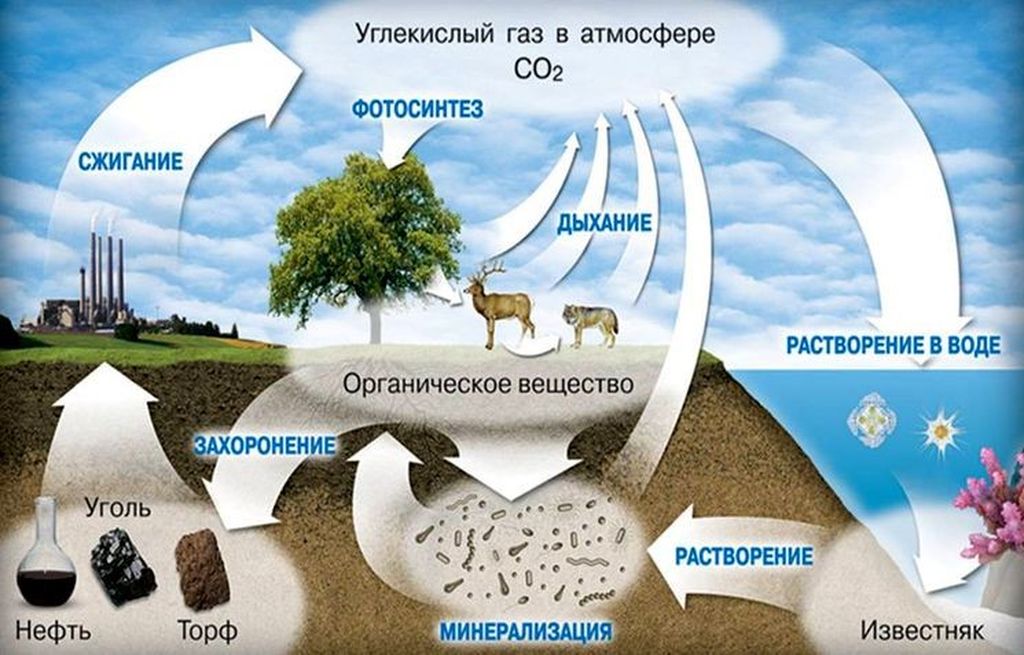
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей. При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности

Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Источник












