- Вода как растворитель
- Процесс растворения
- Универсальный растворитель – определение и характеристики
- Универсальное определение растворителя
- Характеристики универсального растворителя
- полярность
- Высокая удельная теплоемкость
- Уникальные свойства плотности и температуры
- викторина
- Что такое универсальный растворитель?
- Что такое растворитель?
- Почему вода считается универсальным растворителем?
Вода как растворитель

Вследствие своих аномальных свойств вода уникальный растворитель, прекрасно приспособленный для жизнедеятельности.

Другой многочисленный класс веществ, хорошо растворимых в воде, включает такие полярные органические соединения, как сахара, альдегиды, кетоны, спирты. Их растворимость в воде объясняется склонностью молекул воды к образованию полярных связей с полярными функциональными группами этих веществ, например с гидроксильными группами спиртов и сахаров или с атомом кислорода карбонильной группы альдегидов и кетонов. Ниже приведены примеры водородных связей, важных для растворимости веществ в биологических системах. Вследствие высокой полярности вода вызывает гидролиз веществ.
Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Необходимо отметить, что вода является конечным продуктом биологического окисления веществ, в частности глюкозы. Образование воды в результате этих процессов сопровождается выделением большого количества энергии приблизительно 29 кДж/моль.
Важны и другие аномальные свойства воды: высокое поверхностное натяжение, низкая вязкость, высокие температуры плавления и кипения и более высокая плотность в жидком состоянии, чем в твердом.
Для воды характерно наличие ассоциатов групп молекул, соединенных водородными связями.
В зависимости от сродства к воде функциональные группы растворяемых частиц подразделяются на гидрофильные (притягивающие воду), легко сольватируемые водой, гидрофобные (отталкивающие воду) и дифильные.
К гидрофильным группам относятся полярные функциональные группы: гидроксильная —ОН, амино —NH2 , тиольная —SH, карбоксильная —СООН.
К гидрофобным — неполярные группы, например углеводородные радикалы: СНз—(СН2)п —, С6Н5 —.
К дифильным относят вещества (аминокислоты, белки), молекулы которых содержат как гидрофильные группы (—ОН, —NH2 , —SH, —СООН), так и гидрофобные группы: (СН3, (СН2)п ,—С6Н5—).
При растворении дифильных веществ происходит изменение структуры воды как результат взаимодействия с гидрофобными группами. Степень упорядочения молекул воды, близко расположенных к гидрофобным группам, увеличивается, и контакт молекул воды с гидрофобными группами сводится к минимуму. Гидрофобные группы, ассоциируясь, выталкивают молекулы воды из области своего расположения.
Процесс растворения
Природа процесса растворения сложна. Естественно, возникает вопрос, почему некоторые вещества легко растворяются в одних растворителях и плохо растворимы или практически нерастворимы в других.

Великий русский химик Д. И. Менделеев (1834—1907) считал, что важную роль при растворении играют химические процессы. Он доказал существование гидратов серной кислоты H2SО4*H2O, H2SО4*2H2O, H2SО4*4H2О и некоторых других веществ, например, С2Н5ОН*3Н2О. В этих случаях растворение сопровождается образованием химических связей частиц растворяемого вещества и растворителя. Этот процесс называется сольватацией, в частном случае, когда растворителем является вода, гидратацией.
Как установлено, в зависимости от природы растворенного вещества сольваты (гидраты) могут образовываться в результате физических взаимодействий: иондипольного взаимодействия (например, при растворении веществ с ионной структурой (NaCI и др.); дипольдипольного взаимодействия при растворении веществ с молекулярной структурой (органические вещества)).
Химические взаимодействия осуществляются за счет донорноакцепторных связей. Здесь ионы растворенного вещества являются акцепторами электронов, а растворители (Н2О, NН3) донорами электронов (например, образование аквакомплексов), а также в результате образования водородных связей (например, растворение спирта в воде).

Например, при растворении гидроксида калия в воде выделяется теплота:
А при растворении хлорида натрия теплота поглощается:
Теплота, выделяемая или поглощаемая при растворении 1 моля вещества, называется теплотой растворения Qраств
В соответствии с первым началом термодинамики
где ΔНраств изменение энтальпии при растворении данного количества вещества.
Растворение в воде безводного сульфата меди белого цвета приводит к появлению интенсивной голубой окраски. Образование сольватов, изменение окраски, тепловые эффекты, как и ряд других факторов, свидетельствуют об изменении химической природы компонентов раствора при его образовании.
Таким образом, в соответствии с современными представлениями, растворение физико-химический процесс, в котором играют роль как физические, так и химические виды взаимодействия.
Источник
Универсальный растворитель – определение и характеристики
Универсальное определение растворителя
Вода это вещество, которое мы называем универсальным растворитель, Растворитель – это просто жидкость, в которой могут растворяться другие вещества, и причина, по которой вода получила ярлык универсального растворителя, заключается в том, что никакой другой растворитель не может растворить столько веществ, сколько может. Это в основном то, что делает его таким важным для жизни на земле. Кроме того, удивительно, что каждый водоем, найденный на земле, включая лед, поддерживает ту или иную форму жизни, которая адаптировалась к температуре и давлению, обнаруженному в этой форме воды.
Тот простой факт, что ученым всегда интересно находить воду, связанную с жизнью, на других планетах, многое говорит об этом, казалось бы, простом веществе. Вода является наиболее распространенным веществом в организмах и клетках. Конечно, есть много очевидных применений для воды, таких как питье, мытье и тушение пожаров, и это благодаря характеристикам, которыми он обладает, которые делают его универсальным растворителем. Вода очень важна для жизни, потому что для многих важных реакций в организме организмов необходима водная среда. Например, вода необходима для переваривания белков в аминокислоты, И в фотосинтез и пищеварение.
Характеристики универсального растворителя
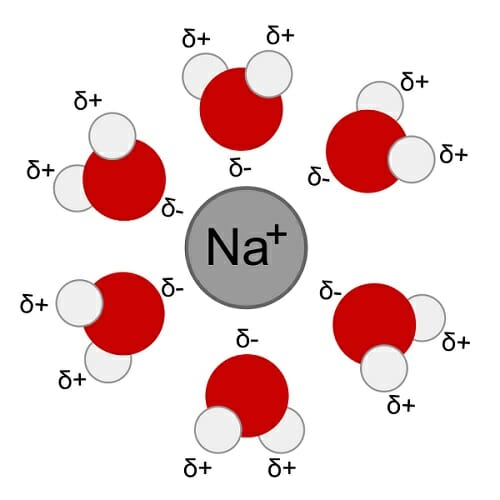
полярность
Это большая часть того, почему вода является универсальным растворителем. Полярность – это неравномерность распределения электронов в молекула, что приводит к одной молекуле, имеющей две противоположные стороны; один отрицательный и один положительный. Теперь вода имеет молекулярную формулу H2O, поэтому каждая молекула воды имеет два атома водорода и один атом кислорода, как вы можете видеть на диаграмме ниже. Атомы водорода не находятся на противоположных сторонах друг друга, и они несут частичный положительный заряд. Это означает, что они создают положительно заряженную часть молекулы, в то время как кислородный конец создает отрицательно заряженную часть. Эта полярность означает, что вода может присоединяться и, следовательно, растворять полярные и ионные (заряженные) вещества.
Высокая удельная теплоемкость
Количество энергии, необходимое для повышения температуры одного грамма воды на 1 градус Цельсия, является ее удельной теплотой, и при одной калории на грамм она намного выше, чем удельная теплоемкость большинства жидкостей. Это хорошая новость для нас, так как мы на 60% состоим из воды, и мы не смогли бы выжить, если бы наши тела сильно и быстро остыли и нагрелись. Это также имеет решающее значение для выживания всех других организмов, в том числе водных организмов. Это означает, что океаны и реки не замерзают постоянно или не испаряются при изменении температуры. Если вода не может стабилизировать свою температуру, энергия, которая выделяется во время обмена веществ в живых организмах, может привести к перегреву и смерти.
Уникальные свойства плотности и температуры
Когда мы помещаем кубик льда в воду, он плавает, и, к счастью, то же самое относится и к айсбергу. Если бы лед был более плотным, чем вода, он бы постоянно замерзал наверху, а затем опускался, пока все водоемы не превратятся в лед, уничтожая всю жизнь. Вода также существует в виде газа, жидкости и твердого вещества в очень небольшом диапазоне температур, что означает, что мы можем найти ее во всех трех формах на Земле в зависимости от того, где мы находимся, и часто в одном и том же месте. Это не часто встречающаяся собственность.
- растворенное вещество – Это вещество, которое растворяется в другом растворителе.
- Ковалентная связь – Распределение электронов между атомами с образованием молекулы.
- Круговорот воды – Процесс циркуляции воды между различными элементами земли – атмосферой, землей и океанами.
- метаболизм – Все химические реакции, происходящие внутри живых организмов.
викторина
1. Вода считается полярной, потому что:A. У этого есть одна отрицательная сторона и другая, которая является положительной.B. Это универсальный растворитель.C. У него два атома водорода.D. Это самый плотный в твердой форме.
Ответ на вопрос № 1
верно. У воды есть сторона, которая немного положительна, и сторона, которая слегка отрицательна.
2. Что из следующего является силой, которая удерживает молекулы воды вместе?A. Ковалентные связи B. Ионные связиC. Полярные связиD. Водородные связи
Ответ на вопрос № 2
D верно. Водородные связи образуются между атомами кислорода и атомами водорода различных молекул воды.
3. Какое свойство относится к слипшимся молекулам воды?A. прилипание B. полярностьC. когезияD. Быть универсальным растворителем
Ответ на вопрос № 3
С верно. Силы сцепления, вызванные водородными связями, делают воду эластичной.
Источник
Что такое универсальный растворитель?
универсальный растворитель это вещество способно растворять широкий спектр растворенных веществ или химических веществ. Вещество, которое считается универсальным растворителем, является вода, а затем объясняет, почему в соответствии с его свойствами.
Если мы думаем о лимонаде, необходимы три ингредиента: вода, лимоны и сахар. Добавляя сахар, он легко растворяется в лимонаде, напитке, который использует воду в качестве основы..
Простой пример, как лимонад, служит для демонстрации свойств воды в действии. Вода известна как «универсальный растворитель» по преимуществу.
Однако, хотя вода является самым известным растворителем и одним из самых важных, она не является единственным растворителем, используемым в химической промышленности..
Что такое растворитель?
Растворитель — это просто вещество, которое может растворять другие молекулы и соединения, известные как растворенные вещества. Гомогенная смесь растворителя с растворенным веществом известна как раствор.
Растворитель всегда находится в жидком состоянии, в то время как растворенное вещество может присутствовать в твердом, жидком или газообразном состоянии..
Примерами растворителей являются вода, олово, спирт, молоко. Примерами растворенных веществ являются сахар, соль, уксусная кислота. Примером раствора является солевой раствор, образованный водой и солью.
Растворители являются частью различных применений, таких как фармацевтические препараты, синтетические материалы, краски и клеи.
Почему вода считается универсальным растворителем?
Наше тело работает через химические изменения, которые происходят на клеточном уровне. Точно так же растения и животные страдают химическими изменениями в своих организмах..
Эти изменения происходят в водных растворах или растворах, в которых вода является основным растворителем..
Поскольку вода обладает свойствами полярности (отрицательный и положительный заряд) и способностью образовывать водородные связи, она считается отличным растворителем.
Способность воды растворять большое разнообразие молекул является ключом для этих химических реакций, происходящих в организмах. Отсюда важность воды для жизни на планете..
Благодаря своей способности растворять большое количество растворенных веществ, больше, чем любая другая жидкость, вода известна как «универсальный растворитель». Важно отметить, что не все вещества хорошо растворяются в воде, например, масла.
Молекулы масел не имеют областей заряда ни положительных, ни отрицательных, поэтому они не притягиваются молекулами воды.
Молекулы воды состоят из атомов водорода и кислорода. Водород имеет положительный заряд, а кислород — отрицательный, что позволяет молекулам воды притягиваться ко многим различным типам молекул и, следовательно, способно растворять их.
Есть и другие свойства воды, такие как поверхностное натяжение, ее уникальная плотность и температура, которые позволяют воде быть отличным растворителем..
Вода существует в трех возможных формах, таких как газ, жидкость или твердое вещество, что обычно не встречается в других растворителях.
Источник